蓝莓根部内生木霉分离鉴定及其拮抗作用
2022-07-05尚晓静张富美
李 思 尚晓静 张富美 侯 瑞
(贵州大学林学院,贵州 贵阳 550025)
蓝莓(Vacciniumuliginosum)为杜鹃花科(Ericaceae)越橘属(Vaccinium)植物[1]。蓝莓果实除普通水果含有的矿物质营养外,还含有丰富的花青素、黄酮、多酚、尼克酸、超氧化物歧化酶(superoxide dismutase, SOD)等物质[2]。其中花青素具有较强的抗氧化活性,是传统抗氧化剂的20~50倍[3]。此外,蓝莓叶片中富含的酚类物质是一种潜在的抗氧化酚类资源[4]。蓝莓因其极高的营养价值和经济价值在中国种植面积逐年增加[5-6]。贵州省草莓主栽区为贵阳、麻江、息烽、凤岗等地,种植品种主要为兔眼和高丛[7-8]。但由尖镰孢菌(Fusariumoxysporum)[9]造成的蓝莓根腐病,盘孢属(Colletotrichumgloeosporioides)造成的蓝莓炭疽病[10]和链格孢属(Alternaria)造成的蓝莓叶斑病[11],成为近年来限制贵州蓝莓产业发展的重要因素。
内生真菌指在生活史的某段时期生活于植物组织内部,但是没有引起明显植物病害症状的真菌[12]。内生真菌在植物组织中普遍存在,具有丰富的物种多样性,主要栖息在植物的根部、茎部以及叶部[13-14]。木霉属(Trichoderma)是常见的内生真菌,在自然界中分布十分广泛,主要存在于森林、草地、农田、坡沟等较为潮湿的环境中,定植于植物根部可以增强根的生长,提高植物的抗逆性和抗病性,是重要的生防微生物资源[15-17]。研究发现,木霉菌对山豆根根腐病菌茄腐镰孢(Fusariumsolani)[18]、黄瓜枯萎病(F.oxysporumf. sp.cucumerinum)[19]、小麦全蚀病菌(Gaeumannomycesgraminisvar.tritici)和小麦根腐病菌(Bipolarissorokiniana)[20-21]等均具有抑制作用,说明木霉菌具有竞争优势显著、生长速度大于病原菌、抑制病原菌菌丝生长的特点,同时表明木霉菌具有广谱性,对不同病原菌均能表现出良好的拮抗作用。木霉菌可以有效抑制镰孢属真菌产生玉米烯酮等真菌毒素,从而减少其对田间作物的污染,提高农产品的产量和质量[22]。此外,木霉菌和其他生物材料对植物根际土壤微生物区系具有一定影响,郭成瑾等[23]用哈茨木霉(T.harzianum)M-33协同小麦秸秆对马铃薯进行处理后,其根际土壤真菌数量较对照降低29.54%,细菌、放线菌和木霉菌的数量分别较对照提高75.36%、60.58%和1 407.27%,表明木霉菌和小麦秸协同处理能够促进马铃薯根际土壤中有益微生物的聚集。
蓝莓根部内生真菌具有多样性,但有关蓝莓根部内生木霉多样性和功能的报道较少[24]。此外,不同菌株的田间防治效果差异较大,发掘新的高效菌株对生物防治具有重要意义。因此本研究从贵州省蓝莓主栽区贵阳市花溪高坡生态蓝莓园健康蓝莓植株根部中分离纯化到16株内生木霉菌株,分析其多样性并对其生防效果进行测试、筛选高效抑菌菌株,以期为贵州省蓝莓病害防治提供参考。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 供试蓝莓植株采自贵州省贵阳市花溪高坡生态蓝莓园(106°50′14E,26°16′46″N),选取5至8年生健康兔眼蓝莓品种圆蓝和粉蓝、高丛蓝莓品种莱格西和奥尼尔根部,供分离内生真菌使用。
1.1.2 植物病原真菌 7种供试植物病原真菌为蓝莓根腐病病原菌(尖镰孢菌Fusariumoxysporum)、蓝莓枝枯病病原菌(小新壳梭孢Neofusicoccumparvum)、蓝莓枝枯病病原菌(Diaporthelongicolla)、蓝莓叶斑病病原菌(交链格孢菌Alternariaalternata)、蓝莓叶斑病病原菌(胶孢炭疽菌Colletotrichumgloeosporioides)、辣椒炭疽病病原菌(尖孢炭疽菌Colletotrichumacutatum)、小麦赤霉病病原菌(禾谷镰孢菌Fusariumgraminearum),以上7种病原真菌均保存于贵州大学林学院森林病理实验室,4℃冰箱备用。
1.2 试验方法
1.2.1 蓝莓根部内生真菌分离培养 利用组织分离法对蓝莓根部内生真菌进行分离培养,选取表面健康无病斑的蓝莓根部,用清水洗净后晾干。在超净工作台中,将表面健康无病斑的蓝莓根在75%乙醇溶液中浸3 s,用无菌水冲洗5次,转入3%(v/v)NaClO溶液中消毒3 min,用无菌水冲洗5次,放入75%乙醇消毒30 s,再用无菌水冲洗5次并吸干表面水分,在每个马铃薯葡萄糖培养基(potato dextrose agar, PDA)中放5段蓝莓根段,重复20个PDA培养基,置于28℃恒温培养箱培养3~5 d;同时采用植物组织印记法,将表面消毒的蓝莓根直接在培养基表面轻抹,相同条件下培养5个PDA培养基作为对照。利用真菌菌落边缘挑取法,挑取PDA平板培养基中生长形态差异典型的真菌转接至新的PDA培养基,置于28℃恒温培养箱培养,纯化3~5次。
1.2.2 内生真菌鉴定 采用十六烷基三甲基溴化铵法(hexadecyl trimethyl ammonium bromide, CTAB)法[25]提取内生真菌DNA。利用通用扩增引物ITS和EF-1ɑ鉴定内生真菌,扩增菌株核糖体DNA内部转录间隔序列。参考王娜等[26]的方法对内生真菌rDNA-ITS、EF-1ɑ区段进行聚合酶链式反应(polymerase chain reaction, PCR)扩增以及产物纯化。PCR扩增产物送至重庆擎科生物测试公司进行切胶、纯化和测序。修正后的内生真菌测序片段利用NCBI数据库中BLASTN对测序结果进行对比分析。为了解每个样品受侵染的发生频率,评价蓝莓样品中内生真菌的组成及其丰富程度。分别统计内生真菌的分离率(isolation rate, IR)[27]、分离频率(isolation frequency, IF)[28]、香农-维纳指数(Shannon-Weiner index,H′)、辛普森多样性指数(Simpson index, D)、丰富度指数(Margalef index, M)、均匀度指数(Pielou index, E)[29-30]。
(1)
(2)
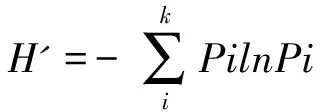
(3)
D=1-∑Pi2
(4)
(5)
(6)。
式中,N为菌株总数,Pi某种属内生真菌的菌株数量占分离到的所有总菌株数量的百分数,S为物种数。
1.2.3 木霉菌对植物病原真菌的拮抗作用 参考刘青等[31]的平板对峙法测定内生木霉菌对7种植物病原真菌的拮抗作用。在超净台上用直径5 mm的无菌打孔器截取新鲜内生木霉菌和植物病原菌菌丝接种于90 mm PDA平板两侧,使木霉菌和植物病原菌直径相距50 mm,只在PDA平板中接种病原菌为对照(CK)。重复3组,置于28℃恒温培养箱培养7 d。测量CK病原菌菌落直径和处理组病原菌菌落直径。按公式(7)计算抑制率:
抑制率=
(7)。
1.2.4 无菌发酵液抑菌活性鉴定 选取5株对峙效果较好的木霉菌单独进行无菌发酵液抑菌试验。将5块直径为5 mm的新鲜木霉菌丝块接种于装有100 mL马铃薯葡萄糖水培养基(potato dextrose broth, PDB)溶液的250 mL锥形瓶中,置于28℃、160 r·min-1恒温震荡培养箱中培养7 d后,在超净工作台中,将经过4层无菌纱布过滤和经细菌过滤器(0.22 μm)后的滤液,与经120℃灭菌30 min的PDA以3∶2的比例混合,制作发酵液抑菌平板,待平板冷却后,用直径5 mm的无菌打孔器截取新鲜病原菌菌丝块置于抑菌平板中央,于28℃恒温培养箱培养5 d,观察并记录病原菌的菌落直径,按公式(7)计算抑制率。
1.2.5 数据分析 蓝莓根部内生木霉多样性采用Excel 2016和Origin 2018软件进行统计和分析,抑菌率采用Excel 2016和SPSS 25软件进行统计和分析。
2 结果与分析
2.1 蓝莓根部内生木霉种类鉴定
由表1可知,利用组织分离法共分离获得菌落形态具有明显差异的木霉菌16株。通过对rDNA-ITS和EF-1α基因序列进行比对,将16株木霉菌分为4个种,这些菌株与NCBI数据库中已知木霉菌rDNA-ITS和EF-1α基因序列相似性均达98%~100%,两种序列测序结果一致,同源性高。16株蓝莓根部内生木霉,T.harzianum为优势种,共有6株,占木霉菌株总数的37.5%;T.virens次之,共有5株,占木霉菌株总数的31.25%;T.koningiopsis3株,占木霉菌株总数的18.75%;T.pubescens数量最少,共有2株,占木霉菌株总数的12.5%。
2.2 蓝莓根部内生木霉系统发育树分析
将16株木霉菌株(GF10、GF39、GL41、GL43、GY38、GA8、GA20、GF31、GF32、GL14、GL15、GL16、GL19、GL39、GL42)送至重庆擎科生物技术有限公司进行测序,获得测序结果后登录GenBank,上述菌株分别得到IST序列登录号MW750422、MW750423、MW750424、MW750425、MW750426、MW750427、MW750428、MW750429、MW750430、MW750431、MW750432、MW750433、MW750434、MW750435、MW750436;GL11、GF39、GL41、GL43、GY38、GA8、GA20、GF31、GF32、GL14、GL15、GL16、GL19、GL39、GL42分别得到EF-1α基因序列登录号MW812395、MW812396、MW812397、MW812398、MW812399、MW812400、MW812401、MW812402、MW812403、MW812404、MW812405、MW812406、MW812407、MW812408、MW812409。将ITS序列与BLASTN比对结果中同属不同种的序列进行多序列比对分析,同时引入Fusariumoxysporum、Nectriaberolinensis两个外源属利用MEGA 7.0软件中的Clustal W进行多序列比对,采用MEGA 7.0中邻接法(neighbor-joining)构建系统发育树。结果发现,菌株GL42、GF31、GF32、GF39与T.virens相似性为100%(图1-A);菌株GY38、GL41、GL43与T.koningiopsis相似性为100%(图1-B);菌株GA20、GA8与T.pubescens聚为一类,相似性为99%(图1-C);菌株GL11、GL14、GL15、GL16、GL19、GL39与T.harzianum聚为一类,相似性为99%(图1-D)。结合菌落形态特征(图2)、显微形态特征(图3)鉴定16株内生真菌分为T.virens、T.pubescens、T.harzianum、T.koningiopsis4种。
2.3 蓝莓根部内生木霉菌多样性
从花溪高坡生态蓝莓园根部共分离得到103株内生真菌,木霉菌株16株,分离样品组织块总数为200。对分离得到的16株内生木霉菌进行多样性分析可知(表2),木霉菌总分离率为8%,分离频率为15.53%,Shannon-Weiner多样性指数为0.450 8,Simpson 多样性指数为0.988 7,Pielou均匀度指数为0.345 0,Margalef丰富度指数为2.408 2。其中粉蓝、莱格西、奥尼尔和圆蓝4个蓝莓品种木霉菌分离率分别为8%、18%、4%、2%(图4)。
2.4 蓝莓根部内生木霉对7种植物病原真菌抑制效果
挑选典型木霉菌与7种植物病原真菌对峙效果图(图5),从图中看出,木霉菌生长速度大于植物病原菌,培养至7 d时,木霉菌与病原菌完全接触并抑制其菌落的生长,使病原菌菌丝生长速度变慢,甚至不再生长。对交链格孢菌,禾谷镰孢菌,D.longicolla、小新壳梭孢、尖镰孢菌、胶孢炭疽菌、尖孢炭疽菌的抑制率分别为35.01%~76.38%、52.24%~67.68%、58.43%~73.53%、51.18%~70.00%、26.21%~52.99%、37.18%~66.76%、37.37%~70.53%。其中GL15对交链格孢菌,GL19对禾谷镰孢菌,GL39对D.longicolla,小新壳梭孢和尖镰孢菌,GL42对胶孢炭疽菌和尖孢炭疽菌的抑制率最高,分别为76.38%、67.68%、73.53%、70.00%、52.99%、66.76%、70.53%。
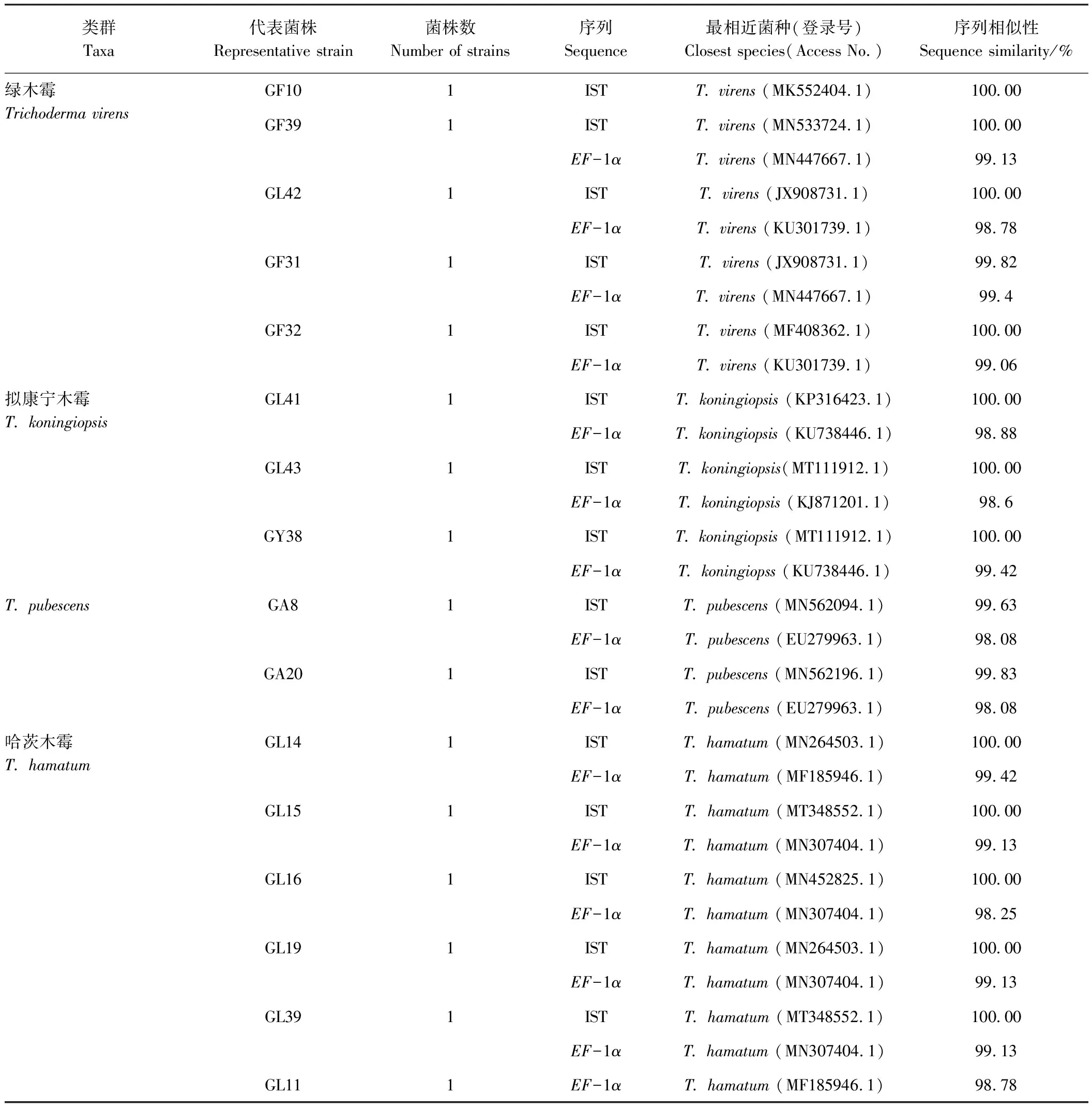
表1 蓝莓根部内生木霉序列相似性分析Table 1 Sequence similarity analysis of Trichoderma endophyte from blueberry roots

表2 蓝莓根部内生木霉菌多样性Table 2 Diversity of endophytic Trichoderma in blueberry roots
综合分析可知,16株木霉菌对尖镰孢菌的抑制效果最差,对禾谷镰孢菌、D.longicolla、小新壳梭孢的抑制效果最好,表明不同木霉菌对不同病原菌的抑制作用存在一定差异(表3)。
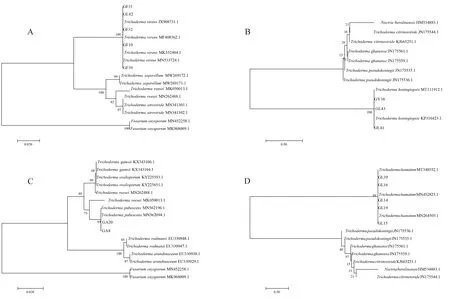
图1 蓝莓根部内生木霉IST序列系统发育树Fig.1 IST Phylogenetic tree of endophytic Trichoderma in blueberry roots
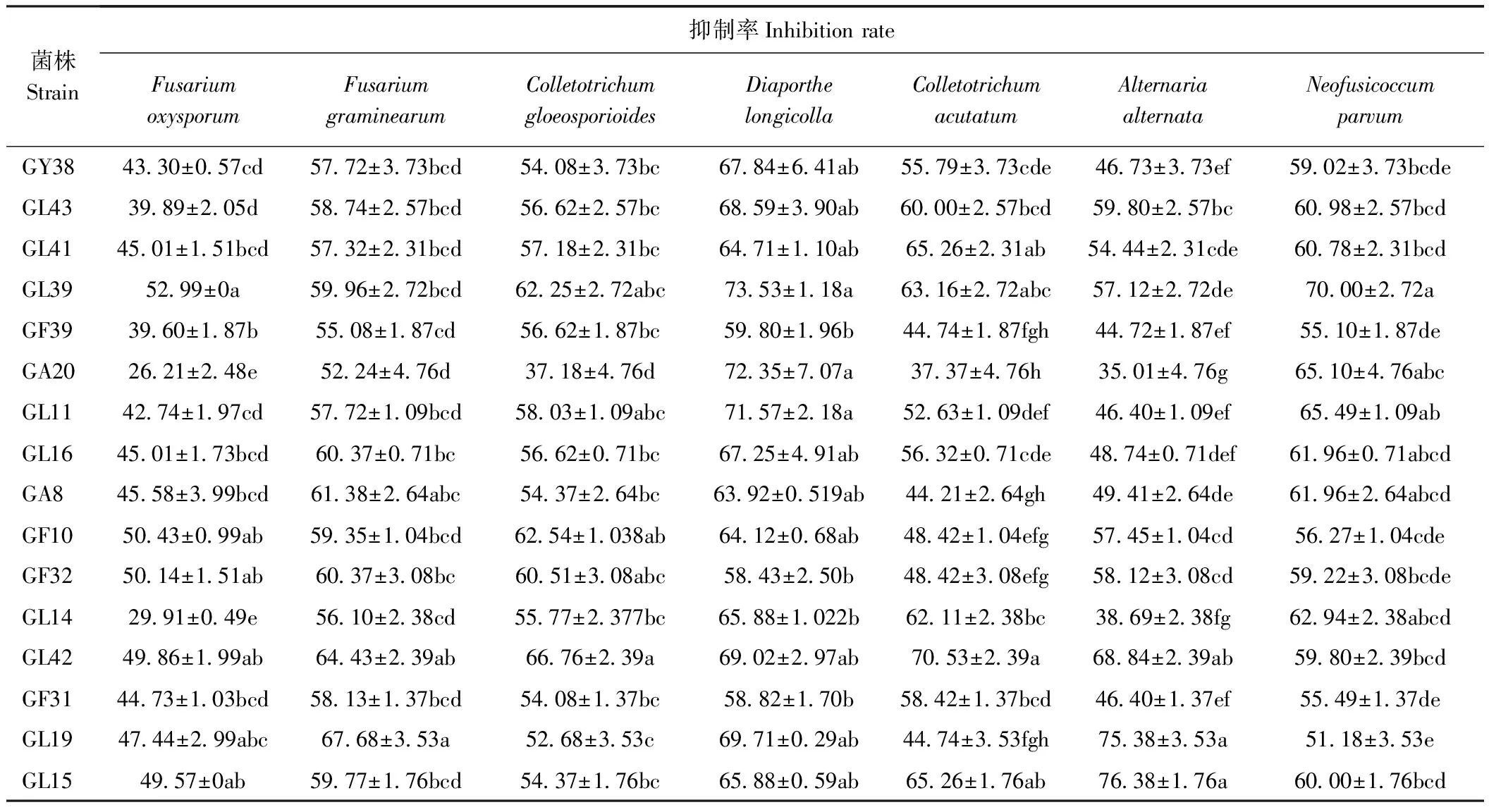
表3 蓝莓根部内生木霉菌对7种植物病原真菌的抑制效果Table 3 Inhibitory effects of endophytic Trichoderma in blueberry roots on 7 phytopathogenic fungi /%
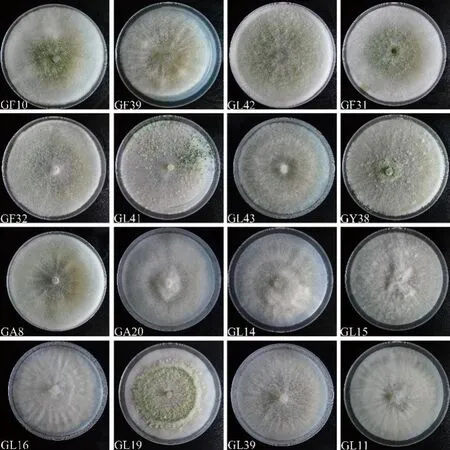
注:菌株GF10、GF39、GL42、GF31、GF32为T. virens;菌株GL41、GL43、GY38 为 T. koningiopsis;菌株GA8、GA20 为 T. pubescens;菌株 GL14、GL15、GL16、GL19、GL39、GL11 为 T. hamatum。Note: Strains GF10、GF39、GL42、GF31、GF32 are T. virens. Strains GL41、GL43、GY38 are T. koningiopsis. Strains GA8、GA20 are T. pubescens. Strains GL14、GL15、GL16、GL19、GL39、GL11 are T. hamatum.图2 蓝莓根部内生木霉菌落形态Fig.2 Colony morphology of endophytic Trichoderma in blueberry roots
2.5 蓝莓根部内生木霉菌发酵液对7种植物病原真菌抑制效果
结合对峙结果选择T.harzianumGL11、T.harzianumGL15、T.harzianumGL19、T.harzianumGL39、T.virensGL42菌株共5株木霉菌进行无菌发酵液试验,探究5株木霉菌发酵液对7种植物病原真菌的抑制效果。结果显示,培养5 d后,除小新壳梭孢外,5株木霉菌发酵液均对其余6种植物病原菌具有一定的抑制作用,但不同或同种木霉菌发酵液对植物病原菌抑制效果之间具有一定的显著差异(P<0.05)(图6、表4)。其中GL11发酵液对尖镰孢菌、胶孢炭疽菌的抑制效果最好,分别为17.95%、44.55%;GL15发酵液对Diaporthelongicolla、尖孢炭疽菌、交链格孢菌的抑制效果最好,抑制率分别为46.71%、36.49%、23.41%;GL19发酵液对禾谷镰孢菌的抑制效果最好,抑制率为37.53%。
3 讨论
目前关于蓝苺内生木霉的研究报道较少[32-33],本研究从蓝莓根部分离的16株内生木霉菌分为T.virens、T.koningiopsis、T.harzianum、T.pubescens4种,其中T.harzianum为优势种,占木霉菌株总数的37.5%。叶馨等[34]从芦苇Phragmitesaustralis根中分离纯化得到长枝木霉T.longibrachiatum和桔绿木霉T.citrinoviride2种木雷菌;曲明星等[35]从柞树的须根分离出Trichodermahamatum、T.virens、T.citrinoviride等12种木霉菌。说明植物根系中木霉菌具有多样性,与本研究结果一致。木霉菌存在于绝大多数植物组织中,刘凤红[36]证明蓝莓根系内生真菌除镰孢属(Fusarium)外,木霉属(Trichoderma)同样为优势种群;任玮等[37]用组织分离法从兰科植物杜鹃兰(Cremastraappendiculata)根中分离出木霉属;张清华等[38]从桉树(Eucalyptusspp.)叶片中分离得到哈茨木霉(T.harzianum),并证明其菌丝能够覆盖桉树焦枯病菌(Calonectriapseudoreteaudii)菌落抑制病原菌生长。本研究利用平板对峙法探究16株木霉菌对7种植物病原菌(交链格孢菌、禾谷镰孢菌、Diaporthelongicolla、小新壳梭孢、尖镰孢菌、胶孢炭疽菌、尖孢炭疽菌)的抑制效果,结果显示,16株木霉菌株对7种病原菌均有抑制效果,最高抑制率分别为76.38%、67.68%、73.53%、70.00%、52.99%、66.76%、70.53%,其中对尖孢炭疽菌和胶孢炭疽菌抑制效果最好的是T.virens,对其余6种病原真菌抑制效果最好的是哈茨木霉。Wang等[39]研究表明T.harzianumTh62菌株对土壤传播的植物病原菌、尖镰孢菌、交链格孢菌等具有明显的拮抗作用;此外,哈茨木霉对烟草青枯病[40]、西瓜枯萎病[41]、柑桔绿霉病[42]等植物病害防治作用被广泛研究。5株木霉菌发酵液对7种植物病原真菌的抑制结果显示,除小新壳梭孢以外,5株木霉菌发酵液对其他6植物病原菌均有抑制效果,对Diaporthelongicolla、胶孢炭疽菌、禾谷镰孢菌、尖孢炭疽菌、交链格孢菌、尖镰孢菌的最高抑制率分别为46.71%、44.55%、37.53%、36.49%、23.41%、17.95%,其中无菌发酵液对6种病原菌抑制效果最好的是T.harzianum,可能是由于不同木霉菌株产生的代谢产物不同,导致其对不同或同种病原菌的抑制作用存在差异[43]。无菌发酵液对7种植物病原菌的抑制效果较差或没有效果,可能的原因有:木霉菌发酵液浓度不够高[44-45];木霉菌发酵液中产生的几丁质酶、多糖[46]、酸和酯类[47]等非挥发性物质较少,可在后续工作中通过对发酵时间、温度、初始pH值的调控,提高生防真菌发酵液的抑菌率[48]。
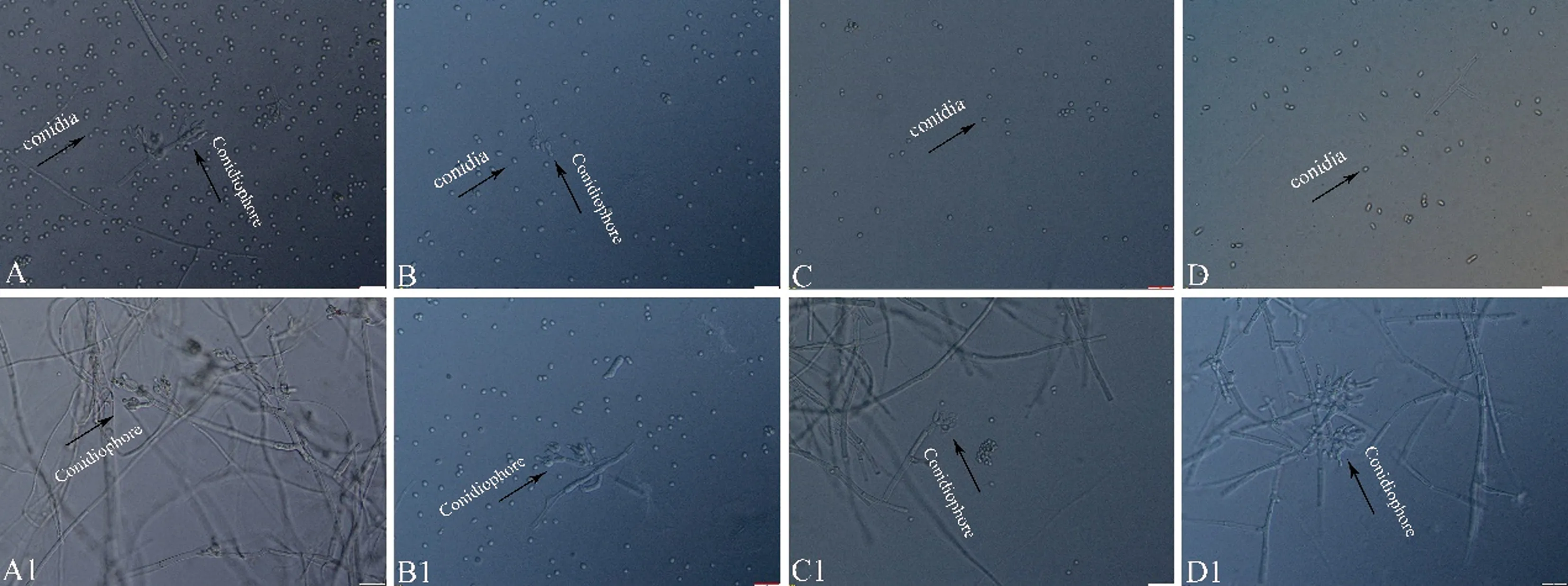
注: A、A1分别为T. virens GL42的分子孢子和分生孢子梗;B、B1分别为T. koningiopsis GL41的分生孢子和分生孢子梗;C、C1分别为T. pubescens GA8的分生孢子和分生孢子梗;D、D1分别为T. hamatum GL19的分生孢子和分生孢子梗。标尺=20 μm。Note: A, A1 are conidia and conidiophore of T. virens GL42, respectively. B, B1 are conidia and conidiophore of T. koningiopsis GL41, respectively. C, C1 are conidia and conidiophore of T. pubescens GA8, respectively. D, D1 are conidia and conidiophore of T. hamatum GL19, respectively. Scale bar=20 μm.图3 蓝莓根部内生木霉显微形态特征图Fig.3 Micromorphological characteristics of endophytic Trichoderma in the root of blueberry
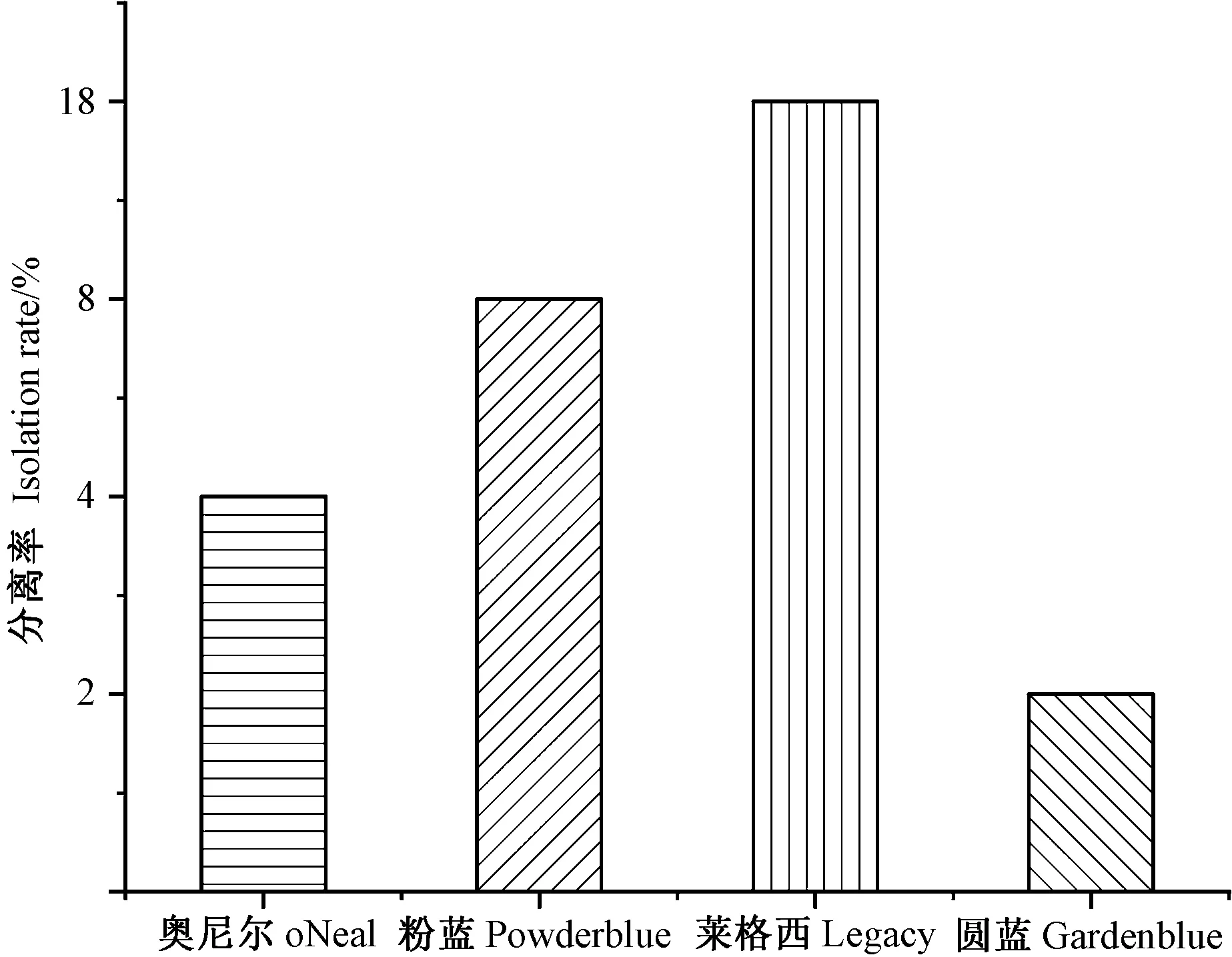
图4 不同蓝莓品种木霉菌分离率Fig.4 Separation rate of Trichoderma from different blueberry varieties
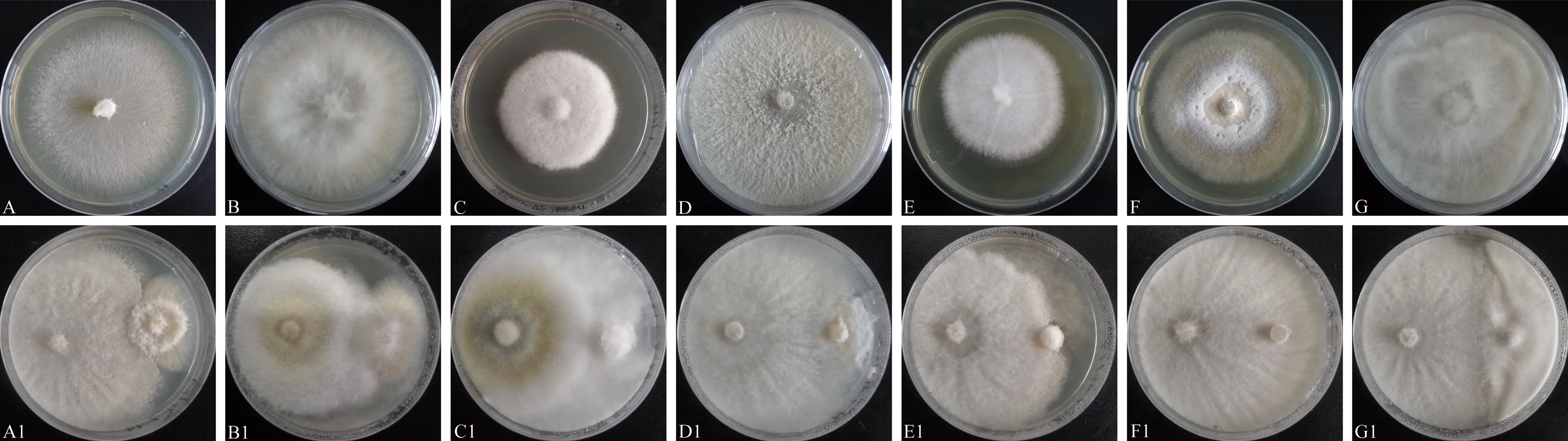
注:A~G分别为病原菌尖镰孢菌、禾谷镰孢菌、胶孢炭疽菌、Diaporthe longicolla、尖孢炭疽菌、交链格孢菌、小新壳梭孢,下同; A1为T. harzianum GL15与尖镰孢菌对峙效果;B1为T. virens GL42与禾谷镰孢菌对峙效果;C1为T. virens GF31与胶孢炭疽菌对峙效果;D1为T. harzianum GL11与Diaporthe longicolla对峙效果;E1为T. harzianum G15与尖孢炭疽菌对峙效果;F1为 T. harzianum GL19与交链格孢菌对 峙效果;G1为T. harzianum G15与小新壳梭孢对峙效果(左边为木霉菌株,右边为病原菌)。Note: A~G are the pathogen Fusarium oxysporum, Fusarium graminearum, Colletotrichum loeosporioides, Diaporthe longicolla, Colletotrichum acutatum, Alternaria alternata, Neofusicoccum parvum, the same as following. A1 is the confrontation effect between T. harzianum GL15 and Fusarium oxysporum. B1 is the confrontation effect between T. virens GL42 and Fusarium graminearum. C1 is the confrontation effect between T. virens GF31 and Colletotrichum gloeosporioides. D1 is the confrontation effect between T. harzianum GL11 and Diaporthe longicolla. E1 is the confrontation effect between T. harzianum G15 and Colletotrichum acutatum. F1 is the confrontation effect between T. harzianum GL19 and Alternaria alternata. G1 is the confrontation effect between T. harzianum G15 and Neofusicoccum parvum (Trichoderma strain is on the left, pathogenic bacteria on the right).图5 蓝莓根部内生木霉菌与7种植物病原真菌部分拮抗效果图Fig.5 The effect of antogonism confrontation between endophytic Trichoderma in blueberry roots and 7 kinds of plant pathogenic fungi
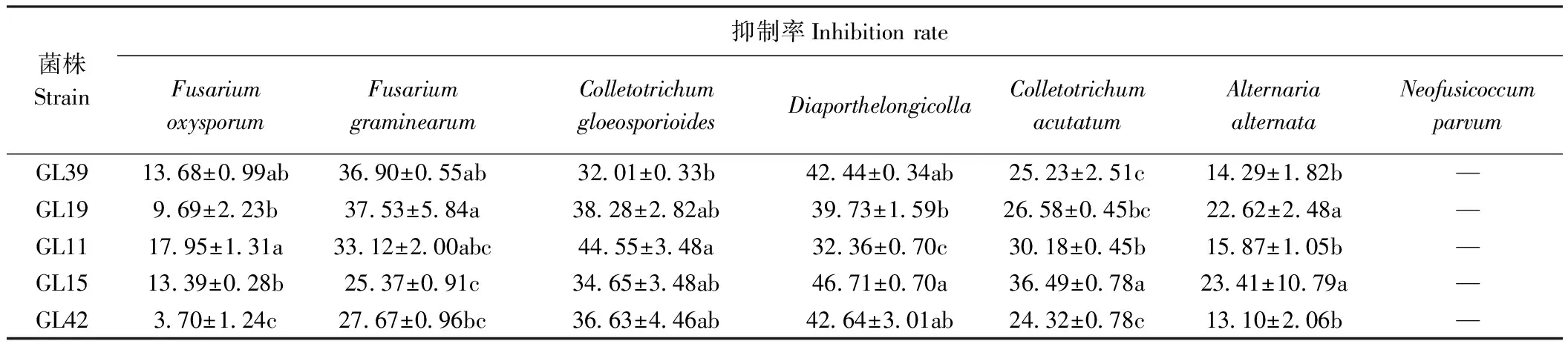
表4 蓝莓根部内生木霉菌发酵液对7种植物病原真菌抑制效果Table 4 The inhibitory effect of the fermentation broth of endophytic Trichoderma from blueberry roots on 7 kinds of plant pathogenic fungi /%
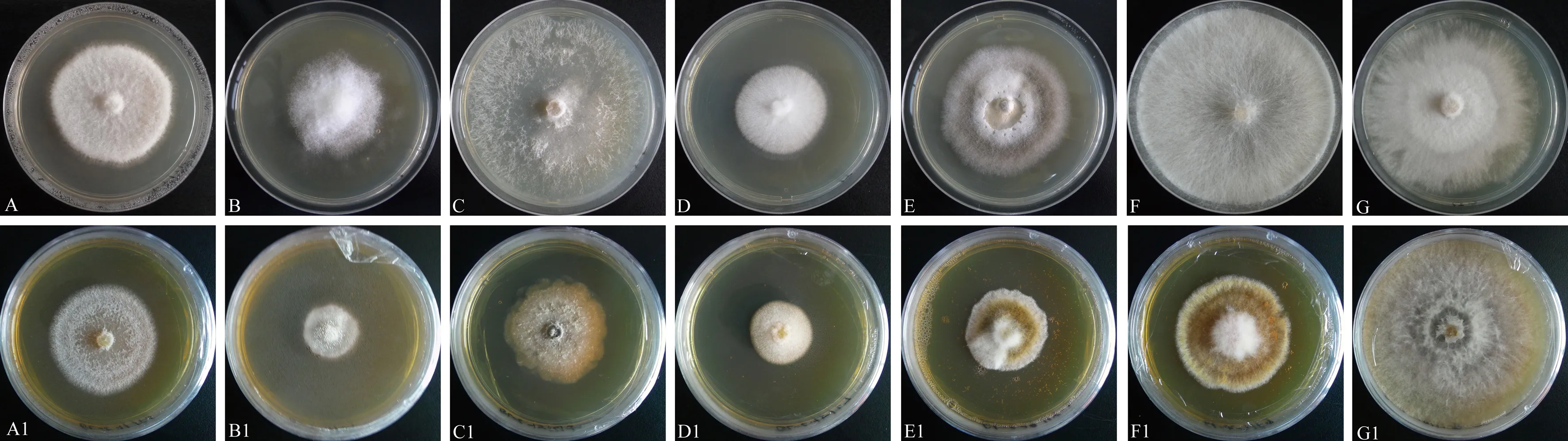
注:A1、B1为T. harzianum GL11发酵液对尖镰孢菌和胶孢炭疽菌抑制效果图;C1、D1为T. harzianum GL15发酵液对Diaporthe longicolla和尖孢炭疽菌抑制效果图;E1为T. harzianum GL19发酵液对交链格孢菌抑制效果图;F1、G1为T. harzianum GL39发酵液对 禾谷镰孢菌和小新壳梭孢的抑制效果图。Note: A1 and B1 are the inhibitory effects of T. harzianum GL11 fermentation broth on Fusarium oxysporum and Colletotrichum gloeosporioides. C1 and D1 are the inhibitory effects of T. harzianum GL15 fermentation broth on Diaporthe longicolla and Colletotrichum acutatum. E1 is a graph of the inhibitory effect of T. harzianum GL19 fermentation broth on Alternaria alternata. F1 and G1 are graphs of the inhibitory effect of T. harzianum GL39 fermentation broth on Fusarium graminearum and Neofusicoccum parvum.图6 蓝莓根部内生木霉菌发酵液对7种植物病原真菌部分拮抗效果Fig.6 The antagonism effect of the fermentation broth of blueberry root endophytic Trichoderma on 7 kinds of plant pathogenic fungi
4 结论
本研究从贵州省贵阳市花溪高坡生态蓝莓园蓝莓根部分离内生木霉,研究其多样性及对植物病原的拮抗作用,共获得16株4种木霉菌。对峙培养结果表明不同木霉菌对7种病原菌均有较好的抑制效果且抑制效果存在差异,最高为76.38%。5株发酵液对除小新壳梭孢外的6种病原菌具有抑制效果,但抑制率较对峙培养低,最高仅为46.71%。表明蓝莓根部内生木霉具多样性且对病原菌有拮抗作用,可用于蓝莓病害防治。后期可进一步研究蓝莓根部剩余的87株内生真菌的多样性及生防效果,筛选高效抑菌菌株,从而为蓝莓病害防治提供参考。
