甘蓝型油菜BnaLPAT4基因功能研究
2022-07-05肖旦望陈婉瑜熊兴华
刘 勇 肖旦望 秦 艺 陈 静 陈婉瑜 熊兴华,*
(1 湖南农业大学国家油料改良中心湖南分中心,湖南 长沙 410128;2 湖南农业大学农学院/湖南省水稻油菜抗病育种重点实验室, 湖南 长沙 410128)
三酰甘油(triglycerides,TAG)是植物种子中油脂的主要储藏形式,在生物体内均通过酶促机制合成[1-2]。溶血磷脂酸酰基转移酶(lysophosphatidic acid acyltransferase,LPAT)是TAG生物合成的重要限速酶,在植物油脂合成、种子发育以及生物膜形成等方面有重大作用[3-5]。脂肪酸在植物种子中主要以TAG的形式存在,是构成植物油脂的主要成分,并参与植物多数代谢反应[6-8]。菜籽油中富含人体所需的多种长链多不饱和脂肪酸,营养价值可与橄榄油(Olea)媲美[9-10]。LPAT基因具有调控Kennedy途径中的长链多不饱和脂肪酸装配TAG的sn-2位上的功能[11-13]。尹永泰[14]通过同源克隆甘蓝型油菜BnaLPATs基因并进行亚细胞定位发现,BnaLPAT1基因定位于叶绿体,属于质体型LPAT,其他拷贝均定位于内质网,属于微粒体型LPAT,并对LPAT基因功能进行了初步鉴定。肖旦望等[15]通过GUS基因染色法(B-Glucuronidase)确定了BnaLPAT4基因主要在油菜花器官和角果中表达,推测BnaLPAT4基因具有调控油菜油脂合成的功能。为验证BnaLPAT4基因对甘蓝型油菜油脂合成的影响,提高油菜种子油脂含量,本试验通过参考洪波等[16]的方法构建BnaLPAT4表达载体转化酵母和拟南芥,并通过气相色谱法检测转基因株中的脂肪酸组分,分析BnaLPAT4基因在油菜油脂合成的作用,旨在为指导油菜育种提供一定的理论基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料及菌株 野生型拟南芥(哥伦比亚型)和酿酒酵母菌株(INVSC 1)均由湖南农业大学油料作物研究所提供;甘蓝型油菜湘油15、野生型拟南芥由湖南省水稻油菜重点实验室提供。INVSC 1酵母菌株和YES2.0表达质粒、过表达载体pBI121(napin)-LPAT4的构建均由湖南农业大学重点实验室完成。
1.1.2 试剂材料 质粒提取试剂盒购自上海生工生物股份有限公司;酵母转化试剂盒购自上海懋康生物有限公司;引物由湖南擎科生物公司设计;其他试剂均为分析纯。
1.2 试验方法
1.2.1 拟南芥总RNA提取及cDNA合成 取光照培养箱内生长的拟南芥种子50~100 mg置于2.0 mL离心管中,加入钢珠和液氮后于磨样机中充分研磨,参照北京全式金生物公司植物总RNA提取试剂盒(TransZol Up Plus RNA Kit)说明书提取拟南芥种子总RNA。以拟南芥种子总RNA为模板,通过北京百迈客生物公司反转录试剂盒(BiomarkerScript Ⅱ 1stStrand cDNA Synthesis Kit)合成cDNA第一链。逆转录反应体系20 μL:RNA模板2 μL, d(T)23VN(50 μmol·L-1) 2 μL, 10 mmol·L-1dNTPs 1 μL, ddH2O 3 μL, BiomarkerScript Ⅱ Reaction Mix (2X)10 μL,BiomarkerScript Ⅱ Reaction Mix (10X)2 μL,将上述试剂混合均匀后置于离心机上8 000 r·min-1离心15 s。反应程序:42℃孵育1 h;80℃加热5 min使酶失活; -20℃ 保存。逆转录PCR(reverse transcription-polymerase chain reaction)反应体系10 μL:cDNA 1 μL, 2×Tap Plus Master Mix Ⅱ 5 μL,正反引物各0.4 μL,ddH2O 3.2 μL。反应程序;95℃预变性3 min,95℃变性15 s,60℃退火15 s,72℃延伸20 s,30~35个循环;72℃终延伸7 min,4℃保存。
1.2.2 YES2.0表达载体的构建 甘蓝型油菜BnaLPAT4基因的基因编码序列(coding sequence,CDS)来源于Enesembl plants(http://plants. Ensembl. org/index. html)数据库。CTAB法提取甘蓝型油菜湘油15号叶片DNA,通过Primer 5.0软件设计BnaLPAT4基因克隆引物。在2个基因上游引物5′处添加SacI(GAGCTC)和保护碱基(C),下游引物5′处添加EcoRI(GAATTC)和保护碱基(G),引物设计如表1所示。PCR反应体系为20 μL:cDNA模板1 μL,Tap Polymerase 高保真酶0.5 μL,上下游引物各 1 μL, 2.5 mmol·L-1dNTP 2 μL,10×Buffer 2 μL,ddH2O 12.5 μL。PCR反应程序;95℃预变性3 min;95℃变性15 s,58℃退火15 s,72℃延伸90 s,33个循环;终延伸15 min。取上述反应产物4 μL于1%琼脂糖凝胶中进行检测,使用SacI和EcoRI两种内切酶对回收产物片段和YES2.0表达载体分别进行双酶切。体系为10 μL:10× buffer 1 μL,PCR产物5 μL,Sac I酶0.2 μL,EcoRI酶0.2 μL,ddH2O 3.6 μL。37℃条件下反应过夜,回收酶切片段后,连接至YES2.0载体中。反应体系10 μL:酶切产物2.5 μL,T4 ligease 0.5 μL,载体1 μL,10×buffer 2 μL,ddH2O 4 μL。置于恒温箱中16℃过夜培养。将连接产物转化至大肠杆菌(DH5α)后平板培养,挑选PCR检测为阳性的菌落继续进行无菌恒温培养,通过质粒提取成功获得pGAL::BnaLPAT4-1和pGAL::BnaLPAT4-2阳性质粒。

表1 PCR引物Table 1 PCR primers
1.2.3 转化酵母菌INVSC1 通过醋酸锂法(PEG/LiAC)将已构建成功的pGAL::BnaLPAT4-1和pGAL::BnLPAT4-2表达载体及不含目的基因的YES2.0表达载体分别转入工程菌株INVSC1内,接种于SD-Ura培养基上进行筛选,获得含有目的基因YES2.0载体及空白YES2.0载体的工程菌株。
1.2.4 PBI121表达载体的构建 根据BnaLPAT4基因的CDS序列设计引物(表1),在2个基因上游引物5′处添加BamHI(GGATCC)和保护碱基(CGC),下游引物5′处添加SacI(GAGTC)保护碱基(C)。成功克隆BnLPAT4-1和BnLPAT4-2基因后,通过内切酶SacI和BamHI对目的产物和pBI121质粒进行酶切。经T4酶连接后成功构建表达载体BnaLPAT4-1::pNapin和BnaLPAT4-2::pNapin,并将构建好的表达载体转化大肠杆菌(DH5a)内。转化方法:解冻感受态后,加入上述连接产物,冰上放置40 min;水浴锅内42℃处理90 s;冰盒内放置5 min;分别加入无抗大肠杆菌(Luria-Bertani, LB)液体培养基800 mL,摇床内37℃复苏1 h;取上述200 μL菌液均匀涂抹至50 mg·L-1Kan抗生素LB固体平板上;37℃条件下倒置过夜培养,挑取数个单菌落分别进行菌落PCR检测,提取质粒,酶切鉴定。
1.2.5 农杆菌介导法转染拟南芥 农杆菌介导法参考文献[9],具体步骤略有改变。制备农杆菌GV3101感受态:将1.2.4提取的阳性质粒转化感受态细胞中,挑取阳性菌进行菌落PCR检测。接种农杆菌菌种于农杆菌(Agrobacterium rhizogene Broth Medium, YEB)固体培养基[25 mg·L-1链霉素(streptomycin, str)+25 mg·L-1利福平(rifampin, rif)+50 mg·L-1卡那霉素(kanamycin, Kan)],28℃恒温条件下放置48 h,然后在超净工作台上将准备好的农杆菌接种于10 mL含有相应抗性的YEB液体培养基中,置于摇床上震荡培养24 h;接种上述混合物于75 mL含对应抗生素YEB液体培养基中,培养至OD值=1.5,离心收集菌体。浸染液为100 mL体系:蔗糖5 g,Silwett-77 30 μL,蒸馏水定容。野生型拟南芥种子置于4℃条件下低温春化处理3 d,然后置于光照培养箱内。培养箱参数设置为:温度24℃,光暗比16∶8,相对湿度75%,拟南芥生长达到盛花期时开始花絮浸染。室温条件下将拟南芥花序完全浸泡于浸染液中40 s,然后将已浸染的拟南芥套上黑色塑料袋遮光培养1 d,最后放置于光照培养箱内使其正常生长,期间每隔3 d重新浸染1次,每次侵染40 s,共浸染3次(浸染液现配现用)。完成浸染后置于光照培养箱继续生长至收获拟南芥T0代转基因种子。将收获的转基因种子用75%酒精处理3 min后置于3%次氯酸钠溶液内消毒15 min,无菌水反复清洗4次,均匀铺种拟南芥种子于含有Kan抗性的1/2MS固体培养基中,待种子发芽后移栽至栽培基质中,并将其放置在光照培养箱内生长,光照培养箱参数设置同上。待拟南芥转基因植株开花后严格自交授粉,并收获完全成熟的T1代种子。继续按照上述方法培养至收获转基因T3代种子。
1.2.6 检测酵母转化子和转拟南芥种子脂肪酸成分 超低温冰箱内取出酵母转化子,置于冰上融解为液体状后均匀涂抹在SD-Ura培养基上,恒温箱内30℃培养64 h后,将挑选的单菌落悬浮于YPDA培养基中,摇床200 r·min-1培养50 h左右,移至烘箱内烘干水分,彻底研磨至粉末状。0.05 g上述粉末高温灭菌后的5 mL离心管内,缓慢加入5%硫酸甲醇3 mL后混匀,将混合液置于85℃水浴锅内90 min,冷却至室温后离心至混合物分层,小心吸取适量上清液于另一干净的离心管内,用移液枪吸取NaCl、正己烷各2 mL至离心管内,8 000 r·min-1离心5 min,复制上一步骤吸取上清液至干净离心管内;等量吸取上述上清液和乙醚-石油醚各200 μL后待用。参照气相色谱仪(Aglient7890,美国安捷伦科技有限公司)使用说明测定酵母转化子脂肪酸成分,操作方法:调节起始温度100℃并保持12 min,15℃·min-1升温至210℃并保持7 min,1 min内升温至230℃,分流比100∶1,进口量1.0 μL。每个处理设置3个重复,拟南芥种子脂肪酸测定同上。
2 结果与分析
2.1 转酵母表达载体的构建及脂肪酸成分分析
2.1.1 YES 2.0表达载体的构建BnLPAT4-1和BnLPAT4-2经PCR扩增后进行胶回收,EcoRI与SacI双酶切回收的目的基因片段和YES2.0穿梭表达质粒的鉴定结果如图1所示,得到2条大小约为1 200 bp的条带。酶切片段及载体经T4连接酶连接得到重组质粒如图2所示。
2.1.2 表达载体转化酵母 随机挑选6个菌落(BnLPAT4-1和BnLPAT4-2各3个)进行PCR扩增,经鉴定均为转基因阳性菌落,经扩大培养后提取其阳性菌质粒。采用LiAc高效酵母转化法,将提取的阳性质粒转入酵母菌INVSC 1中,通过菌落PCR鉴定发现,PCR产物约为1 200 bp,说明质粒成功转入酵母菌中,检测结果如图3所示。

注:M:Trans 2 000 bp DNA marker;1~2:产物。Note: M: Trans 2 000 bp DNA marker. 1~2: Samples.图1 酶切BnaLPAT4基因PCR鉴定图Fig.1 PCR identification of BnaLPAT4 gene by enzyme digestion
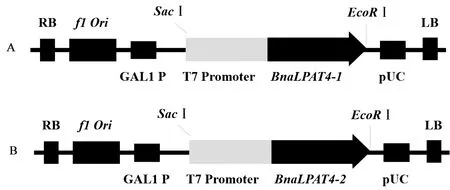
注:A:pGAL::BnaLPAT4-1载体; B:pGAL::BnaLPAT4-2载体。Note: A: pGAL::BnzLPAT4-1 carrier. B: pGAL::BnaLPAT4-2 carrier.图2 pGAL::BnaLPAT4-1和pGAL::BnaLPAT4-2酵母表达载体Fig. 2 pGAL::BnaLPAT4-1 and pGAL::BnaLPAT4-2 of yeast expression vector
注:M: Trans 2 000 bp DNA marker;1:质粒; 2:阴性对照; 3~5: BnLPAT4-1 的单菌落;6~8: BnLPAT4-2的单菌落。Note: M: Trans 2 000 bp DNA marker. 1: Plasmid. 2: Negative control. 3~5: BnLPAT4-1 colonies. 6~8: BnLPAT4-2 colonies.图3 酵母菌落PCR鉴定Fig.3 Yeast colony PCR identification
2.1.3 酵母脂肪酸组成分析 PEG/LiAc法转化酵母菌INVSC 1的气相色谱分析结果如表2所示,检测发现,转BnaLPAT4-1和BnaLPAT4-2基因酵母转化子与空酵母转化子YES 2.0脂肪酸组分之间发生明显变化,转化子间脂肪酸种类和比例出现差异。其中BnaLPAT4-1转化子脂肪酸种类较对照YES 2.0转化子特异性生成了亚麻酸(C18:3)和花生酸(C20:0)2种成分,硬脂酸(C18:0)和软脂酸(C16:0)含量较空转化子分别提高25.72和5.39个百分点,棕榈酸(C16:1)、油酸(C18:1)和亚油酸(C18:2)含量分别下降了14.71、21.35和15.24个百分点;BnaLPAT4-2转化子脂肪酸较对照C16碳链脂肪酸含量特异性增加,其中软脂酸和棕榈酸含量分别提升了18.67和7.82个百分点,而硬脂酸、油酸和亚油酸含量有不同程度的下降,并且较对照未生成其他种类脂肪酸。
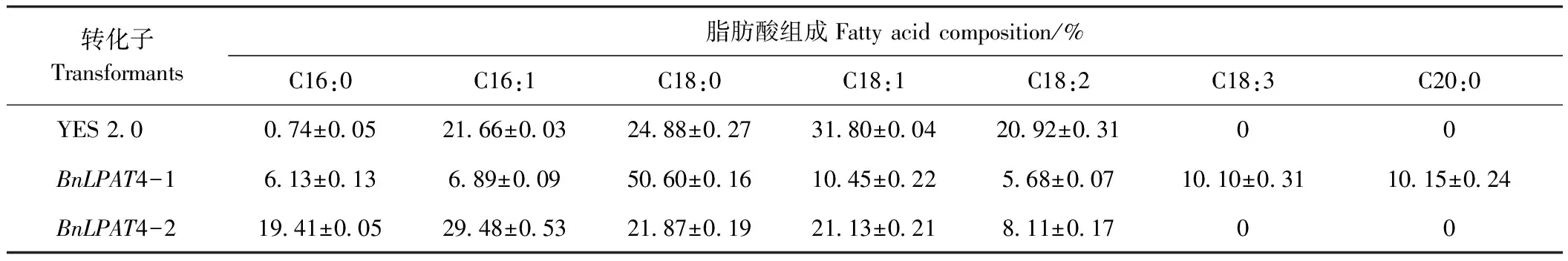
表2 酵母转化子脂肪酸检测Table 2 Detection of fatty acids in yeast converters
BnaLPAT4-1转化子中饱和脂肪酸(软脂酸和硬脂酸)含量达到YES 2.0转化子饱和脂肪酸含量的2.60倍,不饱和脂肪酸(棕榈酸、油酸、亚油酸、亚麻酸和花生酸)仅为YES 2.0转化子的0.58倍。BnaLPAT4-2转化子中饱和脂肪酸含量达到YES 2.0转化子的1.61倍,不饱和脂肪酸为YES 2.0转化子的0.79倍。
2.2 BnaLPAT4种子特异性表达载体的构建及脂肪酸成分分析
2.2.1 表达载体构建及鉴定BamHI与SacI双酶切目的基因BnaLPAT4-1和BnaLPAT4-2,分别连接表达载体pBI121后PCR扩增检测结果显示,试验成功扩增出2条796 bp的BnaLPAT4基因条带(图4),证明成功将克隆的2条BnaLPAT4基因连接至载体pBI121上获得重组质粒pNapin::BnaLPAT4-1和pNapin::BnaLPAT4-2。将上述重组质粒分别转化大肠杆菌DH5α感受态细胞中,经菌落PCR检测,取3个阳性菌落摇菌,并提取质粒,可用于后续试验。重组质粒如图5所示。
注:M:Trans 2 000 bp DNA marker;1~3:产物。Note: M: Trans 2 000 bp DNA marker. 1~3: Samples.图4 酶切BnaLPAT4基因PCR鉴定图Fig. 4 PCR identification of BnaLPAT4 gene by enzyme digestion
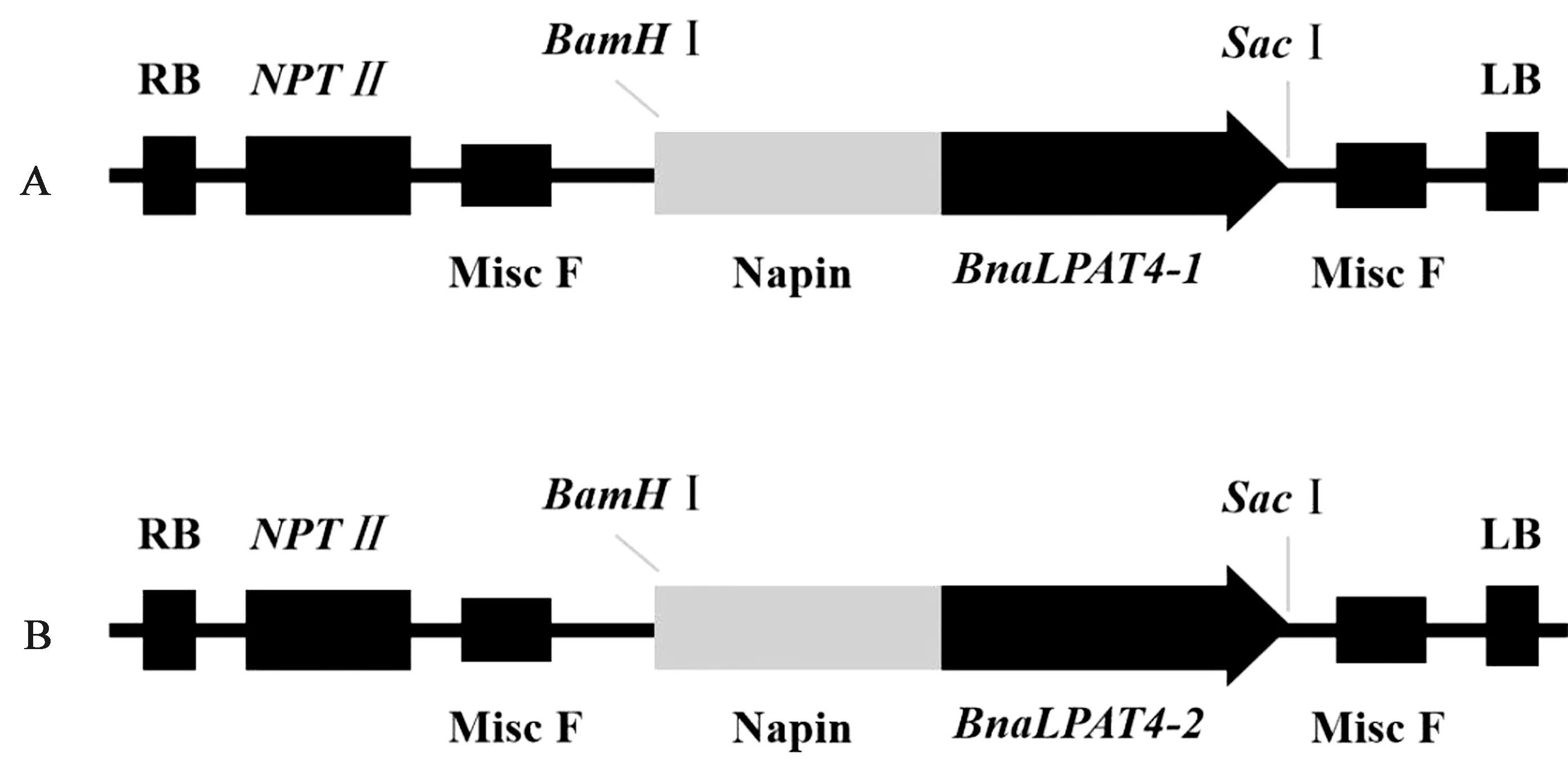
注:A:pNapin::BnaLPAT4-1载体;B:pNapin::BnaLPAT4-2载体。Note: A: pNapin:: BnaLPAT4-1 carrier. B: pNapin::BnaLPAT4-2 carrier.图5 pNapin::BnaLPAT4-1和pNapin:::BnaLPAT4-2载体构建Fig.5 Construction of pNapin::BnaLPAT4-1 and pNapin::BnalPAT4-2 vectors
2.2.2 农杆菌转化及阳性株鉴定 农杆菌从超低温冰箱取出后,将上述重组质粒转化农杆菌感受态细胞中,通过PCR检测表达载体成功转化农杆菌如图6所示。将带有表达载体的农杆菌扩大培养后配置浸染液,采用花絮浸染转化法,将重组质粒导入拟南芥中。
2.2.3 重组质粒转化拟南芥分析 农杆菌重组质粒BnaLPAT4-1和BnaLPAT4-2转化野生型拟南芥(哥伦比亚型)后PCR检测转基因阳性株结果如图7所示。检测结果表明,重组质粒BnaLPAT4-1和BnaLPAT4-2成功转化拟南芥中,并获得Napin启动子驱动BnaLPAT4-1和BnaLPAT4-2基因的转基因阳性拟南芥株。
注:M:Trans 2 000 bp DNA marker;1:阳性质粒;2:阴性对照;3~5:BnaLPAT4-1农杆菌菌落;6~8:BnaLPAT4-2农杆菌菌落。Note: M: Trans 2 000 bp DNA marker. 1: Positive plasmid. 2: Negative control. 3~5: Agrobacterium BnaLPAT4-1 colony. 6~8: Agrobacterium colony BnaLPAT4-2.图6 农杆菌重组质粒PCR检测Fig.6 PCR detection of agrobacterium tumefaciens recombinant plasmid
注:M:Trans 2 000 bp DNA marker;1:阳性质粒;2:阴性对照;3~5:转BnaLPAT4-1拟南芥;6~8:转BnaLPAT4-2拟南芥。Note: M: Trans 2 000 bp DNA marker. 1: Positive plasmid. 2: Negative control. 3~5: Transplanting BnaLPAT4-1 Arabidopsis. 6~8: Transfer BnaLPAT4-2 Arabidopsis.图7 转基因拟南芥PCR检测Fig.7 PCR detection of transgenic Arabidopsis thaliana
2.2.4 拟南芥种子脂肪酸组成分析 转pNapin::BnaLPAT4基因拟南芥RT-PCR结果如图8所示。转BnaLPAT4-1和BnaLPAT4-2基因拟南芥株系扩增产物条带亮度明显高于野生型对照,证明转基因拟南芥中BnaLPAT4-1和BnaLPAT4-2基因都高于野生型拟南芥,Actin条带亮度一致。表达量较野生型拟南芥有明显提升。气相色谱法检测拟南芥转基因BnaLPAT4-1 T3代株系种子脂肪酸组分并较对照材料脂肪酸组分进行比对分析,得到Napin::BnLPAT4-1 T3代种子脂肪酸组分如表3所示。由于拟南芥转基因BnLPAT4-2株系未收获正常发芽种子,无法进行脂肪酸检测试验。
由表3可知,转BnaLPAT4-1拟南芥的3个株系的种子较野生型对照的脂肪酸组分之间存在明显差异。其中转BnaLPAT4-1拟南芥株系1、2和3种子中的花生烯酸含量较野生型分别提高了3.57、4.48和3.60个百分点,平均提高3.88个百分点,而转基因株中花生酸和二十碳二烯酸较野生型对照的含量明显降低,3个转基因株花生酸的含量分别降低0.84、0.52和0.78个百分点,平均降低7.20个百分点,二十碳二烯酸含量分别降低0.68、0.96和0.74个百分点,平均降低0.79个百分点。转基因株种子脂肪酸较野生型对照中的硬脂酸、油酸、亚油酸以及亚麻酸组分的含量与野生型对照无明显差异,但转基因株种子脂肪酸中无花生三烯酸和芥酸的产生,由此可得出BnaLPAT4-1基因具有抑制花生三烯酸和芥酸生成且催化花生烯酸生成的功能。

M:Trans 2 000 bp DNA marker;1~2:拟南芥野生型;3~5:转BnaLPAT4-1拟南芥植株;6~7:转BnaLPAT4-2拟南芥植株。M: Trans 2 000 bp DNA marker. 1~2 : Arabidopsis wild-type. 3~5: Transforming Arabidopsis thaliana plants with BNLPA 4-1. 6-7: Transforming Arabidopsis thaliana plants with BNLPA 4-2.图8 拟南芥转基因BnaLPAT4株系RT-PCR检测Fig.8 RT-PCR detection of Transgenic BnaLPAT4 strain in Arabidopsis thaliana
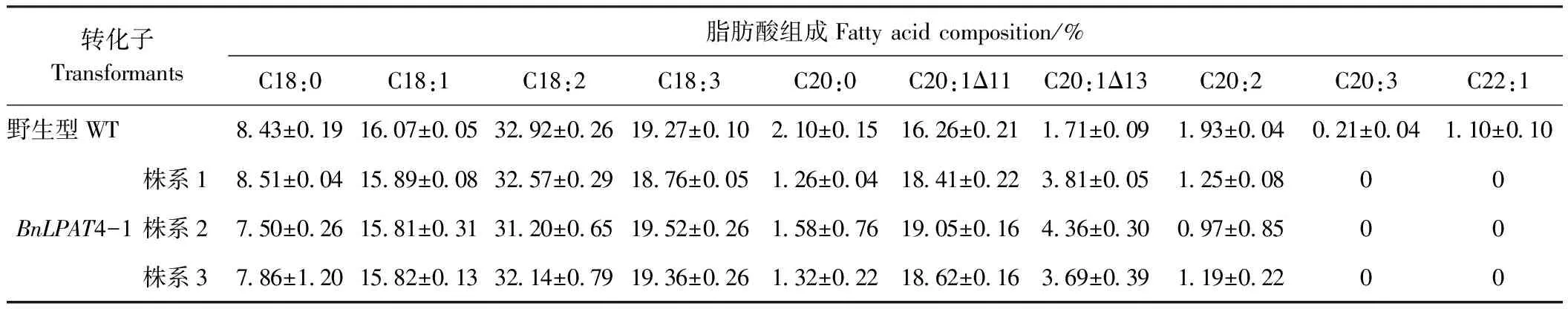
表3 拟南芥种子脂肪酸组分Table 3 Arabidopsis thaliana seeds fatty acid component
3 讨论
油菜是我国重要的油料作物之一,对我国油料安全生产有重大意义[17-20]。研究油菜油脂形成机制和发掘调控油脂合成的相关基因,对提高油菜种子含油量和提升油脂品质具有重要的指导作用[21-23]。研究发现LPAT基因具有调控植物油脂合成的生物学功能[24-26]。本试验通过克隆甘蓝型油菜湘油15号BnaLPAT4基因,构建表达载体转化酵母和拟南芥,并采用气相色谱法检测发现,转基因株脂肪酸组分明显发生变化,证明BnaLPAT4基因具有调控油脂合成的生物学功能。同时本研究检测到BnaLPAT4-1与BnaLPAT4-2转化子间的脂肪酸组分存在差异,BnaLPAT4-1转化子生成亚麻酸和花生酸,而BnaLPAT4-2转化子脂肪酸组分中软脂酸和棕榈油酸比例明显提高,证明BnaLPAT4基因拷贝间在油脂合成的表达模式中存在差异,确定BnaLPAT4基因具有调控植物脂肪酸链合成,从而影响植物含油量的功能,这与尹永泰[14]、柏杨等[18]、肖旦望等[27]、丁检等[28]和陈四龙[29]的研究结果相似。
LPAT酶具有调控脂肪酸链装配在TAG的sn-2位上的功能,对不饱和脂肪酸具有特异选择性,胡蓉等[30]通过构建BnaLPAT2过表达载体转化拟南芥,发现转基因拟南芥种子亚油酸和亚麻酸等不饱和脂肪酸有明显提升,但油酸含量明显下降。Zhang等[31]通过设计多个sgRNA位点并构建CRISPR/Cas9编辑载体对油菜BnaLPAT2和BnaLPAT5基因多同源拷贝进行定向编辑,发现编辑油菜种子中含油量较野生型明显下降,并且种子性状、大小和千粒重受到明显的影响。以上试验验证了LPATs基因家族具有调控油菜油脂合成的生物学功能。本试验构建了BnaLPAT4-1和BnaLPAT4-2基因表达载体转化酵母,并通过气相色谱法检测到酵母转化子饱和脂肪酸(软脂酸和硬脂酸)的含量明显提高。气相色谱检测转BnaLPAT4-1基因植株发现花生烯酸含量明显提高,两种转基因材料脂肪酸变化结果不一致。本试验仅在酵母和拟南芥中对BnaLPAT4-1和BnaLPAT4-2基因功能进行了验证,还需要转化油菜后验证BnaLPAT4基因功能。
4 结论
本研究从甘蓝型油菜湘油15号中克隆获得两条BnaLPAT4基因,长度分别为1 143、1 140 bp,分别命名为BnaLPAT4-1、BnaLPAT4-2。构建重组质粒分别转化酵母和拟南芥,并通过气相色谱法检测转基因材料脂肪酸组分发现,转基因株脂肪酸组分较野生型对照有明显变化,从而验证了BnaLPAT4基因具有调控植物脂肪酸链合成,从而影响植物含油量的生物学功能。
