艾叶挥发油对H2O2诱导鲤鱼肝脏氧化损伤的保护作用
2022-07-05陈剑杰曹谨玲李丽娟张秀林伍宜杰
陈剑杰 曹谨玲 李丽娟 张秀林 伍宜杰
(1 山西农业大学动物医学学院,山西 太谷 030801;2 山西农业大学食品科学与工程学院,山西 太谷 030801;3 晋中信息学院,山西 太谷 030801)
正常情况下,动物机体具有生成和消除自由基的动态平衡能力,当其受到外源性或内源性因素胁迫时,这种动态平衡可能被打破,从而引发氧化应激[1-2]。此时生物体内的抗氧化系统会起到防御作用,其中超氧化物歧化酶(superoxide dismutase,SOD)可使超氧化物阴离子(O2-) 转化为H2O2和O2,过氧化氢酶(catalase,CAT)能很快分解H2O2,使其转变为H2O和O2,谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)可促进H2O2的分解,而丙二醛(malondialdehyde,MDA)含量可以反映机体细胞氧化损伤的程度[1]。肝脏是机体重要的代谢器官,具有解毒、防御和调节血液循环等多种作用。当机体发生氧化应激时会引起肝脏的氧化损伤[1-3]。因此,寻找有助于缓解机体氧化应激的绿色安全的饲料添加剂,对预防动物肝脏的氧化损伤以及维持其健康具有深远意义。
艾叶为菊科植物艾(Artemisiaargyi)的叶,在我国具有悠久的使用传统。现代药理研究发现艾叶具有多种药物活性作用[4-8]。艾叶挥发油(Artemisiaargyiessential oils, AAEO)是艾叶的主要有效成分。已有研究发现艾叶挥发油具有多种功效,如丁圆平等[9]研究发现艾叶挥发油能够显著抑制体外培养的人肺癌A549细胞的生长且具有剂量-时间效应,葛德鹏等[10]研究发现艾叶挥发油可通过破坏微生物细胞壁结构而达到抑菌效果,Xiang等[11]研究发现艾叶挥发油能够对金黄色葡萄球菌、枯草芽孢杆菌产生抑制作用,曹谨玲等[12]研究显示艾叶挥发油可以通过调节细胞炎性因子的基因表达、调控细胞因子和炎症介质的分泌来发挥抗炎作用,齐巧明等[13]通过检测艾叶挥发油对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除率,发现其具有一定的抗氧化作用。但是对于艾叶挥发油在抑制机体氧化应激、防护肝脏氧化损伤方面的研究还鲜有报道。
过氧化氢(H2O2)极易透过细胞膜,与细胞内铁离子通过芬顿(Fenton)反应形成过量的自由基,常用于体内和体外氧化损伤模型的建造和保护剂的研究[14-15]。鱼类对氧化应激较为敏感,是研究氧化应激的理想动物模型[16]。鲤鱼(Cyprinuscarpio)作为我国淡水水体中重要的养殖鱼类,其绿色健康养殖对于经济效益和社会效益具有重要意义。因此,本试验选择鲤鱼作为受试对象,采用H2O2诱导鲤鱼建立氧化损伤模型来探讨艾叶挥发油对鲤鱼肝脏氧化损伤的缓解作用,旨在为将艾叶挥发油作为绿色安全抗氧化剂以促进鱼类绿色健康养殖提供理论依据。
1 材料与方法
1.1 材料与试剂
150尾体型一致、健康活泼的鲤鱼(平均体重为30±1.2 g),由太原渔场提供,饲养于实验室养殖箱中;艾叶挥发油,按照《中国药典》[17]方法进行水蒸气蒸馏法制备,主要成分为1,8 桉叶素(eucalyptol,2.89%)、4-萜烯醇(4-methyl-1-(1-methylethyl)-3-cyclohexen-1-ol,6.56%)、龙脑(borneol,5.94%)、松油醇(p-menth-1-en-8-ola,3.82%)、2,4,6-三甲基苯基-2,4,6-三甲基苯甲酸酯(2,4,6-trimethylphenyl-2,4,6-trimethyl benzoate,4.85%)和石竹烯(caryophyllene,5.84%);H2O2,国药集团化学试剂有限公司;间氨基苯甲酸乙酯磺酸盐(MS-222),武汉中弘生物科技有限公司;考马斯亮蓝(coomassie dimethyl sulfoxide brilliant blue G-250)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、SOD、CAT、MDA、GPx试剂盒,购自南京建成生物工程研究所;RNAiso Plus、反转录试剂盒、SYBR Green PCR kit,大连TaKaRa公司。
1.2 仪器与设备
BX53 显微镜成像系统,日本奥林巴斯;AUY-120 型电子分析天平,日本岛津公司;UV2100紫外可见分光光度计,上海尤尼柯公司;MK3 酶标仪,美国Thermo公司;TGL-10B 高速台式离心机,上海安亭科学仪器厂;XZ-0142水质分析仪,上海希庆电子科技有限公司;荧光定量PCR仪,美国Bio-Rad公司。
1.3 试验方法
1.3.1 试验分组 将鲤鱼随机分为5组,分别为空白对照组、H2O2组和不同浓度AAEO试验组(饵料中添加AAEO的量分别为0.1、0.2、0.4 g·kg-1),每组设3个重复,每个重复10尾鱼。H2O2组和AAEO组每天在H2O2中暴露1 h(暴露浓度为1.00 mmol·L-1,时间为9:00—10:00)。期间按时投饵 (每天按时投喂3次,日投饵量为鲤鱼体重的3%),对照组和H2O2组投喂正常饵料,AAEO组投喂添加了相应剂量AAEO的饵料,期间持续充氧,试验时间为30 d。试验结束后,每组随机取15尾鲤鱼(每个重复5尾)用MS-222麻醉处理,随即进行血液(尾静脉采血,血液置于抗凝管中)和肝组织的采集。血液样品进行ALT、AST、总蛋白(total protein, TP)、白蛋白(albumin, ALB)和SOD、CAT、MDA、GPx的检测;肝脏组织分为3部分:一部分采集后保存到-20℃冰箱中,用于SOD、CAT、MDA、GPx等抗氧化指标的检测;一部分采集后保存到 -80℃ 冰箱中,用于铜锌超氧化物歧化酶(Cu/Zn-SOD)、锰超氧化物歧化酶(Mn-SOD)、GPx、CAT和核因子-E2相关因子2(Nrf2) mRNA表达检测;其余肝组织用中性甲醛固定后用于制作常规组织切片进行病理形态学观察。
1.3.2 血清和组织指标的测定 采集的血清和组织样品,参考试剂盒使用说明书进行Alb、ALT、AST、TP、SOD、CAT、MDA和GPx的测定,所有指标均于当天测定完毕。
1.3.3 肝组织切片的制备 肝脏组织用波恩氏液固定,梯度酒精脱水二甲苯透明后石蜡包埋,切片后HE染色中性树胶封片,并使用显微成像系统观察拍照[18]。
1.3.4 抗氧化基因mRNA表达的检测 肝脏组织提取总RNA转录为cDNA,利用实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)技术对肝脏组织相关抗氧化基因Cu/Zn-SOD、Mn-SOD、GPx、CAT和Nrf2的mRNA表达水平进行检测,具体操作参照试剂盒说明书进行,β-肌动蛋白(β-actin)作为内参基因,采用2-ΔΔct法分析目的基因mRNA相对表达量。应用美国国立生物技术信息中心(national center for biotechnology information, NCBI)数据库查询的基因序列,采用Premier 6软件设计引物,见表1。
1.4 数据统计与分析
采用SPSS 22.0软件对数据进行统计与分析,应用单因素方差分析和Duncan法进行多重比较,采用bivariate correlation进行相关性分析。数据以平均值±标准误(Mean±SE)表示,显著性水平为P<0.05。

表1 引物序列Table 1 Primer sequence
2 结果与分析
2.1 AAEO对H2O2暴露鲤鱼血清ALT和AST活性的影响
由图1可知,与对照组相比,H2O2组鲤鱼血清ALT和AST活性均显著升高;与H2O2组相比,不同浓度AAEO组鲤鱼血清ALT和AST活性均显著降低。相关性分析表明,AAEO添加水平与鲤鱼血清ALT和AST活性均呈负相关(皮尔逊相关系数分别为 -0.597,P=0.019;-0.595,P=0.019);且与对照组相比,0.2和0.4 g·kg-1AAEO组ALT和AST活性均无显著差异。
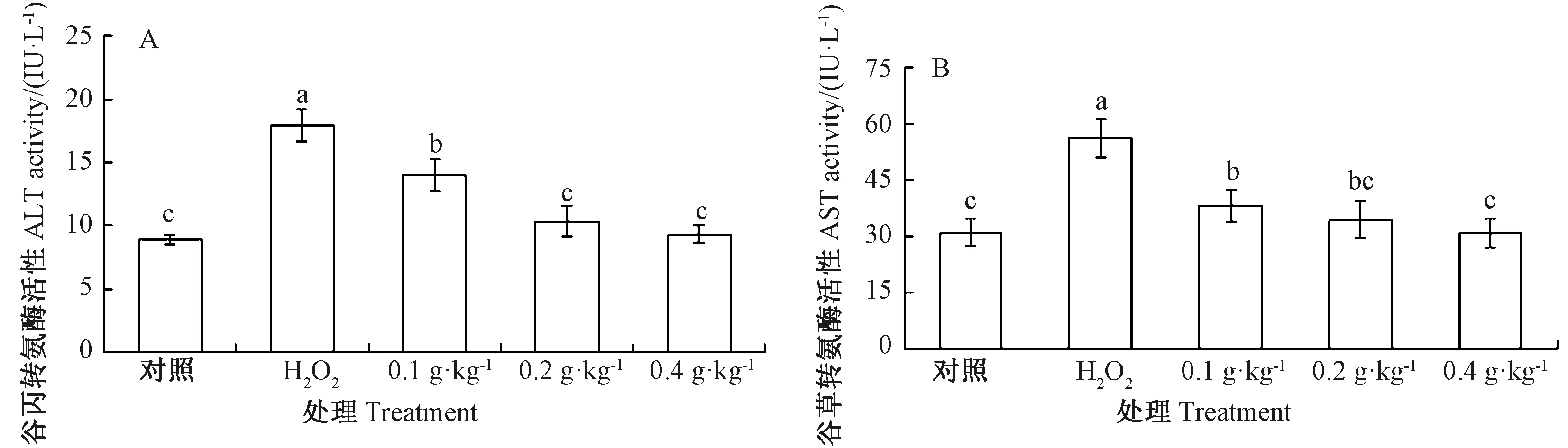
注:不同小写字母表示处理组间差异显著(P<0.05)。下同。Note: Different lowercase letters mean significant difference among treatments at 0.05 level. The same as following.图1 AAEO对H2O2暴露鲤鱼血清ALT和AST活性的影响Fig.1 Effects of AAEO on ALT and AST activities in serum of carp exposed to H2O2
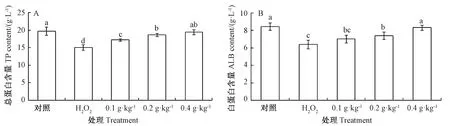
图2 AAEO对H2O2暴露鲤鱼血清TP和ALB含量的影响Fig.2 Effects of AAEO on the contents of TP and ALB in serum of carp exposed to H2O2
2.2 AAEO对H2O2暴露鲤鱼血清TP和ALB含量的影响
由图2可知,与对照组相比,H2O2组鲤鱼血清TP和ALB含量均显著降低;与H2O2组相比,0.2和0.4 g·kg-1AAEO组TP和ALB含量均显著升高。相关性分析表明,AAEO添加水平与鲤鱼血清TP和ALB含量均呈正相关(皮尔逊相关系数分别为0.589,P=0.047;0.605,P=0.017);且与对照组相比,0.4 g·kg-1AAEO组TP和ALB含量均无显著差异。
2.3 AAEO对H2O2暴露鲤鱼血清脂质过氧化及抗氧化能力的影响
由图3可知,与对照组相比,H2O2组鲤鱼血清MDA含量显著升高,SOD、CAT、GPx活性均显著降低;与H2O2组相比,AAEO组MDA含量均显著降低。相关性分析表明,AAEO添加水平与鲤鱼肝组织MDA含量呈负相关(皮尔逊相关系数为 -0.768,P=0.007)。与H2O2组相比,AAEO组SOD、CAT、GPx活性呈上升趋势,且在0.2和0.4 g·kg-1AAEO组分别与H2O2组差异显著。相关性分析表明,AAEO添加水平与鲤鱼肝组织SOD、CAT、GPx活性呈正相关(皮尔逊相关系数分别为0.815,P=0.001;0.754,P=0.006;0.702,P=0.008)。
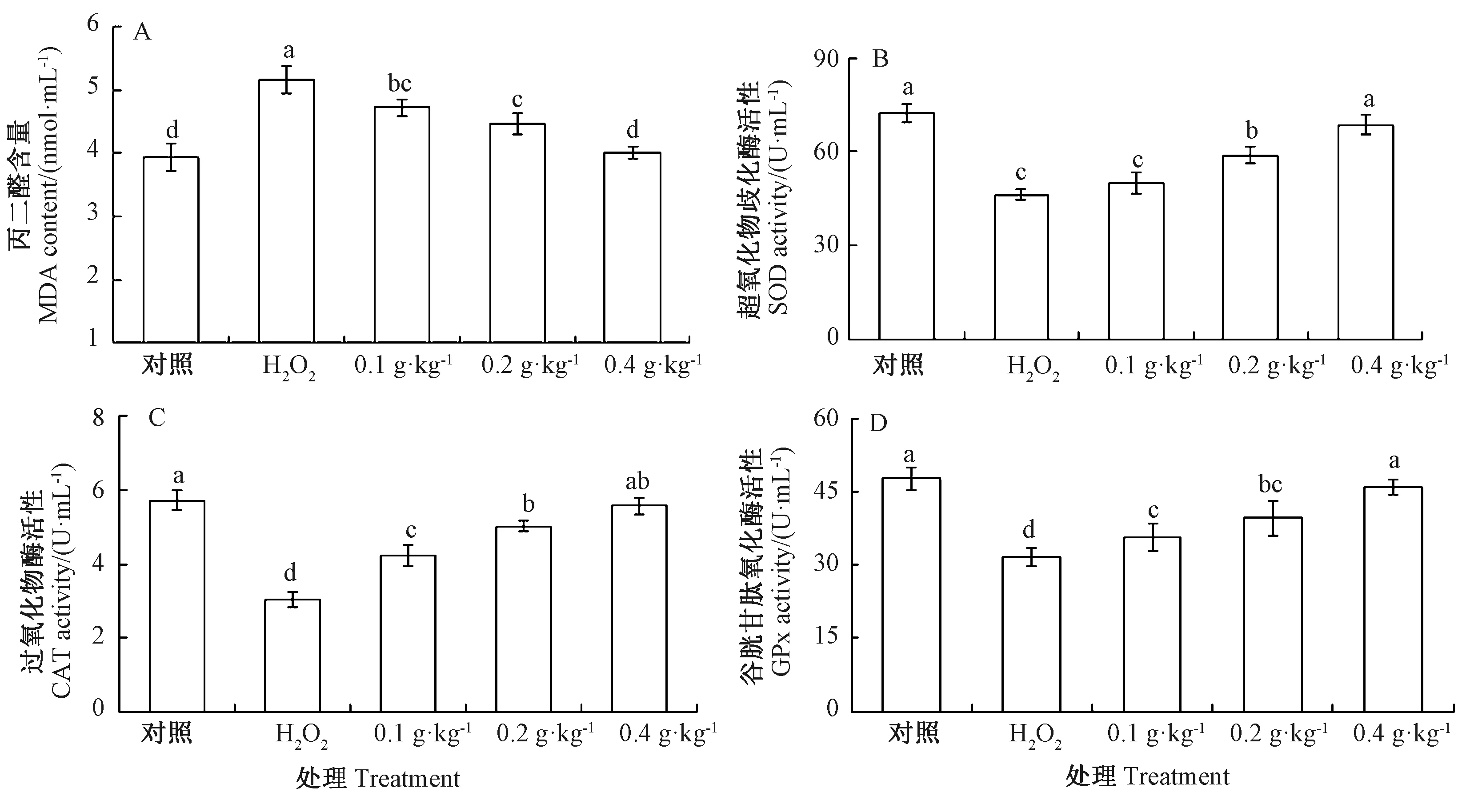
图3 AAEO对H2O2暴露鲤鱼血清脂质过氧化及抗氧化能力的影响Fig.3 Effects of AAEO on lipid peroxidation and antioxidant capacity in serum of carp exposed to H2O2
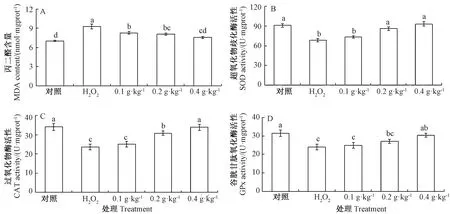
图4 AAEO对H2O2暴露鲤鱼肝脏脂质过氧化及抗氧化能力的影响Fig.4 Effects of AAEO on lipid peroxidation and antioxidant capacity of carp liver exposed to H2O2
2.4 AAEO对H2O2暴露鲤鱼肝脏脂质过氧化及抗氧化能力的影响
由图4可知,与对照组相比,H2O2组鲤鱼肝组织MDA含量显著升高,SOD、CAT、GPx活性均显著降低。与H2O2组相比,AAEO组MDA含量呈下降趋势且均与H2O2组差异显著。相关性分析表明,AAEO添加水平与鲤鱼肝组织MDA含量呈负相关(皮尔逊相关系数为-0.652,P=0.008);SOD、CAT活性呈上升趋势且分别在0.2和0.4 g·kg-1AAEO组与H2O2组差异显著。相关性分析表明,AAEO添加水平与鲤鱼肝组织SOD、CAT、GPx活性呈正相关(皮尔逊相关系数分别为0.777,P=0.001;0.554,P=0.012;0.676,P=0.006)。
2.5 AAEO对H2O2暴露鲤鱼肝脏组织结构的影响
如图5所示,对照组鲤鱼肝脏组织结构完整,肝细胞多呈卵圆形且边缘清晰,肝血窦呈网状分布(图5-a); H2O2组中,鲤鱼肝脏组织出现病理变化,可见肝细胞排列严重紊乱,细胞边缘不清晰,结构表现异常,出现细胞核变形萎缩甚至消失、肝血窦增宽现象(图5-b);0.1 g·kg-1AAEO组可见肝细胞排列紊乱,细胞界限不清晰,出现细胞核变形萎缩甚至消失、肝血窦增宽现象(图5-c);0.2 g·kg-1AAEO组可见肝细胞排列紊乱现象得到缓解,出现肝血窦增宽现象(图5-d); 0.4 g·kg-1AAEO组可见肝血窦增宽现象明显缓解,肝组织结构基本正常(图5-e)。
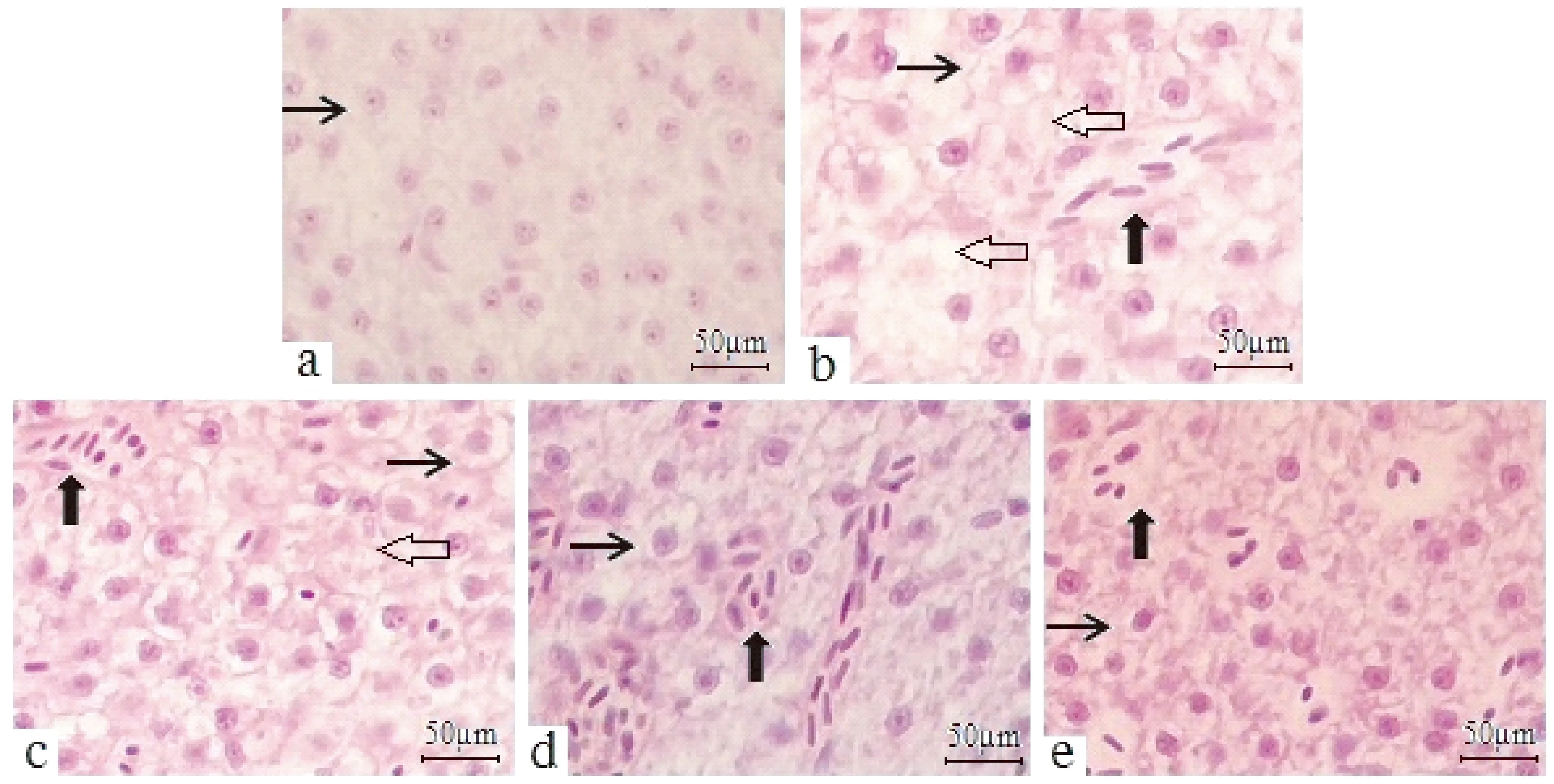
注:←:肝细胞,:肝血窦,⟸:细胞核萎缩消失;a:对照组;b:H2O2组;c:0.1 g·kg-1; d:0.2 g·kg-1; e:0.4 g·kg-1。Note: ←: Hepatocytes. : Sinusoid. ⟸: Nucleus atrophy disappears. a: Control group. b: H2O2 group. c:0.1 g·kg-1. d:0.2 g·kg-1. e:0.4 g·kg-1.图5 AAEO对H2O2暴露鲤鱼肝脏组织结构的影响Fig.5 Effects of AAEO on liver tissue structure of carp exposed to H2O2
2.6 AAEO对H2O2暴露鲤鱼肝相关抗氧化基因的影响
由图6可知,与对照组相比,H2O2组鲤鱼肝组织Cu/Zn-SOD、Mn-SOD、CAT、GPx和Nrf2 mRNA相关表达量分别显著下降了34.41%、33.54%、30.52%、37.58%和35.29%;与H2O2组相比,AAEO组Cu/Zn-SOD、Mn-SOD、CAT、GPx和Nrf2 mRNA相关表达量呈上升趋势,且0.2和0.4 g·kg-1组上升显著。相关性分析表明,AAEO添加水平与鲤鱼肝组织Cu/Zn-SOD、Mn-SOD、CAT、GPx和Nrf2 mRNA相关表达量呈正相关(皮尔逊相关系数分别为0.913,P=0.009;0.803,P=0.005;0.656,P=0.019;0.690,P=0.017;0.893,P=0.007)。
3 讨论
MDA含量可反映脂质过氧化程度,是细胞膜氧化损伤的主要指标之一[19]。SOD、CAT和GPx是机体内重要的抗氧化防御性功能酶,具有平衡细胞氧化还原的作用,能够缓解细胞的氧化损伤,上述物质已被广泛应用为机体的氧化应激标记物[20-22]。Jia等[23]研究显示尼罗罗非鱼(Oreochromisniloticus)腹腔注射H2O2后可导致血清和肝脏组织中MDA含量增加,CAT、SOD和GPx水平降低。本研究结果也发现,H2O2作用于鲤鱼后,血清和肝脏中MDA含量均高于对照组,表明H2O2暴露可使鲤鱼体内自由基堆积,导致脂质过氧化产物MDA含量增加。同时血清和肝脏中SOD、CAT和GPx活性均明显下降,说明机体内H2O2和羟基自由基生成过量,SOD、CAT和GPx被大量消耗,使机体抗氧化能力下降。这与其他研究结果基本一致[24-25]。
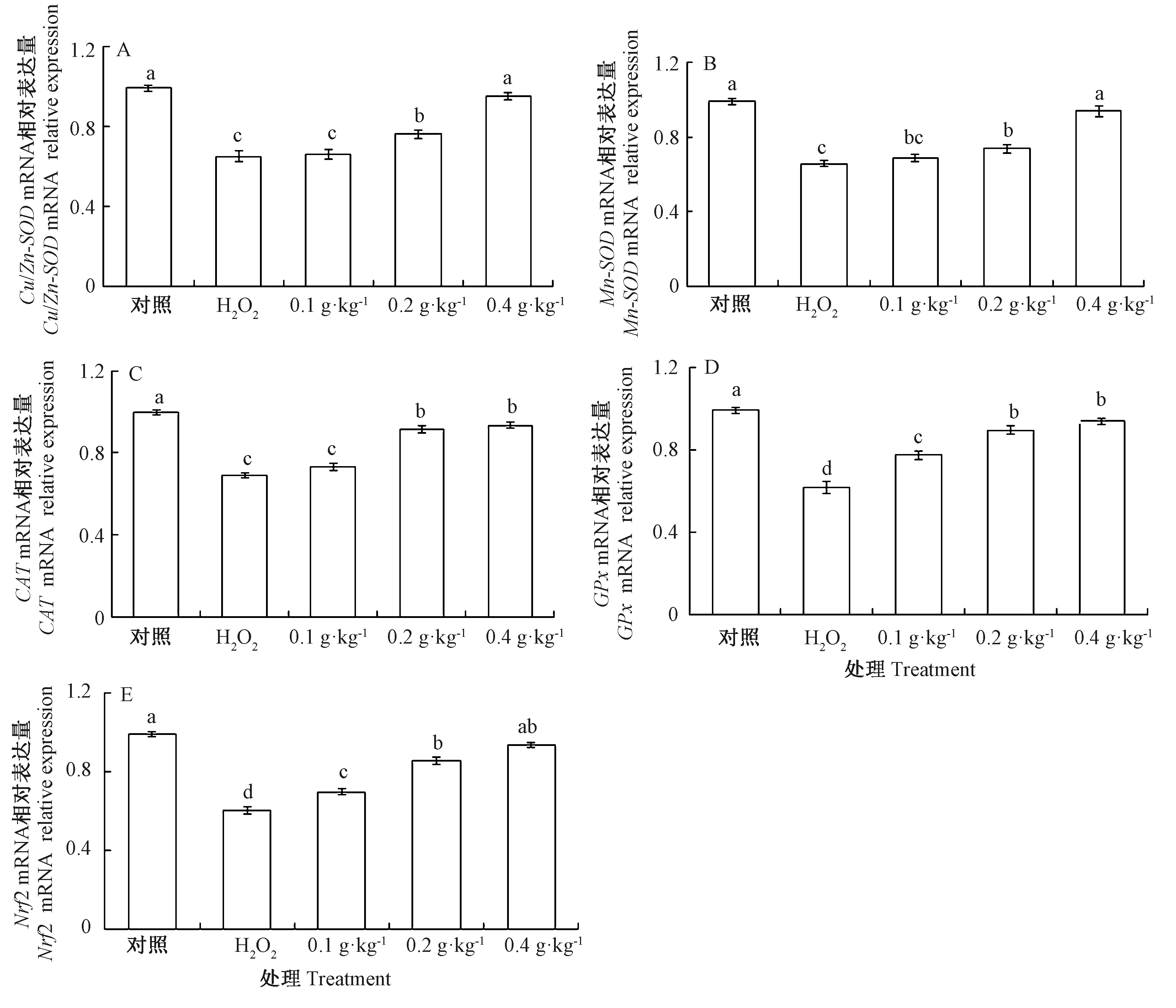
图6 AAEO对H2O2暴露鲤鱼肝相关抗氧化基因的影响Fig.6 Effects of AAEO on liver related antioxidant genes of carp exposed to H2O2
ALT和AST主要分布在肝细胞内,当肝损伤时两者活性会升高;TP和ALB含量是肝脏合成功能的关键指标,当肝功能受到损害时,两者含量会明显下降[26-27]。本研究中,H2O2作用于鲤鱼后,导致ALT和AST活性升高,而TP和ALB含量下降,肝脏组织切片出现明显病理变化,表明H2O2的氧化应激引起了鲤鱼肝脏的损伤。
已有研究表明,多种物质的抗氧化能力在肝保护中发挥着主要作用,如马朝阳等[28]研究发现桦木酸可以减缓环磷酰胺对小鼠肝脏的脂质过氧化而预防肝脏的损伤;刘丹等[29]研究发现地鳖肽可通过提高肝抗氧化酶活性抑制脂质过氧化,从而改善四氯化碳对小鼠的肝损伤;肖凤琴等[30]研究表明酸枣仁黄酮可以通过提高抗氧化作用而减轻全氟辛烷磺酸对小鼠肝脏的损伤。本研究也发现,AAEO可以降低MDA含量,提高SOD、CAT和GPx活性,同时有效降低血清中ALT和AST活性,增加TP和ALB含量,且组织切片观察也发现AAEO组中肝脏组织的病理变化得到缓解。这表明AAEO可以通过诱导鲤鱼肝组织中抗氧化能力的升高和脂质过氧化的降低,来消除过多的自由基抑制氧化应激,从而减轻肝脏的氧化损伤。
Nrf2是机体抗氧化防御系统的关键调控因子,可以调控下游抗氧化基因的表达,其高水平表达于肝脏中[31]。研究发现氧化应激可以促使Nrf2 mRNA表达量的下调[32-33]。本试验中H2O2作用于鲤鱼后Nrf2 mRNA表达量显著下调,而AAEO可以诱导Nrf2 mRNA表达量的升高,上调Mn-SOD、Cu/Zn-SOD、CAT和GPxmRNA的表达量。这可能是由于Nrf2被AAEO激活后进入到细胞核中,与抗氧化反应元件结合后诱导了下游抗氧化酶SOD、CAT和GPx基因的表达,从而提高了机体抗氧化系统清除自由基的能力。
4 结论
本试验用H2O2诱导构建鲤鱼肝脏氧化损伤模型,研究AAEO对鲤鱼肝脏氧化损伤的保护作用。结果表明,AAEO能够缓解H2O2诱导的鲤鱼肝脏中ALT、AST活性上升和TP、ALB含量下降,血清和肝脏组织中SOD、CAT、GPx活性下降,MDA含量上升以及肝脏组织病理损伤和抗氧化基因的表达降低,在一定程度上对其肝脏起到了保护作用。
