肺腺癌组织中COX-2、MMP-7 的表达及临床意义
2022-06-30徐阳范瑞
徐阳,范瑞
(河南省南阳市第一人民医院病理科,河南 南阳 473000)
肺腺癌是我国临床常见恶性肿瘤疾病, 病变进展快,预后差。 文献指出,恶性肿瘤最重要特点是侵袭周围组织并在远处发生转移, 此过程是一个多基因、 多阶段性及多种转录因子参与调控的结果,涉及一系列生理病理反应,而肿瘤的浸润、转移、 恶性质是导致肺腺癌患者错失治疗时机及病死的主要原因[1-2]。 因此,分析肺腺癌病变进展机制成为目前临床研究关注的热点。 环氧合酶-2(Cyclooxygenase-2,COX-2) 是由花生四烯酸合成前列腺素的限速酶,广泛分布于人体,在正常生理状态下表达较少,但受到细胞因子、生长因子、癌基因等多种因素刺激后可快速合成并释放, 进而参与炎症及肿瘤的发生及发展[3]。 基质金属蛋白酶-7(Matrixmetalloproteinase,MMP-7)是基质金属蛋白酶家族中的一员,参与基质降解过程,研究显示, 肿瘤转移屏障可在MMP-7 的作用下被破坏,最终促进肿瘤细胞的转移浸润[4]。 上述研究均表明,COX-2、MMP-7 异常表达与肿瘤的发生、 发展有关。 鉴于此, 本研究进一步分析肺腺癌组织中COX-2、MMP-7 的表达及临床意义。
1 资料与方法
1.1 临床资料 收集2017年1月至12月期间医院收治并进行手术治疗的74 例肺腺癌患者病历资料,其中男23 例,女51 例;年龄35~68 岁,平均(48.85±5.14)岁;高分化21 例、中分化32 例、低分化21 例;肿块直径>3 cm 33 例,肿块直径≤3 cm 41 例。 纳入标准:(1)通过细胞学及术后病理组织检查确诊为原发性肺腺癌;(2)术前均未接受化疗、放疗及其他抗肿瘤治疗者;(3)临床资料及术后组织病理学检查结果完整。 排除标准:(1)合并其他肿瘤类疾病者;(2)合并先天性肺疾病者。
1.2 研究方法
1.2.1 基线资料采集 查阅患者病历, 采用本院自制基线资料调查量表,采集患者性别、年龄、病变位置、肿瘤直径、病理分期、淋巴结转移、分化程度及浸润程度等临床资料。
1.2.2 癌组织中COX-2、MMP-7 检测 采用免疫组化法检查。 取石蜡包埋的肺腺癌组织块,常规切片脱蜡、脱水,加入柠檬酸缓冲液(pH=6.0)进行高温抗原修复,将0.3%过氧化氢溶液滴入,抑制内源性过氧化物酶活性,分别使用兔抗人COX-2 单克隆抗体(北京中山金桥生物技术有限公司,稀释比例为1:200)及兔抗人MMP-7 多克隆抗体(武汉三鹰生物技术有限公司产品,稀释比例为1:160)作为一抗,在4 ℃的环境下孵育过夜,二抗与免疫组化复合物在37 ℃的环境下各孵育30 min,以磷酸盐缓冲液(Phosphate Buffered Saline,PBS)代替一抗并作为阴性对照,而后完成DNA 染色、苏木精复染、乙醇脱水及中性树胶封片。
1.2.3 结果判定 在显微镜下随机选取5 个高倍视野(放大倍数400 倍)观察切片,每个视野计数100个细胞, 判读染色强度及阳性细胞数。 COX-2 及MMP-7 主要表达于细胞膜及细胞质, 阳性范围为淡黄色至棕黄色颗粒,0 分为无着色,1 分为浅黄色,2 分为黄棕色,3 分为棕褐色; 阳性细胞百分比=阳性细胞数/总细胞数×100%, 阳性细胞百分比≤25%记1 分, 阳性细胞百分比25%~50%记2分,阳性细胞百分比51%~75%记3 分,阳性细胞百分比>75%记4 分。 COX-2、MMP-7 蛋白阳性表达判定方法:染色强度分值与阳性细胞占比乘积>2。
1.3 统计学方法 应用SPSS 25.0 统计学软件处理数据, 采用Shapiro-Wilk 正态分布检验计量资料正态性,±s 表示符合正态分布计量资料;n(%)表示计数资料,用χ2检验;采用logistic 回归分析肺腺癌组织中COX-2、MMP-7 的表达与各临床特征的关系;P<0.05 为差异有统计学意义。
2 结果
2.1 肺腺癌组织中COX-2、MMP-7 表达情况 免疫组化检查结果显示,COX-2、MMP-7 主要表达于细胞膜及细胞质中, 在肺腺癌组织中阳性表达率分别为68.92%(51/74),45.95%(34/74),见图1~2。
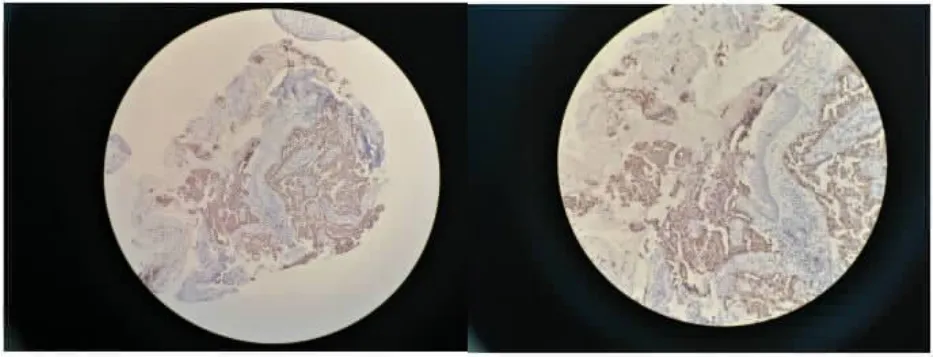
图1 MMP-7 在肺腺癌组织中的表达(×400)
2.2 不同临床特征的肺腺癌患者癌组织中COX-2及MMP-7 表达情况 不同性别、年龄段、肿瘤直径及分化程度的肺腺癌患者癌组织中COX-2、MMP-7 阳性表达比较,差异无统计学意义(P>0.05);TNMⅢ-Ⅳ分期、有淋巴结转移及浸润程度T3-T4 期的肺腺癌组织中COX-2、MMP-7 阳性表达率高于TNMⅠ-Ⅱ期、无淋巴结转移、浸润程度T1-T2 期的肺腺癌组织,差异有统计学意义(P<0.05)。 见表1。
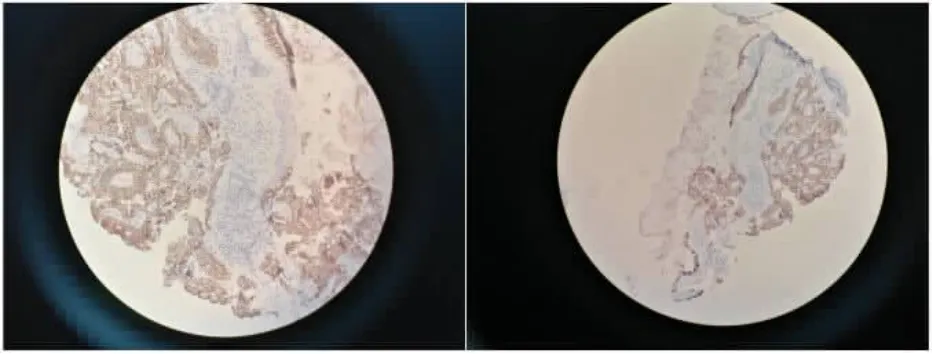
图2 COX2 在肺腺癌组织中的阳性表达(×400)

表1 肺腺癌组织中COX-2、MMP-7 表达与临床特征
2.3 肺腺癌组织中COX-2 及MMP-7 表达与临床病理特征的关系分析 将肺腺癌组织中COX-2 及MMP-7 阳性表达作为自变量,将TNM 分期(0=Ⅰ-Ⅱ期,1=Ⅲ-Ⅳ期)、淋巴结转移(0=无,1=有)及浸润程度(0=T1-T2 期,1=T3-T4 期)作为因变量,经logistic 回归分析结果显示, 肺腺癌组织中COX-2及MMP-7 阳性表达与TN 分期、 淋巴结转移及浸润程度密切相关(OR>1,P<0.05)。 见表2。
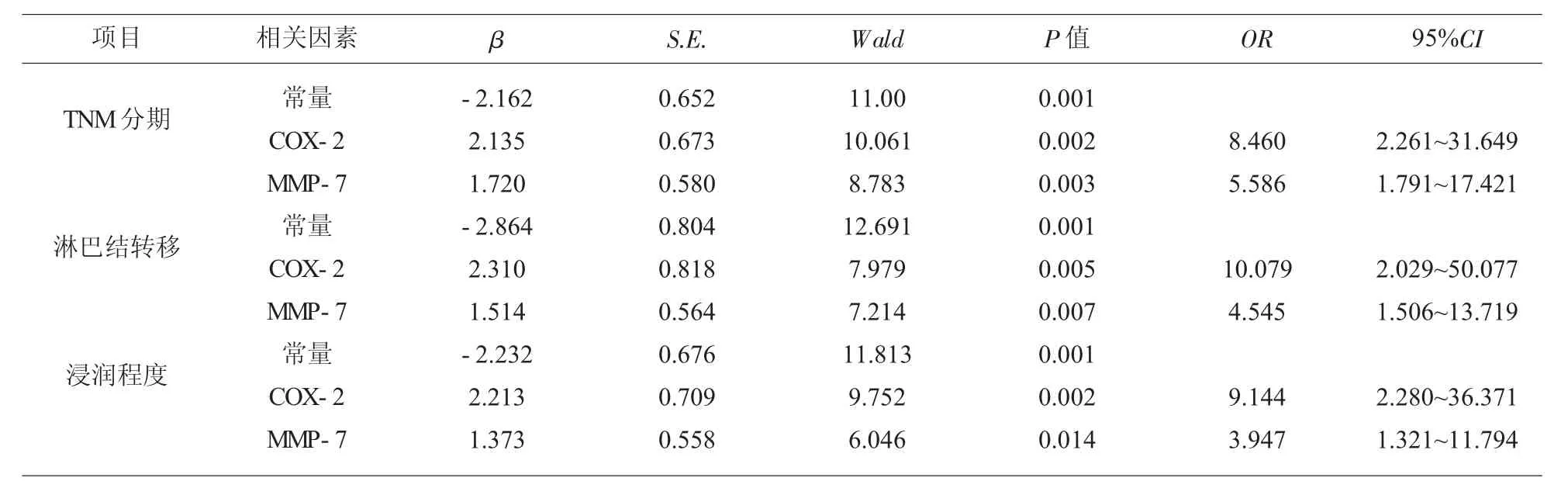
表2 肺腺癌组织中COX-2 及MMP-7 表达与临床病理特征的关系分析
3 讨论
随着近年来手术、化疗、放疗及靶向治疗的不断改进,肺腺癌患者临床治疗取得较好效果,但多数患者治疗后不可避免地出现复发及进展, 严重影响患者生存质量。 因此,了解与肺腺癌进展相关的生物学指标对指导临床治疗肺腺癌具有重要意义。
COX-2 是一种诱导型酶,属于膜结合蛋白,参与人体多种病理及生理过程, 多在肾脏组织及中枢神经系统中表达, 在大多数正常细胞组织中通常不表达或低浓度表达, 但在炎症及肿瘤组织中表达升高,已有研究证实,COX-2 可能是潜在的癌基因,且与肿瘤的发生及进展关系密切[5-6]。MMP-7是基质蛋白酶家族中最小的分子, 主要由巨噬细胞及肿瘤细胞分泌,具有一定的底物特异性,主要作用于细胞基质、细胞膜及细胞膜表面分子,多在人体正常上皮细胞中表达,但活性较低[7]。 文献报道[8],MMP-7 过表达多发生于各种上皮来源的间质肿瘤及肿瘤细胞,与肿瘤细胞的发生、浸润等密切相关。 结合上述COX-2、MMP-7 作用机制, 考虑COX-2、MMP-7 异常表达与肺腺癌肿瘤进展相关。本研究观察了不同临床病理特征的肺腺癌患者COX-2、MMP-7 表达情况,结果显示,不同TNM 分期、淋巴结转移及浸润程度的肺腺癌组织中COX-2、MMP-7 阳性表达具有差异性, 提示COX-2、MMP-7 可能与肺腺癌肿瘤分期、 转移及恶性程度有关。究其原因:COX-2 高表达可刺激血管因子生成, 促进肿瘤细胞增殖分化及新生肿瘤血管的形成,不仅增加肿瘤恶性程度且促进肿瘤进一步生长及对周边组织的浸润,增加肿瘤分期及转移风险[9]。同时,COX-2 可促进中性白细胞A549 的增殖,增加白细胞A549 与肿瘤细胞作用,促进炎症介质的释放,而大量炎症因子的释放,可发挥诱导和维护肿瘤血管作用,促进肿瘤新生血管生成,使肿瘤细胞增殖,增加癌细胞侵袭及转移能力[10-11]。 此外,COX-2 高表达的同时前列腺素E2 的释放量增加,而前列腺素E2 可提高细胞内cAMP 水平,抑制巨噬细胞、T 杀伤细胞活性,抑制机体免疫,导致肿瘤细胞的发生逃逸,导致肿瘤侵袭及转移[12-13]。MMP-7 可通过降解肿瘤细胞表面的FasL, 抑制Fas 与FasL 的结合,降低肿瘤细胞凋亡的敏感性,促进肿瘤生长,使肿瘤恶性程度增加[14]。MMP-7 可通过直接促进血管内皮细胞增殖活性, 诱导肺腺癌新生血管生成,不仅增加肿瘤恶性程度,且增加组织浸润及转移风险[15]。 MMP-7 可酶解机体中的链接组织生长因子, 而链接组织生长因子具有抑制血管内皮生长因子分泌作用,因此MMP-7 高表达可激活成纤维细胞分泌大量内皮生长因子, 增强血管生长因子活性,降低血管生成抑制因子活性,致使肺腺癌新生血管的生成,为肿瘤提供丰富的血供,促进肿瘤生长,逐渐侵袭周围组织器官,促进肺腺癌进展[16-17]。 进一步经logistic 回归分析结果显示,肺腺癌组织中COX-2 及MMP-7 阳性表达与TNM分期、 淋巴结转移及浸润程度密切相关。 提示COX-2 及MMP-7 参与肺腺癌的进展、 转移及浸润。 这进一步说明COX-2、MMP-7 高表达与肺腺癌细胞的增殖、浸润转移及恶性程度密切相关,可为临床肺腺癌的综合治疗提供一个新的靶点,以抑制肿瘤细胞增殖分化,降低复发及转移风险,更好地改善患者预后。
综上所述, 肺腺癌组织中COX-2、MMP-7 阳性表达率较高,与肿瘤分期、淋巴结转移及浸润程度密切相关, 可为临床肺腺癌综合治疗方案的制定提供依据。
