半枝莲多糖通过mTOR/P70S6K 通路对宫颈癌U14荷瘤小鼠的肿瘤抑制及诱导凋亡作用研究
2022-06-30高冬冬张静何苗
高冬冬,张静,何苗
(1.驻马店市中心医院肿瘤一科,河南 驻马店 463000;2.驻马店市黄淮学院医学院,河南 驻马店 463000)
宫颈癌是女性生殖系统常见恶性肿瘤, 发病高峰为45~50 岁, 近年来发病年龄有逐渐下降趋势,严重威胁女性生命健康。 宫颈癌病因复杂,早期无明显症状,出现相应症状时已发展到中晚期,目前认为人乳头瘤状病毒 (human papillomavirus,HPV)感染是主要致病因素,HPV 疫苗可预防相关高危型HPV 感染,但价格昂贵,限制其广泛应用。临床治疗宫颈癌主要依靠手术和放化疗, 患者通过治疗,可在一定程度延长生存期,同时不可避免出现副作用,影响患者继续治疗,因此开发低廉、安全、 有效的药物对提高患者生存质量具有重要意义[1]。 半枝莲是传统中药,有清热解毒、活血化瘀、抗炎、免疫调节等作用,主治疗疮肿毒、跌打损伤及水肿等。 研究显示,半枝莲对胰腺癌、结肠癌等恶性肿瘤具有良好抑瘤作用[2]。 多糖是一种天然大分子物质,其抗肿瘤生物活性已被证实[3]。 半枝莲多糖是半枝莲主要有效活性成分之一, 含有鼠李糖、半乳糖、甘露糖等,在宫颈癌中表现出明显抗肿瘤作用[4]。 但目前关于半枝莲多糖的抗肿瘤机制尚不明确,鉴于此,本研究通过建立宫颈癌荷瘤小鼠模型, 探讨半枝莲多糖抗肿瘤作用及其可能机制,为发掘中药治疗宫颈癌提供实验依据。
1 材料与方法
1.1 细胞系和实验动物 小鼠宫颈癌U14 细胞株,购自中国医学科学院北京药物研究所。
SPF 级BALA/c 雌鼠65 只,4~5 周龄, 体质量18~20 g, 购自北京维通利华实验动物技术有限公司[SCXK(京)2017-0011]。 购入后SPF 环境中适应性饲养1 周。
1.2 主要试剂和仪器 半枝莲多糖(30%)购自西安天康生物科技有限公司,溶血磷脂酸(lysophosphatidic acid,LPA) 购自上海阿拉丁生化科技股份有限公司,兔抗小鼠雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 单抗、p-pmTOR 单抗、B细胞淋巴瘤-2 (B cell lymphoma-2,Bcl-2) 单抗、Bcl-2 相 关X 蛋 白 (Bcl-2 associated X protein,Bax)单抗购自美国Abcam 公司,兔抗P70 核糖体蛋 白S6 激 酶 (P70 ribosomal protein S6 kinase,P70S6K)多抗购自美国Sant Cruze 公司,大鼠抗小鼠p-p70S6K 单抗购自美国Cell Signaling 公司,电泳仪购自美国BIO-RAD 公司。
1.3 建立荷瘤小鼠模型 建立荷瘤小鼠模型[5]:取对数增殖期U14 细胞,0.25%胰酶消化,PBS 洗涤后, 生理盐水调整细胞浓度为5×106个/mL 备用。随机抽取5 只小鼠,按0.1 mL/只腹腔接种U14 细胞, 正常饲养7~10 d 可见小鼠腹部隆起, 腹水增加,表明U14 腹水小鼠模型建立成功。 处死小鼠,无菌抽取腹水, 生理盐水稀释细胞浓度为2×106个/mL。 取60 只小鼠, 按0.1 mL/只接种于左前腋下,接种后4 d,可见肿瘤包块,接种率100%。
1.4 分组及治疗 将接种成功小鼠随机分为模型组、LPA 组、半枝莲组、半枝莲+LPA 组,每组各15只。接种成功后24 h 后进行治疗,半枝莲组灌胃半枝莲多糖3 g/kg(生理盐水溶解),1 次/d,连续14 d,末次灌胃同时尾静脉注射与LPA 组等量PBS;LPA组小鼠灌胃与半枝莲组等量生理盐水,1 次/d,连续14 d,末次灌胃同时尾静脉注射1 mg/kg 的LPA(PBS 溶解);半枝莲+LPA 组小鼠灌胃半枝莲和尾静脉注射LPA; 模型组小鼠灌胃生理盐水和尾静脉注射PBS。
1.5 测量肿瘤大小 治疗当天开始,观察小鼠活动情况,精神状态及肿瘤生长情况,每隔1 d,使用游标卡尺测量对肿瘤长径(a)和短径(b)进行测量,根据公式计算肿瘤体积(V),V=a×b2/2,绘制肿瘤生长曲线。
1.6 检测抑瘤率 末次治疗后24 h, 处死小鼠,无菌分离各组小鼠腋下肿瘤,电子天平称重,计算抑瘤率,抑瘤率(%)=(模型组瘤质量-治疗组瘤质量/模型组瘤质量)×100%。
1.7 检测肿瘤组织细胞凋亡和细胞周期 每组随机取5 只小鼠肿瘤组织, 制备肿瘤组织悬液,300目滤网过滤, 离心洗涤3 次, 调整细胞浓度为1×106个/mL,放入预冷的70%乙醇中4 ℃固定12 h,离心弃上清液, 预冷PBS 重悬细胞后, 加入RNA酶(Rnase)PI 染色液37 ℃避光染色30 min,之后再流式细胞仪激发波长488 nm 处检测,检测肿瘤细胞凋亡情况和细胞周期。
1.8 HE 染色观察肿瘤组织组织学变化 称重后,每组随机取5 只小鼠肿瘤组织放置于10%中性甲醛中,4 ℃固定48 h,梯度浓液乙醇对组织脱水,二甲苯透明,石蜡包埋,切片机切片,片厚约4 μm,常规苏木素、伊红染色,脱水、透明、封片,光学显微镜下观察肿瘤组织学形态。
1.9 免疫组化检测肿瘤组织Bax 和Bcl-2 表达 取肿瘤组织切片,脱蜡水化后,PBS 冲洗;放入枸橼酸钠缓冲液15 min 进行抗原修复,PBS 冲洗; 加入3% H2O2室温孵育10 min,消除内源性过氧化物酶活性;加入50 μL 样品血清室温孵育15 min;加入兔抗小鼠Bax 和Bcl-2 一抗,4 ℃孵育过夜,PBS洗涤;加入辣根过氧化物酶标记的山羊抗兔二抗,37 ℃孵育30 min,PBS 洗涤;DAB 显色; 苏木素复染,梯度浓度乙醇脱水,二甲苯透明,封片,光学显微镜下观察染色结果, 每张切片随机选取5 个视野,计算阳性表达率,阳性表达率(%)=阳性表达细胞数/细胞总数×100%。
1.10 Western blot 检测肿瘤组织mTOR、p-mTOR、P70S6K、p-P70S6K 蛋白表达 各组剩余肿瘤组织保存于液氮中, 取100 mg 液氮中保存肿瘤组织,加入RIPA 液裂解,12000 r/min 离心20 min(离心半径10 cm),取上清液,采用BCA 法测定蛋白浓度,100 ℃加热使蛋白变性, 定量后, 进行SDSPAGE 电泳, 电泳结束后将蛋白转至PVDF 膜上,加入适量封闭液封闭2 h,TBST 洗膜,将膜放入1∶1000 稀释的mTOR、p-mTOR、P70S6K、p-P70S6K一抗中4 ℃孵育过夜,TBST 洗膜, 放入1∶4000 稀释的HRP 标记的二抗中室温孵育2 h,TBST 洗膜,加入ECL 化学发光剂,曝光显影,使用Image J 软件分析蛋白条带灰度值, 以目的蛋白条带灰度值/内参β-actin 蛋白条带灰度值的比值,作为目的蛋白相对表达水平。
1.11 统计学方法 采用SPSS 22.0 软件处理数据,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠一般情况观察 荷瘤小鼠在注射U14 细胞后4 d 腋下出现肿瘤,小鼠弓背、脱毛,精神萎顿,行动迟缓,活动减少,反应迟钝,其中半枝莲组小鼠上述状态程度最轻。
2.2 各组小鼠肿瘤生长曲线 模型组肿瘤体积随时间延长之间逐渐增加;LPA 组较模型组肿瘤生长更快;半枝莲组肿瘤生长明显减慢;半枝莲+LPA组肿瘤生长较模型组慢,但较半枝莲组快。见图1。

图1 各组小鼠肿瘤生长曲线
2.3 各组小鼠肿瘤质量和抑瘤率 瘤质量和抑瘤率组间比较,差异有统计学意义(P<0.05)。 与模型组比较,LPA 组瘤质量增加, 半枝莲组、 半枝莲+LPA 组瘤质量减小(P<0.05);与LPA 组比较,半枝莲组、半枝莲+LPA 组瘤质量减小,抑瘤率升高(P<0.05);与半枝莲组比较,半枝莲+LPA 组瘤质量增加,抑瘤率降低(P<0.05)。 见表1。
表1 各组小鼠瘤质量和抑瘤率(±s,n=15)

表1 各组小鼠瘤质量和抑瘤率(±s,n=15)
注:与模型组比较,aP<0.05;与LPA 组比较,bP<0.05;与半枝莲组比较,cP<0.05。
组别 瘤质量(g)模型组LPA 组半枝莲组半枝莲+LPA 组F 值P 值2.53±0.15 2.92±0.17a 1.27±0.13ab 1.86±0.14abc 363.072<0.001抑瘤率(%)—-15.41±1.87 49.80±2.01b 26.48±1.98abc 428.236<0.001
2.4 各组小鼠肿瘤组织细胞周期和细胞凋亡率G0/G1 期、S 期细胞及凋亡率组间比较, 差异有统计学意义(P<0.05)。 与模型组比较,LPA 组G0/G1期细胞减少,S 期细胞增加,凋亡率降低,半枝莲组和半枝莲+LPA 组G0/G1 期细胞增加,S 期细胞减少,凋亡率升高(P<0.05);与半枝莲组比较,半枝莲+LPA 组G0/G1 期细胞减少,S 期细胞增加,凋亡率降低(P<0.05)。 各组G2/M 期细胞比较,差异无统计学意义(P>0.05)。 见表2。
表2 各组小鼠肿瘤组织细胞周期和细胞凋亡率(±s,n=15)
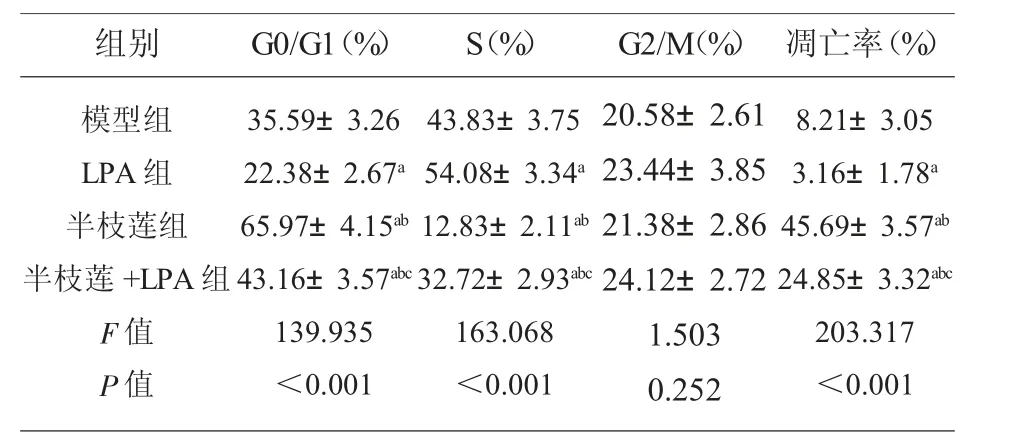
表2 各组小鼠肿瘤组织细胞周期和细胞凋亡率(±s,n=15)
注:与模型组比较,aP<0.05;与LPA 组比较,bP<0.05;与半枝莲组比较,cP<0.05。
组别 G0/G1(%)模型组LPA 组半枝莲组半枝莲+LPA 组F 值P 值35.59±3.26 22.38±2.67a 65.97±4.15ab 43.16±3.57abc 139.935<0.001 S(%) G2/M(%)43.83±3.75 54.08±3.34a 12.83±2.11ab 32.72±2.93abc 163.068<0.001 20.58±2.61 23.44±3.85 21.38±2.86 24.12±2.72 1.503 0.252凋亡率(%)8.21±3.05 3.16±1.78a 45.69±3.57ab 24.85±3.32abc 203.317<0.001
2.5 各组小鼠肿瘤组织学观察结果 HE 染色显示,模型组肿瘤组织细胞数量丰富,排列密集,核大深染,核异型,核浆比例高,无明显萎缩坏死现象;LPA 组与模型组形态相似, 肿瘤细胞生长良好;半枝莲组可见凋亡细胞,数量明显减少,核碎裂,出现萎缩、坏死现象;半枝莲+LPA 组较模型组细胞数量减少,但较半枝莲组多,可见少量萎缩坏死细胞。 见图2。

图2 肿瘤组织HE 染色结果(×400,A:模型组;B:LPA 组;C:半枝莲组;D:半枝莲+LPA 组)
2.6 各组小鼠肿瘤组织Bcl-2、Bax 蛋白表达水平肿瘤组织Bcl-2、Bax 阳性表达率组间比较,差异有统计学意义(P<0.05)。 与模型组比较,LPA 组Bcl-2 阳性表达率升高,Bax 阳性表达率降低, 半枝莲组、半枝莲+LPA 组Bcl-2 阳性表达率降低,Bax 阳性表达率升高(P<0.05);与半枝莲组比较,半枝莲+LPA 组Bcl-2 阳性表达率升高,Bax 阳性表达率降低(P<0.05)。 见图3。

图3 肿瘤组织Bcl-2、Bax 蛋白表达免疫组化结果(×400,A:模型组;B:LPA 组;C:半枝莲组;D:半枝莲+LPA 组)
2.7 各组小鼠肿瘤组织mTOR、p-mTOR、P70S6K、p-P70S6K 蛋白表达水平 肿瘤组织p-mTOR、p-P70S6K 蛋白表达组间比较,差异有统计学意义(P<0.05)。与模型组比较,LPA 组p-mTOR、p-P70S6K 蛋白表达增加,半枝莲组和半枝莲+LPA 组p-mTOR、p-P70S6K 蛋白表达减少(P<0.05);与半枝莲组比较, 半枝莲组+LPA 组p-mTOR、p-P70S6K 蛋白表达增加(P<0.05)。 各组mTOR、P70S6K 蛋白表达比较,差异无统计学意义(P>0.05)。 见表3、图4。
表3 各组小鼠肿瘤组织mTOR、p-mTOR、P70S6K、p-P70S6K 蛋白表达(±s,n=5)
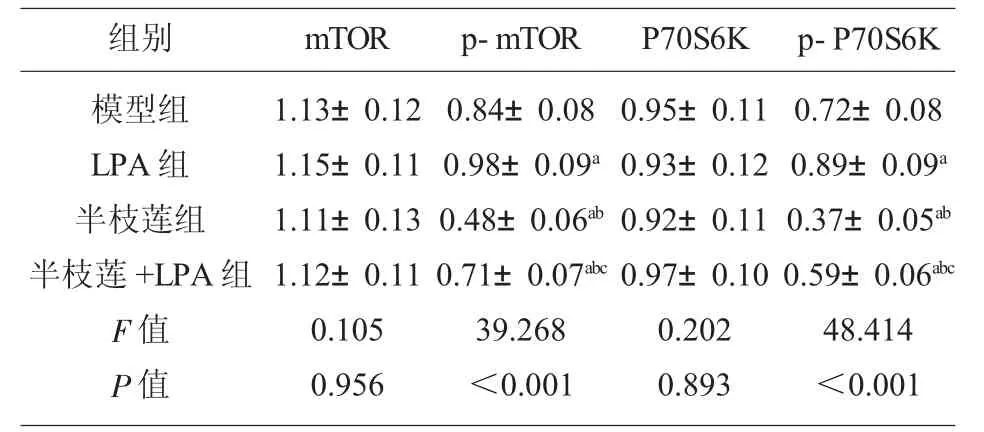
表3 各组小鼠肿瘤组织mTOR、p-mTOR、P70S6K、p-P70S6K 蛋白表达(±s,n=5)
注:与模型组比较,aP<0.05;与LPA 组比较,bP<0.05;与半枝莲组比较,cP<0.05。
组别 mTOR模型组LPA 组半枝莲组半枝莲+LPA 组F 值P 值1.13±0.12 1.15±0.11 1.11±0.13 1.12±0.11 0.105 0.956 p-mTOR P70S6K 0.84±0.08 0.98±0.09a 0.48±0.06ab 0.71±0.07abc 39.268<0.001 0.95±0.11 0.93±0.12 0.92±0.11 0.97±0.10 0.202 0.893 p-P70S6K 0.72±0.08 0.89±0.09a 0.37±0.05ab 0.59±0.06abc 48.414<0.001

图4 肿瘤组织mTOR、p-mTOR、P70S6K、p-P70S6K 蛋白表达(A:模型组;B:LPA 组;C:半枝莲组;D:半枝莲+LPA 组)
3 讨论
动物性移植肿瘤模型的建立对于研究肿瘤治疗具有重要意义, 其作为体内抗肿瘤药物筛选的有效方式,具有接种成功率高、个体差异小、实验周期短等优点,易于客观判断药物疗效[6]。 本研究采用皮下移植瘤模型,均接种成功,接种后第4 天可见小鼠左前腋下接种部位隆起,随时间延长,包块逐渐增大,肿瘤无自行消退,而使用半枝莲干预的小鼠,肿瘤生长趋势明显低于模型组,提示宫颈癌荷瘤小鼠模型建立成功。
肿瘤细胞具有无限增殖能力, 通过影响或调节细胞周期,可抑制肿瘤生长,发挥抗肿瘤作用[7]。细胞凋亡对维持机体自身稳定至关重要,在肿瘤发生发展过程中发挥负调控作用, 通过诱导细胞凋亡,阻滞肿瘤生长,是抗肿瘤的有效途径之一[8-9]。 化学药物在杀死肿瘤细胞的同时, 可导致机体免疫力下降,植物中的多糖成分副作用相对较小,临床已被成功用于抗肿瘤治疗[10-11]。 研究显示,多糖可通过阻滞细胞周期及诱导凋亡等途径发挥抗肿瘤作用[12-13]。Li 等[14]报道,半枝莲多糖对肝癌荷瘤小鼠具有明显抑瘤作用。Jin 等[15]研究表明,半枝莲可抑制结直肠癌细胞迁移和侵袭,从而发挥抗癌作用。另有研究显示, 半枝莲和白花蛇舌草配伍可降低肿瘤细胞糖酵解水平, 抑制胰腺荷瘤小鼠肿瘤生长[16]。 本研究半枝莲组小鼠肿瘤体积较模型组减小,抑瘤率达49.80%,G0/G1 期细胞显著增多,S 期细胞显著减少,凋亡率升高,且病理组织学检查显示肿瘤细胞数量减少,发生萎缩和坏死,提示半枝莲多糖将肿瘤细胞阻滞在G0/G1 期, 延长细胞周期,减少参与分裂细胞数,促进凋亡,发挥抑瘤作用。
mTOR 参与细胞增殖、 代谢和分化等过程中,通过磷酸化活化下游的P70S6K 发挥生物学作用[17]。 mTOR/P70S6K 信号通路与癌细胞生长、增殖密切相关,卵巢癌、食管癌等多种恶性肿瘤发生发展过程中均存在mTOR/P70S6K 信号通路调节异常[18-19]。Bcl-2 表达水平与恶性肿瘤发展关系密切,Bcl-2 可抑制细胞凋亡,Bax 为Bcl-2 同源基因,对细胞具有促凋亡作用。 mTOR/P70S6K 信号通路活化可增加Bcl-2 表达, 减少细胞凋亡, 抑制TOR/P70S6K 信号通路,可作为抗肿瘤靶点。 LPA 参与细胞多种生理病理过程,可通过竞争性结合,激活mTOR[20]。 本研究采用LPA 干预后,p-mTOR 和p-P70S6K 蛋白表达明显增加,Bcl-2 表达较高,Bax表达较低,病理学显示癌细胞生长良好,提示TOR/P70S6K 信号通路被激活,促进肿瘤细胞增殖;而使用半枝莲多糖治疗后, 各项指标与LPA 呈相反趋势; 在使用半枝莲多糖治疗后同时使用LPA,pmTOR 和p-P70S6K 表 达 升 高,Bcl-2 表 达 升 高,Bax 表达降低, 半枝莲多糖的抑瘤作用明显下降,提示半枝莲多糖可能通过抑制TOR/P70S6K 信号通路,阻滞细胞停留在G1/G0 期,调控凋亡基因表达,促进细胞凋亡,发挥抑瘤作用。
综上所述, 半枝莲多糖对宫颈癌荷瘤小鼠具有明显抑制肿瘤生长作用, 可能与抑制TOR/P70S6K 信号通路调节细胞周期,促进细胞凋亡有关,为临床治疗宫颈癌提供实验依据。
