IL-20 在房颤患者表达升高并调控胶原沉积
2022-06-30束颖
束颖
(河南省周口市中心医院急诊科,河南 周口 466000)
心房颤动(AF) 是临床上最常见的心律失常之一,其发病率会随着年龄增大而逐渐增加,60 岁以上人群发病率可达到12%[1-2]。 AF 可引起严重的临床后果,包括心功能下降和脑卒中,严重者可导致心力衰竭和死亡[3]。近年来,越来越多的AF 患者从药物治疗和手术治疗中获益,但AF 患者的总体预后仍然较差,尤其是老年患者[3-4]。 因此,寻找有效的干预靶点以预防AF 的进展具有重大的临床意义和社会价值。
白细胞介素20(IL-20)是一种小分子量的分泌蛋白, 于2001年被美国Chandrasekher 教授发现,属于IL-10 家族[5]。 IL-20 通常作为一个单体存在,可表达于多种免疫细胞和非免疫细胞,包括巨噬细胞、树突状细胞、心肌细胞和平滑肌细胞等,但在免疫细胞中表达尤为明显[6-9]。IL-20 的受体是由IL-20Rα 和IL-20Rβ 构成的异二聚体, 并广泛存在于多种器官和组织表面[5]。 IL-20 可以与靶细胞上的受体结合并激活STAT3、p38 和JNK 信号通路参与下游信号的调控,其中STAT3 通路是IL-20 最主要的信号通路[10-11]。 IL-20 可以调控多种生物学效应,包括生长发育、炎症反应、氧化应激、自噬和凋亡等, 并可参与多个系统疾病的进程[5,10,12-14]。
大量的研究证实,IL-20 与心脑血管疾病密切相关。 在高脂饮食喂养的雄性载脂蛋白E 敲除(ApoE-/-) 小鼠和缺氧诱导的脑卒中小鼠模型中,IL-20 的表达显著增高[15-17]。此外,在高脂饮食介导的ApoE-/-动脉粥样硬化小鼠模型中,给予重组小鼠IL-20 (rIL-20) 显著地促进其进程并放大炎症反应,并且IL-20 是动脉粥样硬化发展进程中的重要启动因素[17-19]。 然而,IL-20 在AF 中的表达和作用未知,这个研究的目的是检测IL-20 在AF 患者中的表达并探讨IL-20 参与AF 进程的可能机制。
1 材料和方法
1.1 血液标本的收集 本实验的研究人群为窦性心律患者和AF 患者。 纳入标准为:连续就诊于本科室的AF 患者。 排除标准为:患有影响IL-20 表达疾病的患者,包括慢性肾衰竭、慢性心力衰竭、肿瘤、冠心病、结缔组织疾病、其他心律失常、脓毒症和其他急性或慢行炎症性疾病等。
血液标本的收集分为2 个阶段。 第一阶段从2016年10月至2017年11月, 收集永久性AF 患者血液标本(n=78),窦性心律患者血液标本(n=60)作为对照。 分离每个血液样本中的CD4+T 淋巴细胞、 巨噬细胞和树突状细胞用于IL-20 mRNA 检测。 第二阶段从2017年12月至2019年4月,收集阵发性AF 患者(n=45), 持续性AF 患者(n=60)和永久性AF 患者(n=70)血液样本、窦性心律患者血液标本(n=62)作为对照。 分离每个血液样本中的血浆,用于检测IL-20 和TGF-β1 水平。其中,阵发性AF、持续性AF 和永久性AF 根据既往的文献进行划分[20]。
所有的血液样本均在河南省周口市中心医院急诊科收集,由临床经验超过5年的护士完成。 血液标本收集之前, 已告知患者及其家属样本仅用于科学研究,且患者或其家属签署知情同意。
1.2 方法
1.2.1 免疫细胞的分离 血液标本中免疫细胞的分离根据既往文献的描述完成[20]。 大致方法如下:每个血液标本中分别加入红细胞裂解液 (0.5 mL 红细胞裂解液/1 mL 血液样本, Servicebio) 裂解红细胞, 以Ficoll 密度梯度分离外周血单核细胞(PMBCs)。 使用磷酸盐缓冲液(PBS) 漂洗PMBCs 2 次,分别使用抗人CD4 和CD11b (Miltenyi Biotech) 阳性磁珠选择和分离样本中的CD4+T 淋巴细胞和单核细胞。 CD4+T 淋巴细胞给予人抗CD3 (1μg/mL,eBioscience)和人抗CD28 (1μg/mL,eBioscience)刺激其成熟[21],单核细胞给予人巨噬细胞集落刺激因子(M-CSF, 50 ng/mL, PeproTech)或人粒细胞-巨噬细胞集落刺激因子(GM-CSF, 50 ng/mL, Pepro-Tech)刺激其向巨噬细胞和树突状细胞分化[20]。
1.2.2 实时聚合酶链反应分析(TR-qPCR) 1.5 mL EP 管分别收集实验所需细胞, 每管中加入1 mL TRIzol 试剂(Invitrogen)分别对这些细胞进行裂解后, 收集各细胞的总mRNA。 使用逆转录试剂盒(Roche) 将总mRNA 转录为cDNA, 使用LightCycler 480 SYBR Green Master Mix (Roche) 进行PCR扩增,并进行靶基因mRNA 的检测,基因的表达使用GAPDH 进行标准化。 所有的样本均重复3 次,其平均值即为目的表达。 本实验中,CD4+T 淋巴细胞、巨噬细胞和树突状细胞中IL-20 mRNA 表达被检测,心脏成纤维细胞中α-SMA、胶原蛋白I (Collagen I)和胶原蛋白III (Collagen III) mRNA 表达水平被检测,RT-qPCR 引物序列,见表1。

表1 RT-qPCR 引物序列
1.2.3 酶联免疫吸附测定(ELISA) 血液样本在采集完成后被迅速转移至实验室, 所有样品在4°C条件下5 000×g 离心10 min,收集上清液(即血浆)后于-80°C 保存, 待进一步检测。 整个过程在45 min 内完成。
人IL-20 ELISA 试剂盒和人TGF-β ELISA 购自Thermo Fisher Scientific 公司。血浆样本从-80°C环境中取出并在4°C 环境中解冻, 然后用样品稀释液稀释血浆样品,根据厂家提供的说明书,用上述ELISA 试剂盒检测每个血浆样品中IL-20 和TGF-β1 的水平。 每个样本重复检测2 次。
1.2.4 细胞实验 小鼠心肌成纤维细胞购于Scien-Cell 研究 实 验 室, 在 含 有10% FBS (Gibco)的DMEM/F12 培养液(Gibco) 中培养和传代。 第5 代的细胞用于本实验,并被分成8 个组,在不含FBS的DMEM/F12 培养液培养12 h 后,各组细胞如下刺激:1. 溶剂 (二甲基亚砜,DMSO, Sigma); 2. 重组小鼠IL-20 (rIL-20,200 ng/mL, PeproTech)[22];3. S31-201 (50 μg/mL,Sigma)[23]; 4. rIL-20 + S31-201; 5. TGF-β1 (10ng/mL; PeproTech)[20]; 6. TGFβ1 + IL-20; 7. TGF-β1 + S31-201; 8. TGF-β1 +rIL-20 + S31-201。 每8 h 更换培养液一次, 刺激24 h 后收集细胞,按照上述方法检测α-SMA、Collagen I 和Collagen III mRNA 表达水平。
1.3 统计学分析 采用SPSS 23.0 对所有数据进行分析。 连续变量用(±s)表示,使用未配对t 检验分析两组之间的差异,one-way ANOVA 和随后进行Tukey’s 检验分析三组或更多组之间的差异。 分类变量以百分比表示, 使用Fisher 检验进行比较。IL-20 表达和TGF-β1 表达相关性使用Spearman相关分析。 通过线性回归来分析IL-20 是否与AF的发生有关。 P<0.05 为差异有统计学意义。
2 结果
2.1 基本临床特征 第一阶段患者:与窦性心律患者相比,永久性AF 患者AF 持续时间增加,左心房内径增大,其他临床特征无显著差异,包括年龄、性别、体重指数、抽烟、饮酒、高血压、糖尿病、基础心脏病、病变的瓣膜、左心室内径和左心室射血分数。 各组临床特征,见表2。 第二阶段患者: AF 持续时间在阵发性AF 组、持续性AF 组和永久性AF组中逐步增高,且均比窦性心律患者延长。 此外,窦性心律组、 阵发性AF 组和持续性AF 组左心房内径和左心室内径无显著差异, 且均小于永久性AF 组。其他临床特征在4 组间无显著差异。各组临床特征见表3。

表2 窦性心律者和房颤患者临床特征
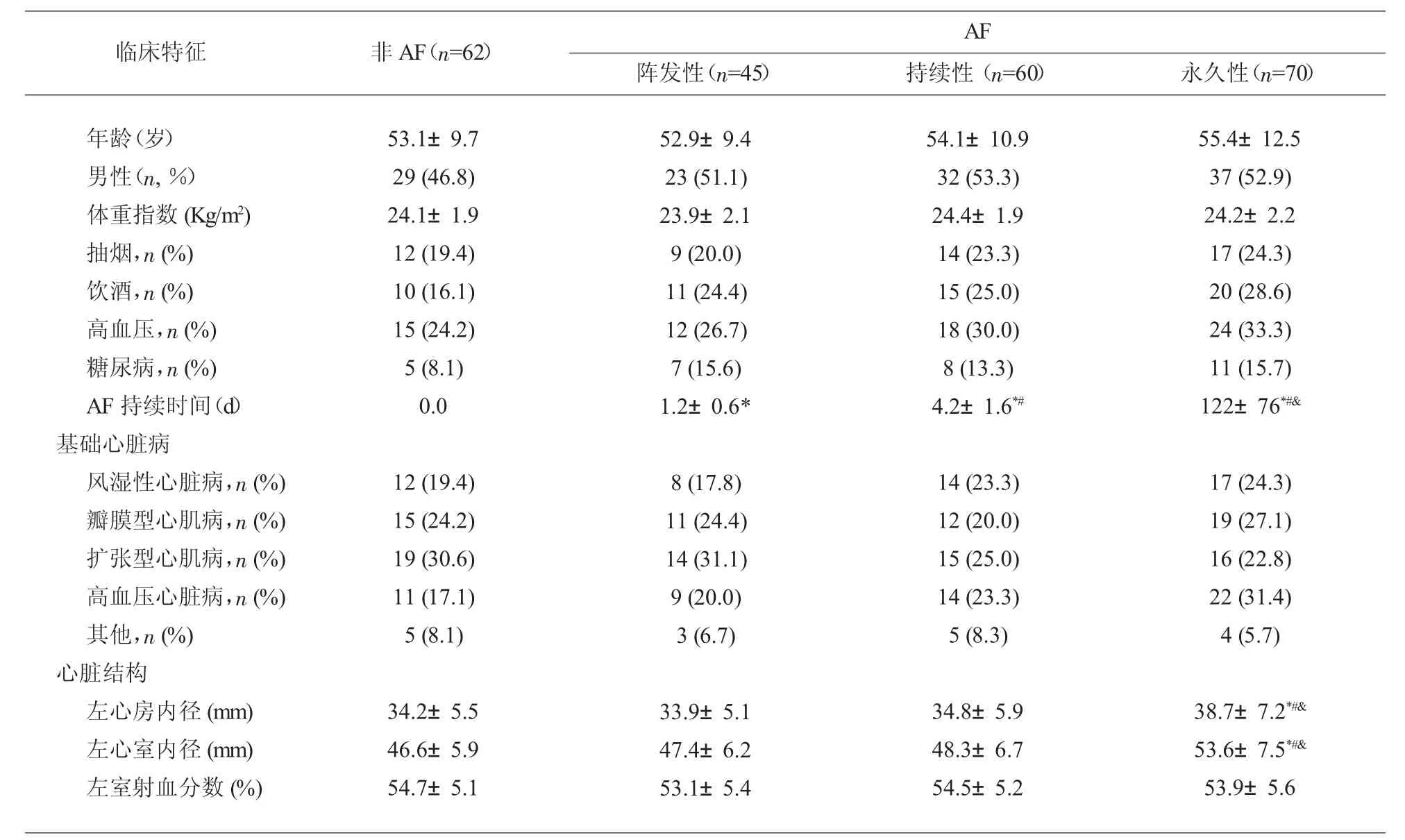
表3 非AF 者和AF 患者的临床特征
2.2 AF 患者巨噬细胞中IL-20 mRNA 表达显著升高 RT-qPCR 结果显示,AF 患者巨噬细胞中IL-20 mRNA 的表达比窦性心律患者巨噬细胞中增加了约2.9 倍,见图1B。 窦性心律患者和永久性AF患者CD4+T 淋巴细胞和树突状细胞中IL-20 mRNA 水平无显著差异,见图1A—图1C。

图1 AF 患者IL-20 mRNA 表达
2.3 AF 患者血浆IL-20 水平显著升高 ELISA 的结果表明,血浆IL-20 水平在阵发性AF 组、持续性AF 组和永久性AF 组中逐步增加, 且均显著高于窦性心律患者,见图2A。血浆TGF-β1 水平表现出与IL-20 相似的趋势,见图2B。Spearman's 相关性分析显示AF 患者中血浆IL-20 水平和TGF-β1水平正相关,见图2C。 根据有无老年、男性、超重、抽烟、饮酒、高血压或糖尿病,AF 患者被分成2 组,结果表明合并有抽烟、饮酒、高血压或糖尿病的AF患者表现出更高的IL-20 水平,各组样本量、IL-20水平和P 值,见表4。
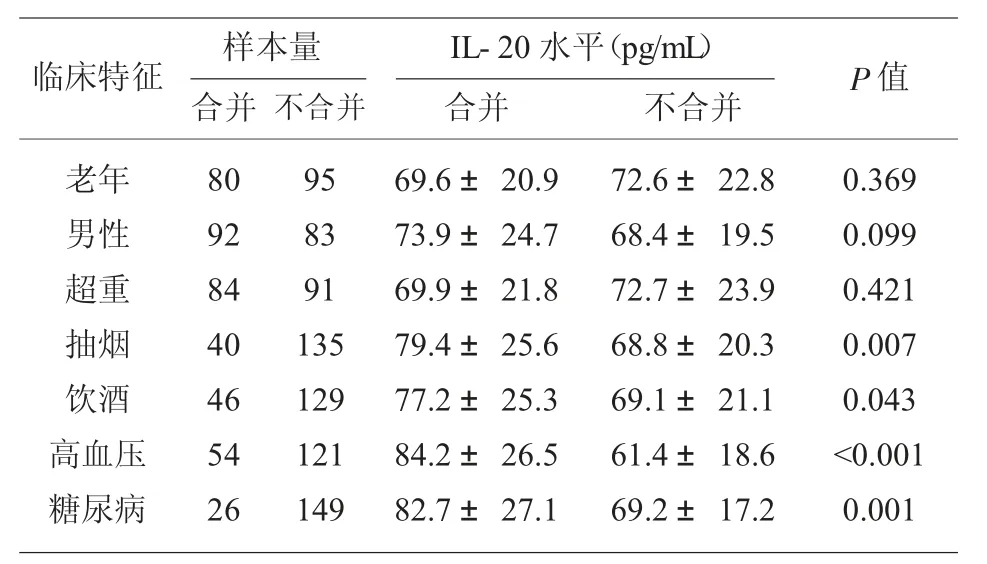
表4 临床因素对IL-20 表达的影响
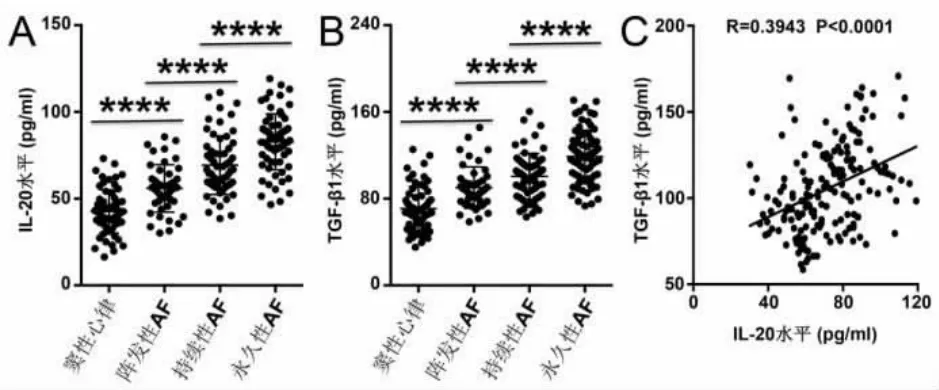
图2 AF 患者循环IL-20 和TGF-β1 水平
2.4 IL-20 与AF 的发生独立相关 为明确IL-20与AF 发生的关系,IL-20 水平、TGF-β1 水平、老年、男性、超重、抽烟、饮酒、高血压、糖尿病和左房内径等变量用来进行单因素回归分析, 结果显示IL-20 水平、TGF-β1 水平、抽烟、饮酒、高血压、糖尿病表现出趋势,即可能和AF 的发生相关。 这些变量被用来进行多元回归分析, 结果显示,IL-20、TGF-β1、抽烟、高血压、糖尿病均与AF 的发生独立相关。 各变量的β 值、95%CI、P 值,见表5。

表5 通过单变量分析和随后的多变量线性回归分析评估血清IL-20 和AF 发生的关系
2.5 rIL-20 处理增加TGF-β1 介导的心脏成纤维细胞胶原沉积 在体外实验中,TGF-β1 处理显著增加了小鼠成纤维细胞α-SMA、Collagen I 和Collagen III mRNA 的表达, 给予rIL-20 进一步增加这些纤维化标志物mRNA 表达, 使用S31-201 显著的逆转rIL-20 对成纤维细胞的调控作用。 而在未给予TGF-β1 处理的小鼠成纤维细胞中,rIL-20和S31-201 对成纤维细胞胶原沉积无显著影响,见图3。
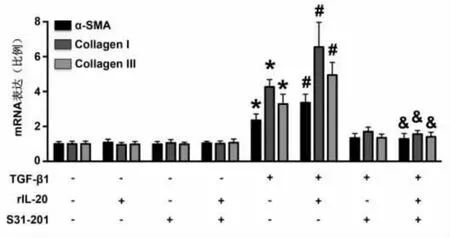
图3 IL-20 对胶原合成的影响
3 讨论
在本研究中,我们检测了IL-20 在AF 患者中的表达,结果表明AF 患者巨噬细胞中IL-20 mRNA 的表达水平显著增高, 表明AF 患者中巨噬细胞可能是IL-20 的主要来源。 此外,循环IL-20 在AF 患者中增高,并且和TGF-β1 水平正相关,多种临床特征如抽烟、饮酒、高血压和糖尿病可以影响IL-20 的分泌, 回归分析结果表明IL-20 可能和AF 的发生独立相关。 在体外实验中,rIL-20 显著增加TGF-β1 介导的胶原沉积, 这种作用可以被S31-201 逆转。
AF 的发病机制十分复杂,包括炎症反应、氧化应激等多种病理因素均参与其进程, 其中炎症反应发挥至关重要的作用[24-26]。IL 成员可以通过调控炎症反应参与多种心血管疾病, 且多个成员被证实与AF 相关。 Gungor 等人报道,IL-1 受体拮抗基因等位基因2 多态性与人孤立性AF 的发生密切相关[27]。 IL-2 在AF 患者中显著升高,与低IL-2 水平组相比,高IL-2 水平组的预后较差[28]。 而IL-6 -174G/C 基因多态性显著地增加冠状动脉搭桥术后AF 的发生率[29]。此外,降低循环IL-17 水平和升高循环IL-17 水平分别可以降低和升高AF 发生和复发率[30-31]。 IL-27 基因rs153109 多态性的G等位基因和GG 基因型显著提高了中国汉族人群的AF 易感性[32]。 近期的研究发现,IL-22 在AF 患者血浆和心房组织均升高,并且和AF 的发生独立相关[20]。 而本研究发现循环IL-20 水平在AF 患者中升高,线性回归结果表明IL-20 可能和AF 的发生独立相关, 这提示IL-20 可能参与AF 的发生,也是对IL 和AF 相关性的进一步补充和完善。 此外,AF 患者巨噬细胞中IL-20 mRNA 表达显著增高,表明在AF 中巨噬细胞可能是IL-20 来源。 巨噬细胞是一类重要的免疫细胞, 可以介导强烈的免疫反应并释放多种炎症物质,表明IL-20 可能是通过调控炎症反应参与AF 进程。
在人和动物AF 心房组织中可以观察到心房重构和心房纤维化。 有研究证实,延缓心房重构可以显著减少AF 的发生率和并缩短AF 持续时间[20,32]。近期发表的一项长期临床随访研究显示, 延缓心房纤维化显著增加AF 射频消融术的成功率并减少复发率, 提示心房纤维化引起的电重构可能是房颤发生发展的主要原因[33]。 事实上,越来越多的研究关注心房纤维化作为心房阻滞的机制, 动物研究和临床实验数据显示, 严重的心房纤维化会导致AF 的发生率和持续时间增加;此外,抑制心房纤维化显著抑制AF 的发生和进展的假说已经越来越被接受[34-36]。 这表明,病理因素可能导致心房重构,包括心房结构改变和心房纤维化,心房电重构最终导致AF 的发生和发展,提示心房纤维化是AF 最直接的发病机制。 而在本研究中,我们发现AF 患者IL-20 水平和TGF-β1 水平呈正相关,表明IL-20 可能是通过调控心房纤维化参与AF进程。
IL-20 是一种多功能的细胞因子,已被证实参与多种生物学效应。 越来越多的研究表明,IL-20与纤维化的进程密切相关,其中中和或下调IL-20表达分别可以减少硬皮病中皮肤纤维化或肝纤维化,而增加IL-20 表达可以加剧慢性肾衰竭介导的肾纤维化[22,37-38]。 这表明IL-20 可以影响多种器官或组织的纤维化进程, 尽管其在心肌纤维化中的作用暂未见报道。 为了探讨IL-20 参与AF 可能的机制,我们检测IL-20 对TGF-β1 介导的小鼠心脏成纤维细胞胶原沉积的影响, 结果表明rIL-20 处理进一步增加成纤维细胞胶原沉积,提示IL-20 可以通过加重心房纤维化加速AF 进程。STAT3 通路是IL-20 最主要的信号通路,并且与心房纤维化和AF 的发生密切相关[39-40]。 为了进一步探讨机制,我们使用特异性的STAT3 通路抑制剂S31-201 进行干预,结果显示IL-20 对成纤维细胞胶原沉积的作用被S31-201 显著逆转。 这些结果表明,IL-20 可能是通过激活STAT3 通路, 加重心房重构和心房纤维化,进而调控AF 进程。
总之, 这个研究发现在AF 患者中IL-20 增高, 并且初步阐明IL-20 参与AF 进程可能的机制。 但具体的机制仍不明确,需要动物实验进一步明确。
