静态核酸制备技术试剂盒在乙型肝炎低病毒载量样本检测中的应用*
2022-06-29曲人亮杨勇卫刘静静刘君玮
曲人亮,杨勇卫,张 帅,刘静静,刘君玮
山东省烟台市奇山医院检验科,山东烟台 264001
乙型肝炎病毒(HBV)感染是我国最严峻的公共卫生问题之一[1]。而血清中HBV-DNA载量是检测HBV感染最直接的指标[2],血清中的HBV-DNA水平变化可以为乙型肝炎(以下简称乙肝)的临床诊治提供依据[3]。近年来,由于抗病毒药物的应用,患者体内的HBV-DNA水平往往维持在较低水平,临床多出现用药后反弹的情况[4]。相关指南指出:为了避免乙肝复发,HBV-DNA需控制在实时荧光定量PCR检测不到的水平(5~10 IU/mL)[5]。目前,国内三甲医院多采用罗氏COBAS核酸检测系统,其定量限在20 IU/mL,少数医院采用国产试剂盒,其定量限普遍在100 IU/mL,灵敏度较低,不能满足美国肝病研究协会的标准和乙肝临床诊断治疗的需求。基于以上问题,急需一种检测乙肝低病毒载量的技术。然而病毒载量的检测结果往往受到实时荧光定量PCR反应过程中产生的非特异性产物的干扰,影响了结果的判断[6]。这就对HBV-DNA的临床检测技术提出了更高的要求。
国家药品监督管理局批准北京纳捷诊断技术有限公司研发的HBV-DNA定量检测试剂盒上市,灵敏度达到5 IU/mL[7]。该试剂盒采用了最新的静态核酸制备技术试剂盒,在1个试管中完成核酸提取及扩增全过程,样本直接加到核酸裂解液中无须混匀,具有静态漂洗、磁珠参与PCR反应,无核酸丢失及操作步骤少、低值重复性好、实验室污染可控的优势,可对低病毒载量进行检测,结果可靠性高。本研究采用世界卫生组织(WHO)标准品及临床样本,同时与罗氏COBAS核酸检测系统进行比对,旨在分析静态核酸制备技术试剂盒的检测能力,现报道如下。
1 资料与方法
1.1一般资料 WHO标准品(批号:201601),浓度为1.0×108IU/mL,经HBV-DNA阴性血清3次100倍稀释后,制成1.0×102IU/mL标准品。取40 mL的1.0×102IU/mL标准品稀释样本与10 mL HBV-DNA阴性血清混匀,制成80 IU/mL的稀释样本,然后采用阴性稀释液进行1∶1倍数稀释,依次制成浓度为80.00、40.00、20.00、10.00、5.00、2.50、1.25 IU/mL的待测样本。收集烟台市奇山医院80例罗氏COBAS核酸检测系统检测临床样本,其中20例表面抗原阴性体检人员血清样本(献血员样本),20例结果小于20 IU/mL的样本,40例结果在20.0~2.0×107IU/mL的样本。
1.2仪器与试剂 选择北京纳捷诊断试剂有限公司生产的HBV-DNA定量检测试剂盒(PCR-荧光探针法)和上海宏石医疗科技有限公司生产的SLAN-96P扩增仪进行研究。选择罗氏COBAS核酸检测系统进行对比检测。
1.3方法 静态核酸制备技术试剂盒与罗氏COBAS核酸检测系统同步对80.00、40.00、20.00、10.00、5.00、2.50、1.25 IU/mL的稀释样本和HBV-DNA阴性血清进行检测。
除此以外,用静态核酸制备技术试剂盒检测临床样本1~80,其中临床样本1~20为表面抗原阴性样本,临床样本21~40为罗氏COBAS核酸检测系统检测结果小于20 IU/mL的样本,临床样本41~80为罗氏COBAS核酸检测系统检测结果在20.0~2.0×107IU/mL的样本。
静态核酸制备技术试剂盒:按照HBV裂解液每人份100 μL+HBV内标1.0 μL配制裂解液,充分混匀后立即按每孔100 μL分装到PCR扩增管中。在已经分装提取液的PCR管内加入100 μL待测样本(校准品、质控品同样本操作),无须混匀;室温静置5~10 min。将PCR管转移至磁力架上,静置2~3 min,用移液器或负压装置吸取上清液后丢弃。保持PCR管在磁力架上,每孔加入HBV漂洗液(DWB)250 μL,静置2 min,用移液器或负压装置吸取上清液后丢弃。取相应量的HBV PCR反应液及HBV酶混合液,按(HBV PCR反应液每人份43.0 μL+HBV酶混合液每人份2.0 μL)比例配制,充分混匀成PCR-Mix,即刻使用。每孔加入45.0 μL的PCR-Mix,盖上管盖,颠倒轻轻弹下磁珠,使PCR-Mix与磁珠充分混匀,水平瞬时离心。将PCR反应管转移至检测区,置于荧光定量PCR仪上进行检测。
1.4统计学处理 采用SPSS20.0对两种方法的抗污染性能、检测限和定量限、精密度[即变异系数(CV)],测定值lg差值及相关系数进行统计分析。并对两种方法的操作性进行比较。
2 结 果
2.1静态核酸制备技术试剂盒的抗污染性能 利用静态核酸制备技术试剂盒对20例表面抗原阴性样本进行4次重复检测,结果全为阴性,符合率均为100%。静态核酸制备技术试剂盒抗污染性能良好,试验结果准确、有效。
2.2静态核酸制备技术试剂盒的检测限、定量限和精密度评价 用静态核酸制备技术试剂盒对1.25、2.50、5.00、10.00、20.00、40.00、80.00 IU/mL样本进行了4次重复检测。11个1.25 IU/mL样本共检出10个,检出率达90.9%,2.50、5.00、10.00、20.00、40.00、80.00 IU/mL样本检出率100.0%,表明静态核酸制备技术试剂盒检测限在1.25 IU/mL,定量限在2.5 IU/mL,低于试剂盒标明的5.00 IU/mL,不同浓度样本检测结果层次分明,分辨率高。而罗氏COBAS核酸检测系统检测限在20.00 IU/mL,静态核酸制备技术试剂盒灵敏度较高,检测限、定量限较低,见表1。

表1 静态核酸制备技术试剂盒检测标准品稀释样本的检出率及CV
40.00、80.00 IU/mL样本检测结果显示,静态核酸制备技术试剂盒的CV分别为4.28%和4.77%,均小于5%,优于罗氏COBAS核酸检测系统的6.51%和6.21%。静态核酸制备技术试剂盒精密度高,检测结果重复性较好。见表2。

表2 罗氏COBAS核酸检测系统检测标准品稀释样本的检出率及CV
2.3对20例罗氏COBAS核酸检测系统检测结果小于20.00 IU/mL样本的检测结果 用静态核酸制备技术试剂盒检测20例罗氏COBAS核酸检测系统检测结果小于20.00 IU/mL的样本,45%的样本检测结果大于5.00 IU/mL,表明静态核酸制备技术试剂盒灵敏度明显高于罗氏COBAS核酸检测系统。
2.4两种方法的准确性研究 用静态核酸制备技术试剂盒检测40例罗氏COBAS核酸检测系统检测结果在20.0~2.0×107IU/mL的样本,结果显示,两种方法测定值lg差值均未超过±0.5。两试剂盒相关系数为0.994 9。见表3。
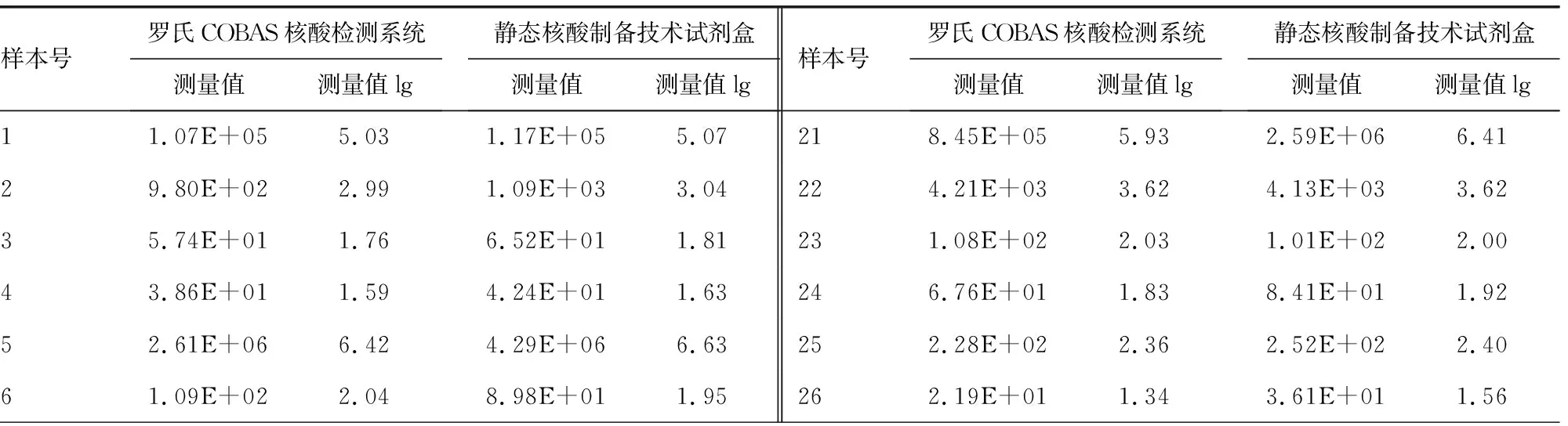
表3 静态核酸制备技术试剂盒与罗氏COBAS核酸检测系统检测结果比对

续表3 静态核酸制备技术试剂盒与罗氏COBAS核酸检测系统检测结果比对
2.5两种方法可操作性比较 两种方法进行核酸制备的方法比较见表4。两种方法PCR扩增性能比较见表5。

表5 PCR扩增性能比较
3 讨 论
乙肝是我国最常见的传染病之一,目前由于抗病毒治疗药物的应用,患者体内的病毒水平往往维持在较低水平[7],若检测结果不准确极易误导临床诊断治疗,导致病情复发[8],如何准确检测低HBV-DNA载量样本是实验室急需解决的问题之一。基于美国肝病研究协会提出的5~10 IU/mL的检测要求,静态核酸制备技术试剂盒较好地补充了我国HBV-DNA检测技术的短板[5]。该技术可实现核酸提取全过程在1个试管中进行,静态漂洗无须混匀操作,不仅避免污染且减少了核酸丢失;裂解液中含有50%构象磁珠等成分,能快速分离蛋白抓取核酸;试剂性能稳定,低值重复性好。若能实现自动化提取,将会极大提高我国基层实验室的检测能力。
本研究显示,静态核酸制备技术试剂盒抗污染能力强,定量限在2.50 IU/mL,远高于罗氏COBAS核酸检测系统的20.00 IU/mL,且低值重复性好,检测结果层次分明,分辨率高。采用静态核酸制备技术试剂盒检测罗氏COBAS核酸检测系统检测结果小于20.00 IU/mL的样本,其中45%的样本检测结果大于5.00 IU/mL,相比罗氏COBAS核酸检测系统,静态核酸制备技术试剂盒灵敏度更高,能有效防止漏检,更适合我国临床检测实验室。准确性研究结果显示,两种技术方法检测结果相差较小,相关系数为0.994 9,无明显差异。两种方法可操作性比较,静态核酸制备技术试剂盒在操作时间、成本、检测通量等方面均优于罗氏COBAS核酸检测系统。
静态核酸制备技术试剂盒为具有独立知识产权的国内专利技术,综合性能显著优于罗氏COBAS核酸检测系统,且操作简单、快速,但静态核酸制备技术试剂盒处于发展初期,目前核酸提取及扩增均为人工操作,与全自动仪器相比,对操作人员的要求更高,若能制造稳定的全自动静态核酸制备技术试剂盒设备,该技术能成为进口技术的替代产品,为临床抗病毒治疗疗效观察提供更科学、准确的依据。
静态核酸制备技术试剂盒与罗氏COBAS核酸检测系统检测HBV-DNA比较,其定量限达到5.00 IU/mL,是罗氏COBAS核酸检测系统(20.00 IU/mL)的1/4;线性范围为5.0~2.0×109IU/mL,高于罗氏COBAS核酸检测系统(20.0~1.2×108IU/mL)。罗氏COBAS核酸检测系统检测HBV-DNA在核酸提取纯化后需用洗脱液从磁珠上洗脱并溶解核酸,检测灵敏度易受洗脱和溶解效率的影响,而静态核酸制备技术试剂盒直接在磁珠核酸中直接添加PCR扩增试剂,无须磁珠核酸洗脱溶解,检测灵敏度不受影响;且静态核酸制备技术试剂盒操作简单,仅需5步即可完成核酸提取和扩增,检测40个样本,从核酸提取到PCR结果报告仅需2 h左右,每天检测通量可达到3 000个样本,而罗氏COBAS核酸检测系统则需要7 h左右,每天检测通量不到1 000个样本,静态核酸制备技术试剂盒每天检测通量为罗氏COBAS核酸检测系统的3倍[7]。而且静态核酸制备技术试剂盒不需要贵重设备,国产荧光PCR仪即可检测,仪器设备费用低,各基层医疗科研单位均可实现检测,试剂盒成本较低,为罗氏COBAS核酸检测系统的1/5左右,适合我国国情。
