酱香型白酒酿造酒醅中产香芽孢杆菌的分离鉴定
2022-06-29戴奕杰杨文佳
戴奕杰,杨文佳,刘 燕
(1.贵阳学院生物与环境工程学院,贵州贵阳 550005;2.贵州省山地珍稀动物与经济昆虫重点实验室,贵州贵阳 550005)
中国传统白酒与白兰地、威士忌、伏特加、杜松子酒和朗姆酒并称为世界六大蒸馏酒。作为我国一种传统的粮食发酵蒸馏酒,白酒酿造以高粱为原料,大曲作为糖化发酵剂,通过固态微生物发酵、固态蒸馏、贮存和勾兑生产而成。我国白酒历史悠久,是全球白酒行业的重要贡献者。根据其独特的香气特征,可将中国白酒划分为12 类,其中浓香型白酒、清香型白酒、酱香型白酒、米香型白酒是我国白酒的四大基础酒类。
酱香型白酒生产工艺复杂,距今已有上千年历史,经两次投料(下沙、糙沙)、九次蒸煮、八次发酵以及七次蒸馏取酒,最终贮存、勾兑、调味、贮存而成。
堆积发酵是酱香型白酒生产过程中非常关键的一个环节。这个阶段涉及的微生物群落结构的动态变化十分复杂,细菌、酵母等迅速生长繁殖,并产生多种酶类和其他代谢物质。原料中的蛋白质在这些酶的作用下被水解成各种氨基酸,酶与各代谢物质间也会相互作用发生美拉德反应和其他化学反应,促进具有酱香风味的化合物的生成,赋予白酒独特风味特征。Wang 等通过16S、18S rRNA 基因测序技术研究了大曲、高粱及空气、窖池、窖泥等3 个发酵谷物样品和12 个环境样品中的微生物群落组成,得出细菌主要来源于大曲,其次是空气、窖泥和高粱。高温大曲(60~65 ℃)的优势菌群是细菌,而非真菌,原因在于芽孢杆菌等部分细菌能够适应高温等环境条件。酱香型白酒发酵过程中,高温大曲中的细菌及其代谢产物对于最终白酒的风味和质量至关重要。
Wang 等使用表型分类和常规生化鉴定大曲中的微生物群落结构。得出优势细菌属为芽孢杆菌属()、醋杆菌属()、乳杆菌属()和梭菌属(),其中芽孢杆菌属菌株数量最多。有学者研究了茅台酒发酵过程中的细菌群落结构,发现大曲成熟期的主要优势菌为芽孢杆菌科,且该菌同为堆积发酵前期和窖池发酵厌氧阶段的优势菌。芽孢杆菌属于嗜热性细菌,发酵后期迅速生长繁殖,释放大量热量。研究发现芽孢杆菌内生孢子的耐热性是由spo-VA2moboperon 介导的。且研究证明:、和能 够代谢产生丙酸、1,3-丁二醇、乙酸、甲酯等物质,其中大部分物质是酱香型白酒中常见的挥发性风味物质。
高温大曲生产和堆积发酵过程中的优势菌是芽孢杆菌,对酱香型白酒的品质具有一定的贡献作用。堆积发酵及入窖发酵过程中微生物种类繁多、复杂多变,对其中优势菌株进行筛选并将其作为功能发酵剂充分利用是目前的研究热点。
本研究通过选择性培养基从传统酱香型白酒酿造工艺中的窖池厌氧发酵的酒醅中筛选得到1株产香菌株,通过进一步形态学观察、生理生化试验及分子生物学方法确定该菌株为解淀粉芽孢杆菌,为今后该菌株发酵性能的研究及白酒酿造工艺中功能发酵剂的挖掘奠定基础。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品采集
按照传统酱酒的酿造工艺,本研究对某酱香型白酒生产企业进行实地采样。选取同一窖池七个轮次窖池发酵工序的酒醅,根据如图1 的9 个取样点的位置进行取样,每轮次取样量保持一致。将收集到的9 个取样位置的酒醅混合均匀后,分装于无菌袋封装标记,置于4 ℃的冰箱保存备用。
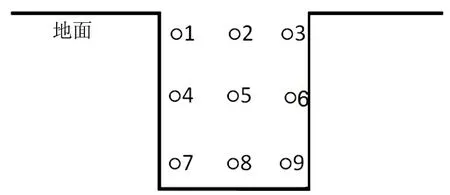
图1 窖池发酵酒醅取样示意图
1.1.2 培养基与试剂
培养基:肉汤(琼脂)培养基购于北京陆桥技术股份有限公司。
试剂:GN、BCL 反应卡购买于梅里埃(VITEK2);16S 引物(F16S-27、R16S-1492)、2×Rapid Taq Master Mix、回收试剂盒(NEP025-1 50T)均来自北京鼎国昌盛生物技术有限公司。
1.1.3 仪器设备
恒温培养箱(HPX9272MBE),上海博讯;均质器,梅里埃(Smasher);PCR仪(DL9700 96孔),东林昌盛;恒温孵育器,鼎国昌盛;全自动微生物分析系统,梅里埃(VITEK2)。
1.2 试验方法
1.2.1 菌株的分离纯化
称取25 g 七个轮次混匀后的酒醅,放置于盛有225 mL 无菌生理盐水的均质袋中,用均质器拍打1 min,制成1∶10 的菌悬液。用无菌吸管吸取1 mL 的1∶10 菌悬液,注入盛有9 mL 无菌生理盐水的无菌试管中,振摇试管混合均匀,制成1∶100 的样品匀液。重复上述操作进行梯度稀释至10,然后分别吸取10 μL 不同稀释度(10~10)的菌悬液于肉汤(LB)琼脂培养基中进行涂布,每个稀释度涂布两个平皿。将平板置于30 ℃恒温培养箱中倒置培养1 d。挑取多个不同形态的单个菌落,于培养基上进行划线以纯化菌株,每日观察并记录菌落的生长情况。
1.2.2 菌株的保藏
挑取纯化好的单个菌落于肉汤琼脂斜面培养基中划线,将斜面培养基置于30 ℃培养箱中培养,菌落长满斜面后,将培养基置于4 ℃冰箱中保藏。每三个月需将试管中的菌种传代一次,保证其活力。
1.2.3 菌株的鉴定
挑取斜面培养基中的菌种在肉汤琼脂培养基中划线,置于30 ℃培养基中培养48 h 以活化菌种,以备优势菌株的形态学观察、生理生化鉴定及分子生物学鉴定。
1.2.3.1 形态学观察
菌落形态观察:将活化好的菌株接种至LB 固体培养基和液体培养基中,30 ℃培养,每天观察并记录固体培养基上菌落的颜色、形状、光泽、突起程度、边缘形状等。
细胞形态:无菌操作下,挑取菌株于载玻片上进行革兰氏染色,于100×油镜下观察其颜色变化及细胞形态特征。
革兰氏染色法:参考《微生物学实验教程》(第三版)进行。
1.2.3.2 生理生化鉴定
菌株生理生化鉴定通过全自动微生物鉴定系统VITEK®2 Compact 实现。包括:革兰氏阳性菌鉴定卡(GP)、芽孢菌鉴定卡(BCL)。主要操作流程为:挑取单个优势菌进行纯培养,制备一定浓度的菌悬液,将卡片按顺序放在载卡架上,将导液管插入菌悬液中,上机测试。2~10 h 系统自动打印鉴定结果。
1.2.3.3 分子生物学鉴定
根据操作步骤使用试剂盒提取待待测菌株的总DNA。使用引物F16S-27(AGAGTTTGATCCTGGCTCAG)和R16S-1492(CGGTTACCTTGTTACGACTTC)扩增菌株的目的片段。PCR 扩增过程如下:94 ℃初始变性5 min,进行35 个循环,即94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s,循环结束后,72 ℃单次延伸10 min,最后在4 ℃孵育结束。PCR 反应体系为:25 μL 的2×Rapid Taq Master Mix,10 μM的每个引物(1.0 μL),1.0 μL 的模板DNA及22.0 μL 的ddHO。1 %的琼脂糖凝胶电泳鉴定PCR产物。
在NCBI 网站将获得的基因序列进行BLAST(Basic Local Alignment Search Tool),选取数据库中与测定序列同源性高于99 %的序列进行比对,将得到的比对结果使用MEGA 软件中的Neighborjoining算法构建系统发育树。
2 结果与分析
2.1 产香菌株的筛选
每个稀释度(10~10)的平板上挑取20 个菌落进一步分离纯化,观察菌株在LB 固体培养基上的菌落形态和细胞形态特征,七轮次混合酒醅中共分离到12 株菌落形态不同的菌,结合革兰氏染色结果,12 株菌落形态不同的菌中6 株菌为革兰氏阳性菌,其在肉汤琼脂培养基上的菌落形态和细胞形态如表1所示。

表1 菌株的菌落形态和细胞形态
为判断各菌的产香性能,将筛选到的6 株革兰氏阳性菌DAI bj-1、DAI bj-2、DAI bj-3、DAI db-1、DAI db-2、DAI db-3 接种至肉汤液体培养基(试管)中,分别编号为1、2、3、4、5、6,于30 ℃培养5 d,通过感官评价试管内的香气特征进行复筛,结果如表2所示。

表2 菌株香气特征
由表2 可知,除4 号、6 号试管无明显香味外,其余4 支试管均有一定的清香味,1 号、3 号试管香气特征相似,菌株生长较旺盛,香气强度均高于2号、5 号试管,且均具有一定的酱香味,但3 号试管除酱香外还有微微的酸味,2 号试管具有淡淡的酯香味。因此从筛选到的6 株菌中选用综合产香性能较优的DAI bj-1作为目标菌株。
2.2 形态学观察
菌株DAI bj-1 菌落形态与细胞形态如图2 所示,由图2 可知,纯化后的单个菌落在LB 固体培养基上形状为圆形,颜色呈淡黄色,边缘不规则,中间突起不透明,表面湿润。挑取单个菌落于载玻片上通过革兰氏染色法于显微镜下观察到该菌株的细胞形态为:形状呈杆状,革兰氏染色结果为阳性。

图2 菌株的菌落形态(a)和细胞形态(b)
2.3 生理生化鉴定
由菌株DAI bj-1的形态学观察结果,可初步得到该菌为革兰氏阳性菌,因此可通过VITEK® 2 Compact 系统中的革兰氏阳性菌鉴定卡(GP)和芽孢菌鉴定卡(BCL)进一步确定。该全自动微生物鉴定系统可快速、高效、准确地通过各生理生化试验确定该菌株。其GP 和BCL 鉴定结果如表3、表4所示。根据最终结果报告显示:革兰氏阳性菌鉴定卡(GP)中,苦杏仁苷(AMY)、D-甘露糖(dMNE)、D-半乳糖(dGAL)、α-葡萄糖苷酶(AGLU)、水杨素(SAL)等21 项结果呈阳性,磷酸酶(PHOS)、D-木糖(dXYL)、α-半乳糖苷酶(AGAL)、β-D-葡萄糖苷酸酶(BGUR)等22 项结果呈阴性;芽孢菌鉴定卡(BCL)中,β-木糖苷酶(BXYL)、丙酮酸盐(PVATE)、肌醇(INO)、D-葡萄糖(dGLU)、腐胺同化(PSCNa)等32 项结果呈阳性,磷酰胆碱(PHC)、L-脯氨酸芳胺酶(ProA)、N-乙酰-D-氨基葡萄糖(NAG)、麦芽三糖(MTE)等14 项结果呈阴性。根据VITEK® 2 Compact 全自动微生物鉴定系统中的GP、BCL结果,判断该菌株可能为芽孢杆菌。
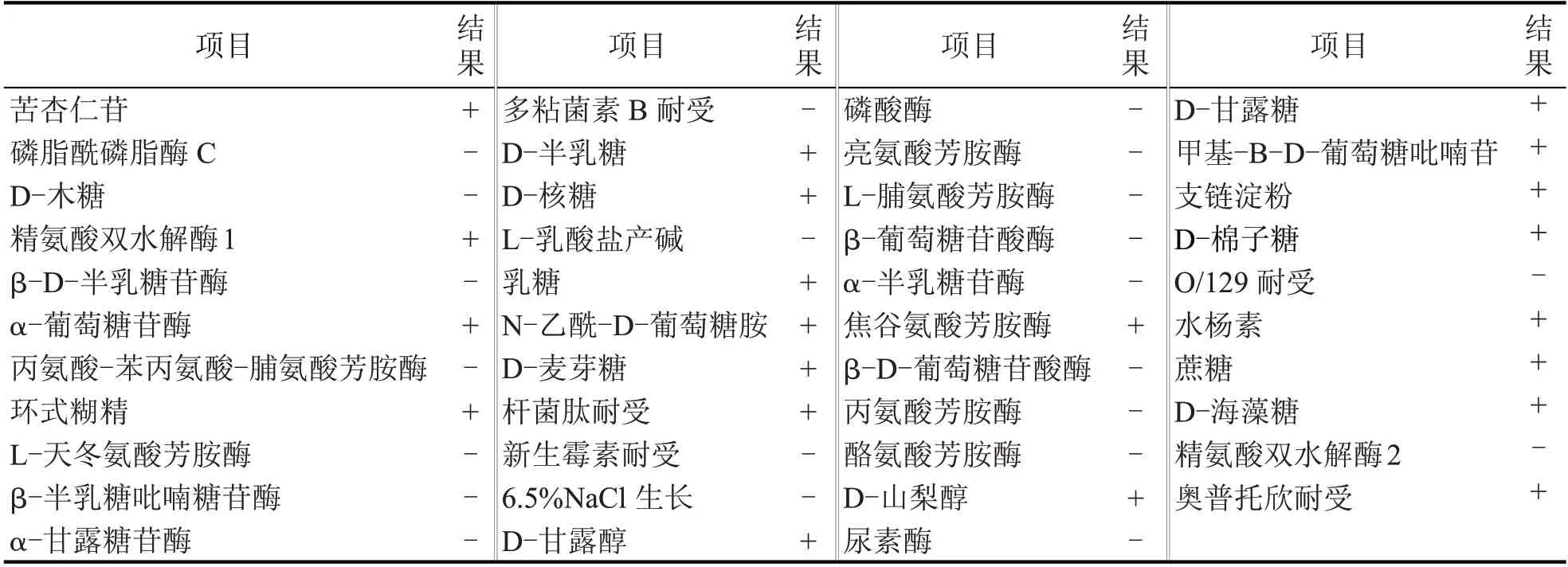
表3 VITEK 2 GP鉴定结果
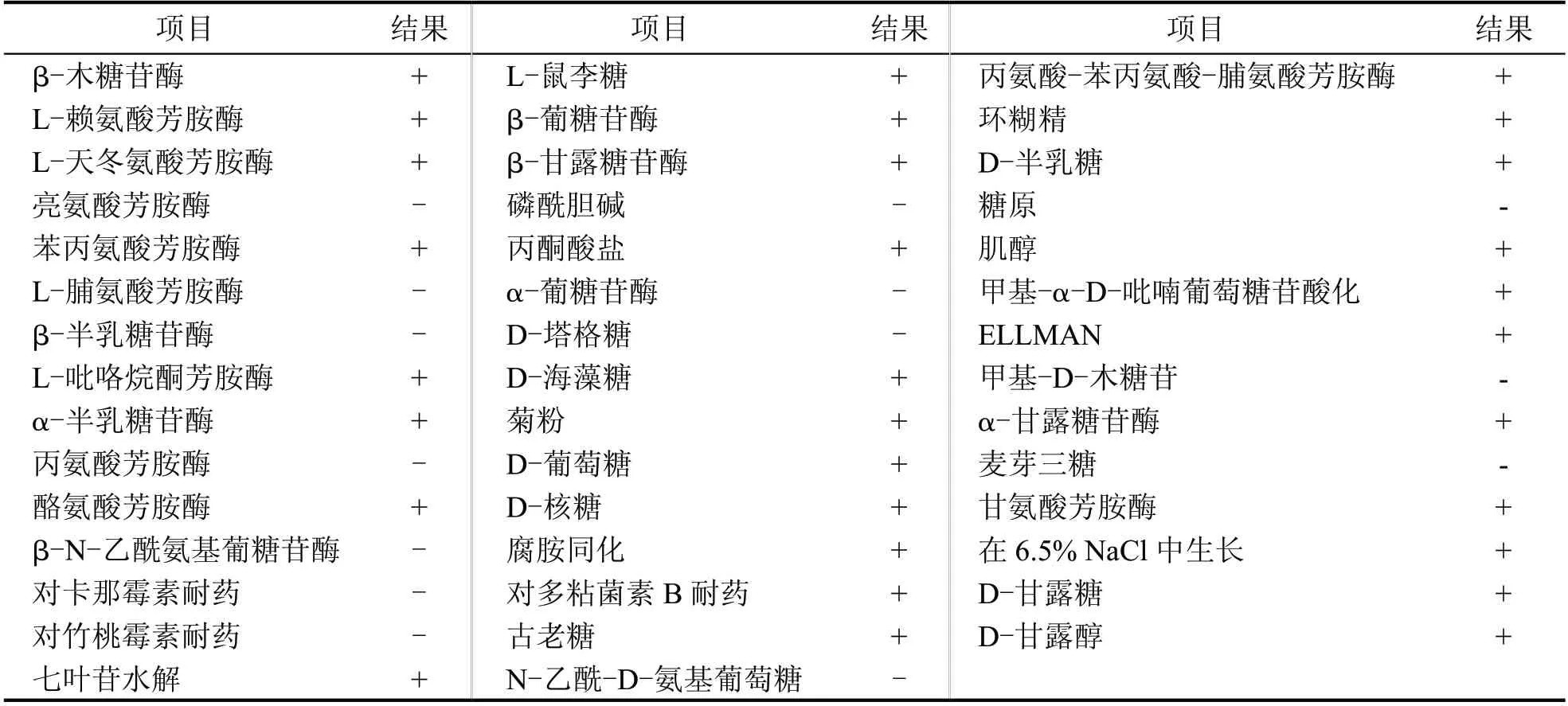
表4 VITEK 2 BCL鉴定结果
2.4 系统发育树的建立
为验证VITEK® 2 Compact 全自动微生物鉴定系统结果的准确性及确定酒醅中分离到的菌株DAI bj-1 为哪种芽孢杆菌,提取该菌株DNA 后,PCR扩增上机测序。
将测序所得的该菌株的基因序列与NCBI在线基因数据库中的已知序列进行比对,按照相似性高低进行排序后得到:菌株DAI bj-1的基因序列与数据库中的strain Ba13(Sequence ID:MG846076.1)具有99.93 %的相似性。选取Genbank 数据库中与测试菌株的序列同源性较高的已知菌株的序列进行多序列比对,将比对结果通过Mega-X 软件使用Neighbor-joining 算法构建系统发育树图3。
由图3 可知,菌株DAI bj-1 为芽孢杆菌,且其与的遗传进化距离接近,位于同一个分支。因此,结合形态学、生理生化鉴定结果,可确定,传统酱香型白酒酿造工艺中的窖池厌氧发酵的酒醅中筛选出的优势菌为解淀粉芽孢杆菌()。
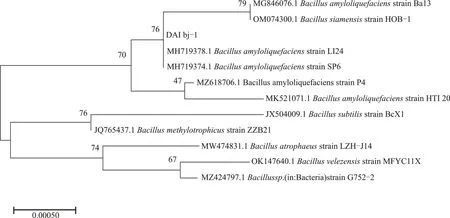
图3 菌株系统发育树
3 讨论
本研究涉及了一种全自动微生物分析系统(VITEK 2 Compact),该鉴定系统通过改良后的氧化、水解等生化反应,可实现细菌的鉴定和药敏试验。其自动化程度高,与PCR 检测技术、API 鉴定系统鉴定出的结果具有较高的符合率,具有快速、高效及较高的准确性、可重复性和安全性等特点,因此可广泛应用于食品中各类微生物的鉴定分析。
酱香型白酒共经历两次投料(下沙、糙沙)、九次蒸煮、八次发酵以及七次蒸馏取酒,受到发酵温度、酒醅中水分含量、酸度及糊化程度等影响,不同轮次酒醅中的微生物多样性存在一定的差异性。在这复杂的工艺过程中,酒醅中的微生物资源丰富,芽孢杆菌属()、片球菌属()、乳杆菌属()、梭形杆菌属()、假丝酵母属()、曲霉属()等微生物迅速生长繁殖,成为优势微生物,对酱香型白酒产品良好品质的形成具有重要意义。
芽孢杆菌作为酒醅中的主导功能性细菌,在不同轮次酒醅中呈先上升后下降,最后趋于稳定的变化趋势。该菌属对酱香型白酒品质的影响主要体现在其代谢产生的蛋白酶、淀粉酶等多种酶类能将酒醅中丰富的蛋白质、糖类等大分子物质水解成多种风味前体物质,在改善产品风味的同时赋予其独特的风味特征。罗建超等从大曲中分离筛选的解淀粉芽孢杆菌、枯草芽孢杆菌等产香菌,其代谢产物有2,6-二甲基吡嗪、β-苯乙醇、3-羟基-2-丁酮和异戊酸等10种风味物质。
解淀粉芽孢杆菌作为芽孢杆菌属的一种,无毒无害,对抗生素敏感,具有良好的乙醇、牛胆汁耐受能力,能分泌木聚糖酶、β-葡聚糖酶、淀粉酶等多种酶类及胞外多糖,在促进营养物质吸收、抑制病原菌、免疫调节等方面发挥重要作用。为了改善白酒中典型风味物质减少这一现象,有学者将筛选到的解淀粉芽孢杆菌作为发酵剂接种至冷却后的蒸粮中堆积发酵一定时间后,发酵初期芽孢杆菌的相对丰度从82.14%增加到88.47%,与对照组相比,酒醅和白酒中的四甲基吡嗪含量分别增加了26倍和24 倍,该物质不仅是一种含氮杂环化合物,赋予白酒焦糊和烤芝麻香气,它还是具有多种生物活性的潜在功能成分。结合感官分析,得出解淀粉芽孢杆菌在增强白酒香气的同时还具有改善产品质量等作用。此外,某些极端环境条件有利于芽孢杆菌的生长繁殖,因此该菌在工业酶制剂生产方面也具有广大的应用前景。
本研究从七轮次混合的酒醅中分离筛选到了一株产香芽孢杆菌,通过观察该菌在LB 固体培养基上的菌落形态及细胞形态特征,结合全自动微生物生理生化鉴定系统及分子生物学等鉴定方法,最终确定该菌株为解淀粉芽孢杆菌()。目前,已有研究证明该菌对白酒风味具有贡献作用,因此,将其作为发酵剂按照相应比例添加至白酒中进行发酵,测定并分析其与未接种发酵剂的白酒相比风味成分的差异,初步建立了解淀粉芽孢杆菌与白酒风味物质间的联系。同时可进一步研究剖析该菌的发酵性能及其代谢途径,了解该菌对白酒品质的具体作用机制,在此基础上,将其作为功能发酵剂对调控各类白酒风味、质构等品质具有巨大的发展潜力。
