连栽对杉木幼苗生长的影响及其代谢基础
2022-06-26刘敬灶

摘要:連栽导致的外源因素改变打破了杉木在防御与生长间资源调配的平衡,从而严重限制了杉木的生长和发育,成为我国南方杉木人工林经济最大化的重要制约因素。次生代谢调节是植物响应与抵御外部胁迫的重要措施,也是杉木响应和适应连栽障碍的生化基础。然而,针对杉木应对连栽障碍的次生代谢基础方面的研究依然薄弱,极大限制了对杉木响应和适应连栽障碍生化机制的认知。通过对连栽组和撂荒地对照组的杉木幼苗林进行土壤理化物质、幼苗生长量和幼苗代谢物的测定,分析连栽过程中杉木幼苗差异响应连栽障碍的生理与代谢基础。结果发现,相对于对照组(撂荒地),连栽组的土壤毛管孔隙度降低了23.05%,土壤总孔隙度降低了13.22%,有效磷含量降低了73.17%,全碳含量降低了30.23%、全氮含量降低了24.87%。各处理杉木幼苗中,总共测得147个代谢物。其中,差异代谢物87个,大多数隶属于类黄酮生物合成通路,该通路有抵抗生物和非生物胁迫的功能,说明连栽障碍会对杉木幼苗的生长形成明显的胁迫,且此胁迫可能由土壤毛管孔隙度、土壤总孔隙度、土壤有效磷含量、土壤全碳含量和土壤全氮含量差异导致,进而造成了苗高生长量降低了26.62%,地径生长率降低了30.74%,冠幅生长量降低了25.9%。本研究探究了连栽障碍影响杉木幼苗的代谢基础,可为生产中改善和缓解杉木的连栽障碍以及为杉木人工林地可持续经营和科学管理提供理论依据。
关键词:杉木;次生代谢物质;土壤理化性质;生长量
中图分类号:S 718.3 文献标志码:A 文章编号:0253-2301(2022)04-0064-09
DOI: 10.13651/j.cnki.fjnykj.2022.04.011
Effects of the Continuous Planting on the Growth of Cunninghamia lanceolataSeedlings and Its Metabolic Basis
LIU Jing-zao
(Fujian Taining State-owned Forest Farm, Sanming, Sanming, Fujian 354400, China)
Abstract: The change of exogenous factors caused by the continuous planting broke the balance of resource allocation between the defense and growth of Cunninghamia lanceolata, which severely restricted the growth and development of Cunninghamia lanceolata, and became an important constraint factor for the economic maximization of Cunninghamia lanceolata plantation in south China. The secondary metabolic regulation was an important measure for plants to respond to and resist the external stress, and was also the biochemical basis for Cunninghamia lanceolata to respond to and adapt to the continuous planting obstacles. However, the studies on the secondary metabolic basis of Cunninghamia lanceolata in response to the continuous planting obstacles were still weak, which greatly limited the understanding of the biochemical mechanisms of Cunninghamia lanceolata in response to and adaptation to the continuous planting obstacles. Through the determination of soil physical and chemical substances, seedling growth and metabolites of Cunninghamia lanceolata seedling forest in the group of continuous planting and the control group of abandoned land, the physiological basis and metabolic basis of the differential response of Cunninghamia lanceolata seedlings to the continuous planting obstacles were analyzed. The results showed that compared with the control group (abandoned land), the soil capillary porosity, total porosity, available phosphorus content, total carbon content and total nitrogen content in the group of continuous planting decreased by23.05%,13.22%,73.17%,30.23% and24.87%, respectively. A total of147 metabolites were detected in Cunninghamia lanceolata seedlings with each treatment. Among them, there were87 differential metabolites, most of which belonged to the flavonoid biosynthesis pathway, and the pathway had the function of resisting the biological and abiotic stresses, indicating that the continuous planting obstacles could cause the obvious stress on the growth of Cunninghamia lanceolata seedlings, and this stress might be caused by the difference of soil capillary porosity, total porosity, available phosphorus content, total carbon content and total nitrogen content. As a result, the growth of seedling height, the growth rate of ground diameter and the growth of crown diameter decreased by26.62%,30.74% and25.9%, respectively. This study explored the metabolic basis of Cunninghamia lanceolata seedlings affected by the continuous planting obstacles, which could provide theoretical basis for improving and alleviating the continuous planting obstacles of Cunninghamia lanceolata in production and for the sustainable management and scientific management of Cunninghamia lanceolata artificial forest.2283DCCB-D908-4E40-9EC8-FD85965DE850
Key words: Cunninghamia lanceolata; Secondary metabolites; Soil physicochemical property; Growth
杉木Cunninghamia lanceolata Lamb.Hook.作為我国南方地区的主要造林树种,在生态保护、林区经济增长和森林碳汇等方面贡献卓著[1],其可持续发展对维护森林生态系统稳定及我国现代林业的发展具有极其重要的意义[2]。目前我国杉木种植方法主要为人工林集约经营模式,在这种传统模式下,由多代连栽导致的杉木人工林地力衰退问题日益严重,主要表现为林内出现水土流失、生物多样性下降、土壤地力衰退等生态问题[3],严重影响了杉木经济和生态效益的发挥。目前,国内对于连栽障碍的研究主要针对杉木林自身生物学特性[4]、过度的人为干扰[5]以及土壤微环境的变化[6]等,依然缺乏对杉木自身响应连栽障碍的生理生化基础的研究。诸多研究已经证实[7-9],次生代谢调节是植物(杉木)响应外部胁迫(连栽障碍)的主要生化手段。近年来,代谢组学的发展越来越完善,广泛地应用在研究面临胁迫的植物生长状况[10]。目前前人已经在杉木涩籽发生机理[11]、土壤增温和氮沉降对杉木幼树细根的影响[12]、凋落物中次生代谢物对森林土壤可溶性氮的影响[13]等方面进行了一定的研究。有研究表明[14-16],杉木体内存在抑制种子萌发及幼苗生长的物质,致其人工林存在自毒现象,针对这一现象,代谢组学可研究杉木在受到连栽障碍时其植物体内所产生的代谢的变化,从而揭示连栽障碍产生的原理,进而为杉木人工林连栽障碍提供有效措施,实现杉木人工林的可持续发展。
本研究以种植在连栽组和撂荒地(仅有低矮灌木,没有种过杉木)对照组样地的杉木幼苗作为研究对象,分析了两者在土壤理化性质即土壤毛管孔隙度、土壤总孔隙度、有效磷含量和土壤化学元素含量的差异,比较了连栽的外源因素(土壤条件)的差异;此外,对幼苗生长量和代谢物进行了比较,探索了不同土壤条件下杉木的生理与代谢指标的差异。本研究旨在了解连栽对杉木幼苗生长的影响及其次生代谢响应基础,为从小分子化合物的角度解决杉木的连栽障碍提供理论基础,并为其人工林地可持续经营和科学管理提供理论依据。
1材料与方法
1.1研究区概况
试验地位于福建省泰宁国有林场。福建省泰宁国有林场地处福建省西北边陲泰宁县(26°54′6.2928″N,117°11′29.4936″E),毗邻江西省的南丰、广昌、黎川等地。地形突兀,四周高中间低,呈阶梯式下降。属于亚热带季风气候,表现出明显的山地气候特点,气温较低,冬季气温寒冷,夏季昼夜温差大。年平均气温18℃,极端最高温40℃,极端最低温-11℃,年降水量1765 mm,全年积温5000℃左右,适合林木生长发育。这里杉木分布较多、较广,且品质优良。试验林位于林场将上管护区23林班7大班1小班,海拔305~328 m,坡向西南,坡度18°左右。
1.2样品采集与处理
取两年生杉木幼苗作为试验对象,其中2019年5月砍伐杉木清除伐桩后种植的杉木作为连栽组(NE);撂荒地(仅有低矮灌木)作为对照组(NO);连栽组和对照组的海拔、坡向、坡位均一致。
在2020年10月1日进行土壤取样,分别在连栽组和对照组的杉木林地中,设置一个20 m×20 m的样方。在每个样方中随机选取3个部分,每部分去除地面枯枝落叶层、石粒,使用土钻(3.5 cm直径)取0~20 cm新鲜土样各3份,将每个部分取到的3份土壤样本混合为一个土样,用自封袋封装做好标记带回实验室。土壤样品带回实验室后,剔除土样中石块、植物根等杂物,自然风干土壤后,将风干土磨碎后过2 mm土壤筛。最后将每部分过筛后的土壤平均分为3小份,共18个土壤样本,用于测量土壤的理化性质。
在2019年10月到2020年10月进行生长量的取样,对采集土壤样品时所选取的18个点对应的杉木幼苗进行苗高生长量、地径生长量和冠幅生长量的测定。
在2020年10月1日进行代谢组的取样。在中午1点左右分别在连栽组和对照组的杉木幼苗林地设置的样方中随机选取3棵杉木幼苗,尽量保持样本(颜色、衰老程度、叶脉占比、光照、位置等)一致进行采集。每种条件下取3整片叶片,混合为一个植物样品,用锡箔纸包裹并标记后,迅速放入液氮中冷冻处理至少15 min。取出后迅速放入自封袋中(每组一袋),在自封袋中放入标签纸注明样本信息(连栽组:NE1、NE2、NE3;对照组:NO1、NO2、NO3)。迅速放入-80℃,冰箱冻存,足量干冰寄送。
1.3土壤理化性质的测定
土壤毛管孔隙度、土壤总孔隙度采用环刀法测定[17]。土壤有效磷的测定采用碳酸氢钠法-钼锑抗比色法测定,土壤全碳(TC)、全氮(TN)使用全自动碳氮分析仪(Elemental Analyzer Vario ELIII,德国)测定,土壤全量养分使用双酸消煮土壤制备待测液,采用电感耦合等离子体发射光谱仪测定,以上土壤化学性质分析方法来自土壤农业化学分析方法[18]。
1.4杉木幼苗生长量的测定
杉木幼苗生长量的测定采用标准木测量法,分别在2019年10月和2020年10月对样方内选取的18株杉木幼苗进行苗木高、地径和冠幅的测定,其中苗木高采用直尺测量,地径和冠幅采用游标卡尺测定[19]。幼苗苗高、地径和冠幅的净生长量即为杉木幼苗一年的苗木生长量、地径生长量和冠幅生长量。
1.5代谢组测序
代谢组测序是将收集到的植物样本基于液质联用(LC-MS)技术[20-21]进行非靶向代谢组学研究,实验流程主要包括:(1)进行样本的收集;(2)样本代谢物的预处理,包括样本的代谢物提取;(3)LC-MS/MS上机检测;对鉴定到的代谢物进行功能和分类注释,主要的数据库包括KEGG、HMDB、LIPID MAPS等。同时使用数据处理软件,对样本中检测到的色谱峰进行积分,并使用总峰面积对定量结果进行归一化,最后得到代谢物的定量结果。2283DCCB-D908-4E40-9EC8-FD85965DE850
1.6数据处理
利用CD软件进行代谢数据预处理,mzCloud、mzVault和MassList数据库搜索进行代谢物定性定量分析;将检索到的代谢物定性及定量数据进行信息分析。研究数据采用Excel 2010進行整理与分析,采用GraphPad Prism 7软件进行t检验、方差分析和多重比较,差异显著性水平定义为0.05,试验数据以平均值±标准差表示。
2结果与分析
2.1连栽组和对照组土壤理化性质分析
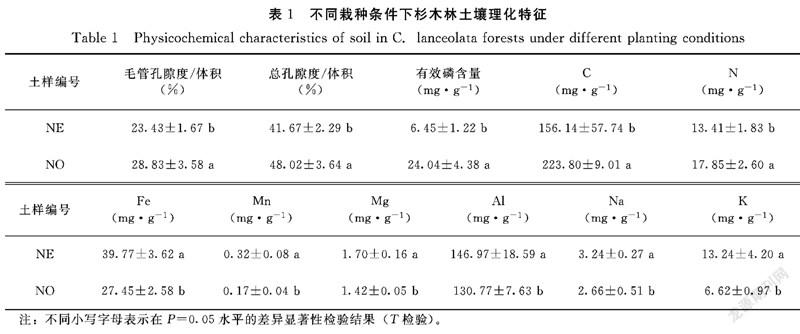
土壤孔隙度直接影响土壤的透水与渗水能力。通过对不同栽种条件下杉木幼苗林土壤样品理化性质的测定,结果发现连栽的杉木林地土壤毛管孔隙度值变化范围为21.76%~25.1%,而对照组的毛管孔隙度值变化范围为25.25%~32.41%。对照组的毛管孔隙度显著(P<0.05)高于连栽组。连栽组的总孔隙度变化范围为39.38%~43.96%,而对照组的总孔隙度变化范围为44.38%~51.66%,对照组的总毛管孔隙度显著(P<0.05)高于连栽组。
探究不同栽种条件下杉木幼苗林土壤的养分物质情况,可以揭示不同栽种条件下杉木林生长的背景情况,从而针对连栽情况提出调控措施。土壤有效磷是土壤磷素养分供应水平高低的指标,在一定程度上反映了土壤中磷素的贮量和供应能力。研究发现,对照组的杉木幼苗林土壤的有效磷含量显著(P<0.05)高于连栽条件下的杉木林。由表1可知,不同栽种条件下土壤的全养分含量存在一定的差异性,其中对照组的杉木幼苗林土壤的C、N含量显著(P<0.05)高于连栽组;而对照组的杉木林土壤中的Fe、Mn、Mg、Al、Na、K的含量(P<0.05)低于连栽组。
2.2连栽组和对照组杉木幼苗生长量的差异
生长量是指生物中单个体或群落随时间的推移质量、结构、形态指标变化的数量,表征生物的生长情况。连栽组的杉木幼苗苗高生长量值的变化范围为6.81~9.55 cm,而对照组的苗高生长量值的变化范围为10~12.92 cm。两种栽种条件下,对照组的杉木幼苗苗高生长量显著(P<0.05)高于连栽组(表2)。不同栽种条件下,对照组的杉木幼苗地径生长量显著(P<0.05)高于连栽组,前者杉木幼苗地径生长量的变化范围为2.38~3.28 cm,后者的变化范围为1.49~2.43 cm,对照组的杉木幼苗冠幅生长量显著(P<0.05)高于连栽组。
2.3连栽组和对照组杉木林代谢物质之间的差异
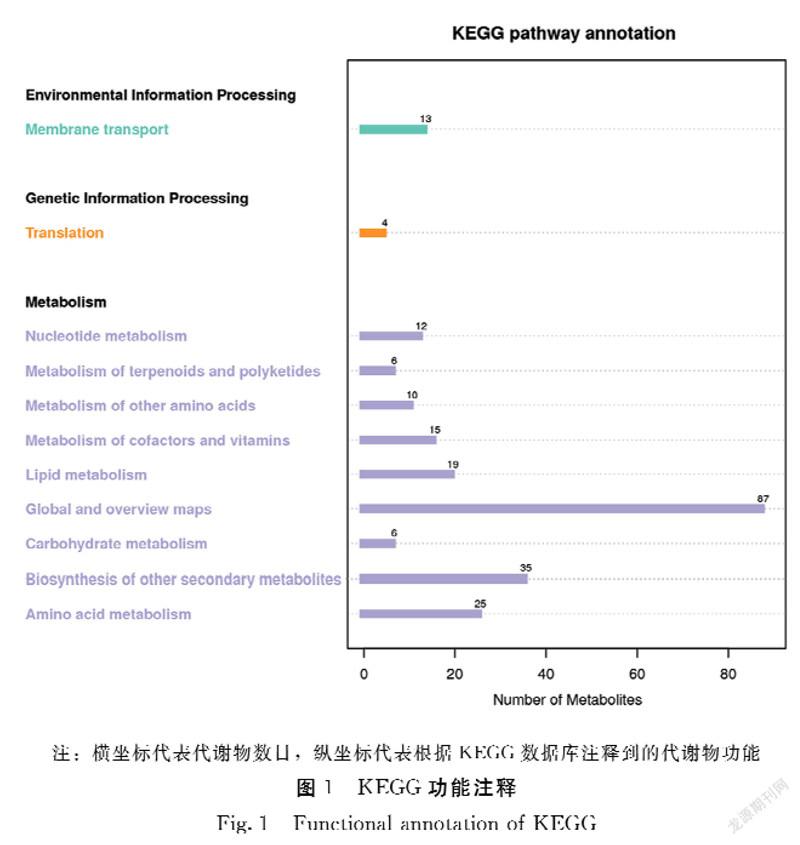
2.3.1KEGG富集分析利用KEGG数据库对鉴定到的代谢物进行生物学通路的注释,以了解不同代谢物的功能特性及分类情况。其中富集到的代谢物数目共147个,KEGG类别有3个,KEGG二级通路有11条。这些通路主要为全局与概述地图(global and overview maps)、其他次生代谢产物的生物合成(Biosynthesis of other secondary metabolites)、氨基酸代谢(Amino acid metabolism)等与新陈代谢相关的一些类中(图1)。
2.3.2LIPID MAPS分类注释利用LIPID MAPS数据库分类注释杉木幼苗相关的脂质结构。其中富集到的代谢物包括脂质的四大类,分别为脂肪酸类 (Fatty Acids,FA)、多聚乙烯类 (Polyketides,PK)、孕烯醇酮脂类 (Prenol Lipids,PR)、固醇脂类 (Sterol Lipids,ST)。其中多聚乙烯类 (Polyketides,PK)下的类黄酮(Flavonoids)次代谢产物所包含的代谢物数目差异最多。
2.3.3差异代谢物火山图分析火山图可直观显示差异代谢物的整体分布情况,火山图中每个点代表一个代谢物,显著上调的代谢物用红色点表示,显著下调的代谢物用绿色点表示,圆点的大小代表VIP值。由图3可以看出,富集到的代谢物数目为147个,其中上调的代谢物数目为37个,占比25%,下调的代谢物数目为44个,占比30%。
2.3.4KEGG富集气泡图根据上述富集结果,绘制富集到的KEGG通路的气泡图(只展示top20的结果),见图4。其中,横坐标的值越大,表示该通路中差异代谢物富集程度越高。点的颜色代表超几何检验的p-value值,值越小,说明检验的可靠性越大、越具统计学意义。点的大小代表相应通路中差异代谢物的数目,点越大,该通路内差异代谢物就越多。
从图4可知,两种栽种情况在类黄酮代谢(Flavonoid metabolism)通路中差异代谢物的数目最多,在黄酮与黄酮生物合成(Flavone and flavonal biosynthesis)通路中代谢物的差异性最显著。2.3.5KEGG富集通路图在KEGG通路图中,圆圈代表代谢物,其中绿色实心圆圈标记为注释到的代谢物,蓝色圆圈标记为下调差异代谢物,由图5可知,差异代谢物大量富集在黄酮和黄酮醇的合成通路中,影响黄酮类化合物的生物合成,注释到的代谢物为芦丁 (Rutin),差异代谢物主要为下调差异代谢物,分别是牡荆素(vitexin)、芹菜素(Apigenin)和木犀草素(Luteolin)。
3结论与讨论
本试验针对人工杉木林的连栽障碍情况进行了土壤理化性质的研究。发现以下几点结果:(1)连栽情况下的土壤毛管孔隙度降低了23.05%,土壤总孔隙度降低了13.22%,这与韦玮等[22]的研究结果一致,说明连栽可降低林地的土壤毛管孔隙度和土壤总孔隙度。土壤毛管孔隙度的大小反映了土壤持水及对植物的供水能力[23]。随着杉木连栽次数的增加,林下土壤变得更为紧实,土壤通气和容蓄能力有所下降,直接影响杉木的生长。(2)连栽情况下的杉木林的土壤有效磷含量降低了73.17%,这与张虹等[24]的研究结果一致,说明连栽导致杉木林地土壤中的有效磷含量降低。连栽杉木林土壤中磷素的贮量和供应能力减弱,对杉木幼苗的生长产生不利影响。(3)随着杉木幼苗栽种条件的变化,连栽条件下杉木林地的有机质和全氮含量明显下降,其中土壤全碳降低了30.23%、土壤全氮含量降低了24.87%。这与李朝婷等[25]的研究结果一致,说明连栽导致林下土壤有机质和主要养分的积累减少,不利于林下土壤肥力的恢复和维持,致使杉木林地地力下降,进而导致杉木林生产力下降,不利于杉木的生长。(4)连栽情况下杉木林地土壤的Fe、Mn、Mg、Al、Na和K的含量显著高于撂荒地对照组,这与杨起帆等[26]的研究结果不一致,原因可能为连栽地区曾施用有机肥,而撂荒地对照组未施肥。2283DCCB-D908-4E40-9EC8-FD85965DE850
本试验针对不同栽种情况下杉木幼苗的生长量进行了研究,结果发现连栽情况下杉木幼苗的苗木生长量、地径生长量和冠幅生长量显著(P<0.05)低于对照组,其中对照组的苗高生长量降低了26.62%,径生长率降低了30.74%,冠幅生长量降低了25.9%。这与张幸幸等[27]的研究结果相似,说明连栽打破了植物在生长和防御间的平衡,导致了杉木林地力衰退,从而影响了杉木幼苗的生长发育。
本次试验对连栽和撂荒地的杉木幼苗进行代谢组分析,结果发现:(1)两者在全局与概述地图(global and overview maps)通路的代谢物差异最多,该通路与林木新陈代谢有关,说明连栽障碍影响了杉木的新陈代谢。(2)在连栽障碍胁迫下的杉木幼苗差异代谢物中,上调的代谢物大概占比25%,下调的代谢物大概占比30%。进一步说明连栽影响会杉木幼苗次生代谢物的差异表达,进而影响其生长发育。(3)根据分析两种栽种条件下杉木幼苗代谢物之间的差异,发现不同栽种条件下具有差异的代谢物多属于类黄酮合成通路。类黄酮作为次生代谢产物,具有特征性很强的2个芳香环和1个吡喃环连接而成的碳骨架,具有极强的抗氧化特性,可清除杉木在代谢过程中产生的活性氧[28],增强其抵抗非生物胁迫[29-32]和抵御生物胁迫[33-35]的能力。本次研究表明杉木人工林在产生连栽障碍时,营造了不利于杉木生长的外界环境,根据生长的需要,杉木幼苗会增加次生代谢物类黄酮来抵御逆境的产生。(4)根据KEGG富集通路得到的差异代谢物均为下调差异代谢物,分别是牡荆素(vitexin)、芹菜素(Apigenin)和木犀草素(Luteolin),这三者都属于黄酮类化合物。连栽杉木幼苗体内的黄酮类化合物代谢物明显上升,说明杉木幼苗体内的活化氧含量增高,从而产生各种疾病,出现杉木林自毒现象,导致杉木生长状态较差,杉木幼苗林在连栽情况下的生长状况明显低于在撂荒地种植的杉木幼苗。
本研究通过研究连栽组与撂荒地对照组之间土壤性质的差异,显著诱导出杉木二次生代谢物的差异,进而显著影响杉木幼苗生长量的变化。因此,在后续进行杉木连栽种植时,可以针对林地土壤C、N含量和有效磷含量下降追施氮肥和磷肥;在进行下一代杉木人工林种植前,在林内进行松土以提高杉木人工林的土壤孔隙度;由于连栽组和对照组之间具有差异的代谢物主要分布在类黄酮合成通路中,可用丛生真菌、内生真菌等共生微生物侵染杉木根系,從而促进杉木吸收土壤中的养分和水分,促进杉木的生长发育,调节杉木对逆境的相应,以达到提高林地利用率和实现林地可持续经营的目的。未来会进一步研究丛生真菌等共生微生物在杉木连栽障碍中的机理,以及发现更多可以调节连栽障碍产生的逆境,促进杉木生长的共生微生物。本研究对明晰杉木连栽障碍的代谢机制有着重要的理论意义,可为杉木连栽障碍产生原因提供理论依据。
参考文献:
[1]魏晓骁,陈爱玲,王士亚,等.杉木连栽林土壤微生物碳源利用比较[J].应用与环境生物学报,2016,22(3):518-523.
[2]罗扬,刘书影,周柳婷,等.连栽杉木根际土壤镰刀菌属真菌群落变化规律[J].生态学杂志,2020,39(9):2921-2929.
[3]夏丽丹,于姣妲,邓玲玲,等.杉木人工林地力衰退研究进展[J].世界林业研究,2018,31(2):37-42.
[4]俞新妥.论杉木人工林的回归——从杉木林地力衰退的因果谈杉木林的可持续经营[J].世界林业研究,1999(5):15-19.
[5]YANG Y SH, LIU CH J, KUTSCH W, et al.Impact of Continuous Chinese Fir Monoculture on Soil[J].Pedosphere,2004(1):117-124.
[6]夏志超,孔垂华,王朋,等.杉木人工林土壤微生物群落结构特征[J].应用生态学报,2012,23(8):2135-2140.
[7]马志慧.铝胁迫下杉木无性系苗若干生理过程及转录组的研究[D].福州:福建农林大学,2015.
[8]喻方圆.几个针叶树种苗木逆境生理研究[D].南京:南京林业大学,2002.
[9]陈冉红,周梦岩,李娇阳,等.蔗糖添加对杉木低磷胁迫响应和蔗糖代谢的影响[J].生态学报,2021,41(16):6588-6599.
[10]鲁海坤,姜业成,隋昕,等.蒙古黄芪种子老化的代谢组学分析[J/OL].分子植物育种:1-9[2021-10-06].
[11]陈宇,吴超,武忆寒,等.杉木涩籽发生机理的研究进展[J].亚热带农业研究,2020,16(4):247-253.
[12]蔡瑛莹.土壤增温和氮沉降对杉木幼树细根分泌物通量和化学组成的影响[D].福州:福建师范大学,2018.
[13]刘维丽,马红亮,彭秀明,等.凋落物中次生代谢物对森林土壤可溶性氮的影响[J].土壤,2010,42(4):564-568.
[14]马越强,廖利平,杨跃军,等.连栽土壤对杉木幼苗生长影响的研究[J].生态学杂志,1997(6):13-17,22.
[15]马祥庆,刘爱琴,黄宝龙.杉木人工林自毒作用研究[J].南京林业大学学报,2000(1):15-19.
[16]张家武,邓仕坚,廖利平,等.杉木连栽土壤对其幼树生长的影响[J].应用生态学报,1994(03):241-244.
[17]马雪华.森林生态系统定位研究方法[M].北京: 中国科学技术出版社,1994: 25-135.
[18]鲁如坤.土壤农业化学分析方法[M].北京: 中国农业科技出版社,2000: 18-96.
[19]周忠胜,张文豹,曾雷,等.稀有树种红果榆种实发芽特性与苗期种源筛选初报[J].特产研究,2021,43(1):29-32.2283DCCB-D908-4E40-9EC8-FD85965DE850
[20]DUNN W, BROADHURST D, BEGLEY P, et al.Procedures for large-scale metabolic profiling of serum and plasma using gas chromatography and liquid chromatography coupled to mass spectrometry[J].Nature protocols,2011,6:1060-1083.
[21]WANT E, WILSON I, GIKA H,et al Global metabolic profiling procedures for urine using UPLC-MS[J].Natureprotocols,2010, 5:1005-1018.
[22]韦玮,丁贵杰,陈伟,等.一、二代马尾松林土壤微生物数量及酶活性垂直分布特征[J].重庆师范大学学报(自然科学版),2017,34(3):114-120.
[23]刘伟,罗玲,钟奇,等.生草和地布覆盖对攀枝花地区芒果园土壤性质及果实品质的影响[J].应用与环境生物学报,2021,27(2):261-270.
[24]张虹,于姣妲,李海洋,等.不同栽植代数杉木人工林土壤磷素特征研究[J].林业科学研究,2021,34(1):10-18.
[25]李朝婷,周晓果,温远光,等.桉树高代次连栽对林下植物、土壤肥力和酶活性的影响[J].广西科学,2019,26(2):176-187.
[26]杨起帆.杉木二代林轮作速生树种尾巨桉和黑木相思9a后的土壤养分变化特征[D].福州:福建农林大学,2017.
[27]张幸幸.杉木连栽与马尾松轮作后的土壤质量评价[D].福州:福建农林大学,2013.
[28]HERNANDEZ I, ALEGRE L, BREUSEGEM VF, et al.How relevant are flavonoids as antioxidants in plants?[J].Trends Plant Sci, 2009,14: 125-132.
[29]SARMA AD, SHARMA R.Anthocyanin-DNA copigmentation complex: mutual protection against oxidative damage[J].Phytochemistry, 1999,52: 1313-1318.
[30]STEYN W, WAND S, HOLCROFT D, et al.Anthocyanins in vegetative tissues: a proposed unifi ed function in photoprotection[J].New Phytol, 2002,155: 349-361.
[31]CASTELLARIN SD, PFEIFFER A, SIVILOTTI P, et al.Transcriptional regulation of anthocyanin biosynthesis in ripening fruits of grapevine under seasonal water defi cit[J].Plant Cell Environ, 2007,30: 1381-1399.
[32]CHRISTIE PJ, ALFENITO MR, WALBOT V. Impact of low-temperature stress on general phenylpropanoid and anthocyanin pathways: enhancement of transcript abundance and anthocyanin pigmentation in maize seedlings[J].Planta, 1994: 541-549.
[33]LORENC-KUKULA K, JAFRA S, OSZMIANSKI J, et al.Ectopic expression of anthocyanin 5-O-glucosyltransferase in potato tuber causes increased resistance to bacteria[J].J Agric Food Chem,2005,53: 272-281.
[34]WINKEL-SHIRLEY B.Flavonoid biosynthesis.A colorful model for genetics, biochemistry, cell biology, and biotechnology[J].Plant Physiol,2001,126: 485-493.
[35]BIDART-BOUZAT MG, IMEH-NATHANIEL A.Global change effects on plant chemical defenses against insect herbivores[J].J Integr Plant Biol, 2008,50: 1339-1354.
劉敬灶.连栽对杉木幼苗生长的影响及其代谢基础[J].福建农业科技,2022,53(4):64-72.
收稿日期:2021-12-20
作者简介:刘敬灶,男,1971年生,高级工程师,主要从事森林培育及林业科学技术研究。
基金项目:福建省三明市林业局科技项目(2021-MLKJ-15号);福建省林业科学研究项目(闽林科便函〔2020〕9号)。2283DCCB-D908-4E40-9EC8-FD85965DE850
