基于HPLC法测定车前子不同炮制品中主成分含量差异*
2022-06-24彭睿芳洪桂芳盛军华叶喜德
魏 峰 丁 燕 彭睿芳 洪桂芳 盛军华 叶喜德※
(1.江西省抚州市东乡区人民医院药剂科,江西 东乡 331800;2.江西中医药大学药学院,江西 南昌 330004;3.平乐县源头镇卫生院药剂科,广西 平乐 542406)
车前子为我国常用中药之一,为车前科植物车前(Plantago asciatica L.)或平车前(Plantago depressa Will d.)的干燥成熟种子。主要分布于江西、黑龙江、辽宁等地,为江西道地药材之一。本品味甘性寒,入肾、膀胱、肝、肺经,具渗湿通淋、清热利尿、明目、祛痰等药理作用,临床上一般用来医治水肿胀满、热淋涩痛、暑湿泄泻、目赤肿痛、痰热咳嗽等病症[1]。
现代研究表明,车前子主含环烯醚萜类、苯乙醇苷类、黄酮类、多糖等成分[2],而京尼平苷酸是其主要有效成分,为一种环烯醚萜类化合物,具有降血糖及抗炎等作用[3];毛蕊花糖苷也是其主要有效成分,为一种苯乙醇苷类化合物,可促进小鼠树突状细胞的成熟,具有消炎、抗肿瘤、抗衰老、改善记忆、免疫调节、抗氧化、神经保护等作用[4]。现今对车前子的炮制方法主要为净制、炒制、盐制[5],文献对于车前子中京尼平苷酸、毛蕊花糖苷的测定研究较多[6-9],但有关于测定车前子不同炮制品中的京尼平苷酸、毛蕊花糖苷含量报道很少,京尼平苷酸、毛蕊花糖苷为车前子药材质量指标成分。故本实验运用通过高效液相色谱法(HPLC),比较车前子不同炮制品中京尼平苷酸和毛蕊花糖苷的含量差异,为车前子及其炮制品的质量评价提供了实验依据,为深入研究车前子炮制作用机制奠定基础。
1 仪器与材料
1.1 仪器 Agilent 1100高效液相色谱仪(美国安捷伦仪器有限公司);GZX-9076MBE电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂);YF-111B(100 g)高速中药粉碎机(瑞安市永历制药机械有限公司);FA1004N万分之一电子天平(上海精密科学仪器有限公司);KQ-500E超声波清洗器(昆山市超声仪器有限公司)。
1.2 药材与试剂 车前子药材来自安徽汇仁堂中药饮片有限公司,经江西中医药大学龚千锋教授鉴定为车前科植物车前Plantago asiatica L.的干燥成熟种子。京尼平苷酸对照品(四川省维克奇生物科技有限公司,批号:wkp20082603,纯度:HPLC>98%),毛蕊花糖苷对照品(成都曼思特生物科技有限公司,批号:MUST-20092315),供含量测定用,纯度:HPLC>98.73%)购于成都曼思特生物科技有限公司。水为娃哈哈饮用纯净水,乙腈为色谱纯,磷酸、甲醇为分析纯。
2 方法与结果
2.1 车前子不同炮制品的制备
2.1.1 净制车前子 取原车前子药材,除去枝,梗等杂质,筛去灰屑,即得。
2.1.2 清炒车前子 将净制车前子倒入炒锅内,用文火炒至表面微黄、有爆裂声时,取出放凉,即得。
2.1.3 盐制车前子 将净制车前子倒入炒锅内,用文火炒至有爆裂声时,将该炒锅中车前子倒入新的炒锅,再喷洒盐水,继续炒干,有香味逸出时,取出放凉,即得。净制车前子与食盐的比例为50∶1。
2.2 供试品溶液的制备 精密称取车前子药材粉末(过2号筛)约1 g,精密加入60%甲醇50 mL,加热回流2 h,放置在室温下,等冷却后,再称定重量,用60%甲醇补足减失的重量,摇匀,滤过。取滤液经0.22μm微孔滤膜过滤后作为供试品溶液,取1 mL注入样品瓶中,即为上样分析样品,将制备好的样品置于4℃下保存,待测。
2.3 对照品溶液的制备 精密称取京尼平苷酸、毛蕊花糖苷对照品各1 mg,加60%甲醇溶解并定容,制备成质量浓度均为1 mg/mL。分别取对照品适量,制备成质量浓度为京尼平苷酸0.4 mg/mL和毛蕊花糖苷0.25 mg/mL的混合对照品溶液,即得,待测。
2.4 色谱条件 色谱柱:RD-C18(250 mm×4.6 mm,5μm);以乙腈为流动相A,以0.1%磷酸水溶液为流动相B,梯度洗脱(0~7 min,14%A;7~27 min,14%~24%A);流速:1 mL/min;检测波长为254 nm;柱温:35℃;进样体积:10μL。在该色谱条件下,车前子中京尼平苷酸和毛蕊花糖苷与其他化学成分的色谱峰分离度良好。色谱图见图1。
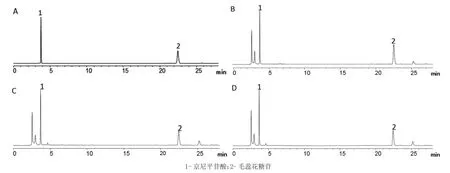
图1 混合对照品(A)、生车前子(B)、炒车前子(C)、盐车前子(D)的HPLC图
2.5 线性关系考察 精密吸取“2.3”项下方法制备的京尼平苷酸和毛蕊花糖苷的混合对照品溶液4、6、8、12、16、20μL,分别按照“2.4”项下的色谱条件进样分析,测定色谱峰面积,以进样量X(μg)为横坐标,峰面积Y为纵坐标进行回归分析。计算得京尼平苷酸的线性回归方程为Y=232.67X+318.5,r=0.999;毛蕊花糖苷的线性回归方程为Y=205.86X+504.43,r=0.999。结果表明,京尼平苷酸在1.6~8.0μg范围内线性关系良好,毛蕊花糖苷在1.0~5.0μg范围内线性关系良好。
2.6 精密度实验 精密吸取“2.3”项下方法制备的对照品溶液10μL,按照“2.4”项下的色谱条件进行分析,连续进样6次,记录京尼平苷酸和毛蕊花糖苷的峰面积并以峰面积计算RSD。结果京尼平苷酸峰面积的RSD为0.14%,毛蕊花糖苷峰面积的RSD为0.25%,表明该仪器精密度良好。
2.7 稳定性实验 取同一供试品溶液,按照“2.4”项下的色谱条件进样分析,于0 h、2 h、4 h、6 h、8 h、12 h、24 h分别进样测定,记录京尼平苷酸和毛蕊花糖苷的峰面积并以峰面积计算RSD。结果京尼平苷酸峰面积的RSD为1.43%,毛蕊花糖苷峰面积的RSD为0.21%,表明该供试品溶液在24 h内稳定性良好。
2.8 重复性实验 精密称取同一批车前子药材粉末(过2号筛)6份,根据“2.2”项下方法制备供试品溶液,并按照“2.4”项下的色谱条件进样分析,记录京尼平苷酸和毛蕊花糖苷的峰面积并用外标法以峰面积计算含量和RSD。结果京尼平苷酸峰面积的RSD为0.33%,毛蕊花糖苷峰面积的RSD为0.35%,表明该方法重复性良好。
2.9 样品含量测定 分别取净制车前子、清炒车前子、盐制车前子粉末各3份,根据“2.2”项下方法制备供试品溶液,并按照“2.4”项下的色谱条件进样分析,含量测定结果见表1。
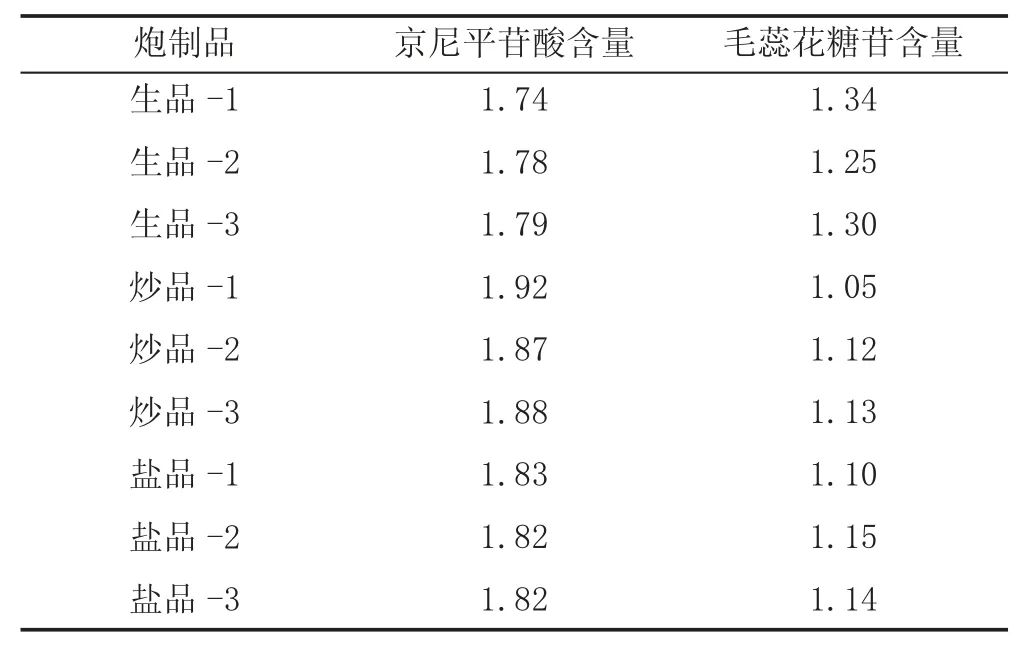
表1 车前子不同炮制品含量测定结果 (%)
3 讨论与小结
3.1 炮制方法的选择 古代对车前子的炮制主要有净制、炒制、酒制等法,而现代主要采用净制、炒制、盐制等。把酒制改为盐制,这可能是因为酒制会导致车前子中某些活性成分的散失,而盐制对这些活性成分影响相对较少[10]。因此,本实验选用净制、炒制、盐制等法。但在盐制过程中,发现喷洒盐水容易使车前子结块,且因为炒锅温度高会导致盐水蒸发掉,食盐易粘连在锅底,故而在文火炒至有爆裂声时,将车前子倒入新的炒锅内,喷洒盐水,炒干,至有香味逸出时取出放凉。
3.2 流动相的确定 通过查阅文献,前期先后选用了甲醇-水、乙腈-0.1%磷酸、甲醇-0.1%甲酸、甲醇-0.1%醋酸、乙腈-水这5种系统作为流动相。结果发现选用乙腈-0.1%磷酸作为流动相,梯度洗脱,分离效果最好。即图谱中京尼平苷酸和毛蕊花糖苷的峰型好,与其他杂质峰的分离度高,保留时间适中,京尼平苷酸的保留时间为3.76 min,毛蕊花糖苷的保留时间为22.46 min。因而选用乙腈-0.1%磷酸作为流动相,对车前子药材进行分析。
3.3 小结 本实验通过HPLC对生车前子、炒车前子、盐车前子中京尼平苷酸和毛蕊花糖苷的含量进行测定,得生车前子中京尼平苷酸平均含量为1.77%、毛蕊花糖苷平均含量为1.29%;炒车前子中京尼平苷酸平均含量为1.89%、毛蕊花糖苷平均含量为1.10%;盐车前子中京尼平苷酸平均含量为1.82%、毛蕊花糖苷平均含量为1.13%。根据现行版《中华人民共和国药典》中车前子药材的含量测定规定,车前子干燥品中的京尼平苷酸含量不得少于0.50%,毛蕊花糖苷不得少于0.40%。结果发现车前子各炮制品均符合2020版《中华人民共和国药典》中车前子药材含量规定。
由含量测定结果可知,不同炮制品中京尼平苷酸和毛蕊花糖苷含量存在差异,生车前子经炮制后京尼平苷酸含量有所增加,而毛蕊花糖苷有所降低。因此,基于HPLC法测定车前子不同炮制中京尼平苷酸和毛蕊花糖苷的含量可反映不同炮制方法对车前子有效成分产生影响,为深入研究车前子炮制机制及饮片质量提供科学依据。
