中老年男性T2DM患者血清中RBP4、BMP2水平变化与骨质疏松的关系
2022-06-24师毓惠敬泽慧杨发满青海大学附属医院老年科青海西宁810001
师毓惠 敬泽慧 杨发满 (青海大学附属医院老年科,青海 西宁 810001)
全球范围糖尿病(DM)性骨质疏松逐年上涨,导致患者骨皮质变薄、骨小梁减少,因其发病隐匿,容易遭人们忽略,一旦摔倒易出现病理性骨折,危害巨大〔1〕。膳食中维生素(Vit)A从肠道吸收后进入肝脏,以其中间产物VitA的形式储存,肝脏细胞分泌的视黄醇结合蛋白(RBP)4功能是转运蛋白,将VitA从肝脏转至外周靶器官〔2〕,当VitA水平稳定时,肝脏细胞对血液中RBP4影响不大〔3〕。脂肪细胞分泌的RBP4有生物活性功能,在局部和远处组织发挥作用,参与胰岛素抵抗、2型糖尿病(T2DM)、冠心病的发生发展〔4〕。骨质疏松是骨形成和骨破坏动态失衡,骨形态发生蛋白(BMP)2开启生物通BMP2/Smad/Runx2,是骨形成必不可少的蛋白〔5〕。本文旨在分析RBP4、BMP2与BMD及相关因子的关系,确定两者的变化水平对中老年男性T2DM患者骨质疏松的影响。
1 资料与方法
1.1一般资料 纳入2019年2~8月青海大学附属医院就诊的中老年男性T2DM患者82例(所有患者签署知情同意书)。本研究经医院伦理委员会批准(伦理审查编号:SL20190079),所有程序按照伦理审批机构指导原则进行。纳入标准:诊断为T2DM的中老年患者;排除标准:排除血液病、恶性肿瘤、甲状腺疾病、甲状旁腺疾病、自身免疫性疾病、炎性疾病和严重的心脏、肝脏和肾脏疾病及口服影响骨代谢药物。测量所有研究对象腰椎1~4、股骨颈骨密度(BMD),依据世界卫生组织标准T评分,将受试者分为骨质疏松组(T评分≤-2.5 SD)26例、骨量减少组(-2.5 SD
1.2标本采集 记录年龄、身高、体重、腰围、病程、BMI,测定FPG、空腹胰岛素(FINS)、TC、TG、HDL-C、LDL-C、HbA1c、Ca、P、PTH,计算HOMA-β,HOMA-IR。静置2 h 4 ml血液标本,调定转速1 000 r/min,离心20 min,留上层血清,-80℃备用。
1.3检测方法和主要仪器 BMD检测用AmericaHOLOGIC的双能X线骨密度仪,FPG、TG、TC、HDL-C、LDL-C、ALP、Ca、P检测用Japan Hitachi生产的7600型全自动生化分析仪,FINS检测用Germany Rochecosbase601电化学发光仪,HbA1c检测用AmericaPRIMUS层析高压液相检测仪,PTH检测用Siemens ADVIA Centaur XP全自动化学发光分析仪,光密度值测定用Finland Red全自动酶标仪。
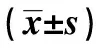
表1 3 组一般资料比较
胰岛素抵抗指数:HOMA-IR;胰岛素分泌指数:HOMA-β;糖化血红蛋白:HbA1c;三酰甘油:TG;高密度脂蛋白胆固醇:HDL-C;总胆固醇:TC;低密度脂蛋白胆固醇:LDL-C;碱性磷酸酶:ALP;钙:Ca;磷:P;甲状旁腺素:PTH;与骨量正常组比较:1)P<0.05;与骨量减少组比较:2)P<0.05;下表同
1.4实验步骤 人RBP4、RBP2、Ⅰ型前胶原氨基端延长肽(PINP)、Ⅰ型胶原羧基端肽β特殊序列(β-CTX)试剂采用购自中国江苏晶美有限公司,该四项均采用冻融血清后,采用酶联免疫吸附试验(ELISA)双抗体夹心法,按照捕获抗体包被、稀释样品、样品预处理、加样、加检测抗体、显色、终止比色的操作步骤,将得出吸光度值。x=吸光度值,代入回归方程式,最终得到y=标本浓度。RBP4;r2=0.996,y=13.664x2+11.152x+0.165;BMP2:r2=0.996,y=29.173x2+142.260x-12.335;PINP;r2=0.994,y=11.388x2+5.0003x-0.906;β-CTX:r2=0.993,y=18.081x2+123.960x-14.289。
1.5统计学方法 采用SPSS21.0软件进行单因素方差分析、非参数检验、Kruskal-Wallis检验、Spearman相关分析、二元Logistic回归。
2 结 果
2.13组RBP4、BMP2水平比较 3组RBP4水平比较:骨量正常组>骨量减少组>骨质疏松组,差异均有统计学意义(均P<0.05);3组BMP2水平比较:骨质疏松组>骨量减少组>骨量正常组(均P<0.05)。 见表2。
2.2相关性分析 通过Spearman相关性分析可知:①RBP4与PINP呈正相关(r=0.425,P=0.000)、与β-CTX呈负相关(r=-0.287,P=0.009)、与腰椎、股骨颈、髋部、前臂BMD均呈正相关(r=0.259,0.377,0.346,0.291,均P<0.05),与BMP2无相关性(r=0.002,P=0.855);②BMP2与β-CTX呈正相关(r=0.229,P=0.038)、与腰椎、股骨颈、髋部、前臂BMD均呈负相关(r=-0.313,-0.293,-0.225,-0.324,均P<0.05),与PINP无相关性(r=-0.133,P=0.238)。

表2 3组 RBP4,BMP2 的比较〔M(P25,P75),ng/ml〕
3 讨 论
DM是我国慢病防控中的重中之重,损伤神经、血管、视网膜之外,还可影响骨代谢,造成骨质疏松。当骨组织微细结构遭到破坏,可出现骨性疼痛,破坏进一步加重,骨质硬度下降,会发生自发性或外力性骨折,需要手术干预治疗,且血糖高、年龄大影响骨折预后情况,长久卧床可导致下肢深静脉血栓,血栓阻塞肺动脉,可危及性命〔6〕。
RBP4有可结合VitA的特殊点位,可将VitA带离肝脏运送至肝外靶器官。在血液中,RBP4、VitA、甲状腺素蛋白(TTR)三者聚合,形成可防止肾小球滤过的三元复合物,当肾小球病变时,滤过增多,尿液中RBP4将增加〔7〕。RBP4将VitA运送至细胞质中,进入细胞质的VitA氧化成视黄酸后通过视黄酸受体RAR和RXR进入细胞核发挥功能〔8〕。脂肪细胞分泌的RBP4具有生物活性,作用局部和远处组织,参与机体慢性炎症、胰岛素抵抗。
研究发现T2DM患者当中RBP4水平与CTX呈正相关,邹学军等〔11〕进行动物实验,在基础培养上加入用重组人源BMP2培养BMSCs,培养基上成骨细胞增多,并且细胞培养上清中RBP4含量增高,转染RBP4 siRNA后RBP4表达减少,小鼠的成骨分化被显著抑制。研究发现T2DM中体重、BMI、RBP4与腰椎、股骨颈、前臂远端骨密度均呈正相关〔12〕。
本研究显示升高的RBP4对骨质有保护作用,RBP4与各部位BMD为呈正相关,与骨形成指标呈正相关,与骨破坏指标呈负相关。其原因可能是BMSCs是成骨细胞和脂肪细胞共同的前体源细胞,其分化方向的动态平衡维持骨稳态,RBP4通过调节BMSCs分化信号通路BMP/smad、Wnt/β-catenin及调控PPARγ来发挥作用〔13〕,PPARγ可以起始BMSCs的成脂分化,缺乏PPARγ将停止分化。高血糖激发机体氧化应激反应,PPARγ大量表达,促进脂肪组织沉积,RBP4含量升高,升高的RBP4通过抑制PPARγ表达,负向调控BMSCs成脂分化〔14〕。在DM患者体内,糖基化终末产物(AGEs)持续积累,促进大量的炎症因子释放,一氧化氮(NO)在激活的一氧化氮合酶作用下释放增多,强烈的氧化损伤能力破坏成骨细胞的结构、功能直至死亡,RBP4可以减少NO的释放〔15〕。RBP4基因区域内有GPR120,该基因通过复制、转录、编码形成的蛋白可以促进GLP-1生成〔16〕,GLP-1与BMSCs和未成熟的成骨细胞表面的GLP-1受体结合〔17〕,作用于BMSCs分化信号通路,增强BMSCs转变为成骨细胞,使OPG升高,RANKL下降,改变二者比值,削弱骨吸收能力〔18〕。本研究T2DM患者骨量明显降低的同时,BMP2反而升高,BMP2与各部位骨密度呈负相关,与骨破坏指标呈正相关。其原因可能是,内皮和血管平滑肌细胞也有BMP2,此次研究未培养骨细胞,无骨细胞中BMP2表达水平做对比,考虑T2DM血液中BMP2可能受其他因素影响〔19〕。因此,在高血糖环境下,升高的BMP2参与骨质疏松可能与慢性炎症有关系〔20〕,具体机制还需要进一步研究。
