血小板/白细胞比值与2型糖尿病合并非酒精性脂肪性肝病患者肝纤维化进展的相关性
2022-06-24韩孟冉张晨钰杜岑都健敖娜
韩孟冉,张晨钰,杜岑,都健,敖娜
(中国医科大学附属第四医院内分泌代谢内科,沈阳 110032)
2型糖尿病(type 2 diabetes,T2DM)与非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)关系密切,NAFLD会增加T2DM慢性并发症的发生风险,而T2DM则会增加NAFLD进展为晚期肝纤维化、肝硬化甚至肝癌的风险。因此,在T2DM患者中早期识别NAFLD及其纤维化进展并进行治疗干预至关重要。NAFLD及其纤维化与肝内胰岛素抵抗(insulin resistance,IR)、脂代谢异常、炎症反应、氧化应激等多种机制密切相关。有研究[1]表明,血小板/白细胞比值(platelet to white blood cell ratio,PWR)与乙型肝炎患者肝脏纤维化密切相关,本研究旨在探讨PWR与T2DM合并NAFLD患者肝纤维化的相关性,为临床提供更便捷的早期筛查指标。
1 材料与方法
1.1 研究对象
选取2018年7月至2020年11月于中国医科大学附属第四医院内分泌代谢内科就诊的T2DM患者440例,其中,男258例,女182例,年龄23~94岁,平均年龄为(58.5±11.9)岁。纳入标准:(1)T2DM符合1999年世界卫生组织糖尿病诊断标准[2];(2)NAFLD符合《非酒精性脂肪性肝病防治指南(2018年更新版)》[3]的诊断标准。排除标准:(1)T2DM伴有急性代谢紊乱、严重肝功能不全[谷丙转氨酶(alanine aminotransferase,ALT)>8~10正常值上限(upper limit of normal,ULN)或者ALT>3 ULN且总胆红素(total bilirubin,TBIL)>2 ULN][4]、严重肾功能不全[估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<30 mL/min]、心功能Ⅲ~Ⅳ级、风湿免疫系统疾病、慢性炎性疾病或肿瘤、血液系统疾病、处于妊娠或哺乳期;(2)嗜酒,乙醇量男>140 g/周,女>70 g/周;(3)合并病毒性肝炎、药物性肝损伤、胆汁淤积性肝损伤、肝豆状核变性及药物依赖患者。
1.2 分组
纳入研究对象被分为单纯T2DM组(120例)和T2DM合并NAFLD组(320例)。将T2DM合并NAFLD组根据NAFLD纤维化评分(NAFLD fibrosis score,NFS)[5]分为T2DM+F0(除外肝纤维化亚组,NFS<-1.455,120例)、T2DM+F1(可疑肝纤维化亚组,-1.455≤NFS<0.676,120例)和T2DM+F2(肝纤维化亚组,NFS≥0.676,80例)3个亚组。其中,F0表示无肝纤维化,F1表示可疑肝纤维化,F2表示肝纤维化。
1.3 方法
1.3.1 一般资料收集:记录患者性别、年龄、T2DM病程、近半年用药情况等,由专人测量并记录患者的身高、体质量,并计算体质量指数(body mass index,BMI),BMI=体质量(kg)/身高2(m2)。
1.3.2 实验室检查:患者夜间禁食≥8 h,并于次日清晨6时抽取肘部静脉血。检测白细胞计数(white blood cell,WBC)、中性粒细胞计数(neutrophil,N)、单核细胞计数(monocyte,M)、淋巴细胞计数(lymphocyte,L),血小板(platelet,PLT)、糖化血红 蛋白(hemoglobin A1C,HbA1c)、空腹血糖(fasting plasma glucose FPG)、白蛋白(albumin,ALB)、ALT、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、尿酸(uric acid,UA)、肌酐(creatinine,Cr),空 腹C肽(fasting C-peptide,FCP)和空腹胰岛素(fasting insulin,FINS)。计算PWR,PWR=PLT/WBC。计算单核细胞与HDL比值(monocyte to high density lipoprotein ratio,MHR)、中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板/淋巴细胞比值(platelet to lymphocyte ratio,PLR)、淋巴细胞/单核细胞比值(lymphocyte to monocyte ratio,LMR),MHR=M/HDL,NLR=N/L,PLR=PLT/L,LMR=L/M。计算胰岛素抵抗指数(homeostatic model assessment for insulin resistance,HOMA-IR),HOMA-IR=FINS×FPG/22.5。计 算NFS,NFS=-1.675+0.037×年龄(岁)+0.094×BMI(kg/m2)+1.13×糖耐量异常或糖尿病(是=1,否=0)+0.99×AST/ALT-0.013×PLT(109/L)-0.66×ALB(g/dL)。
1.3.3 肝脏超声检查:患者行超声检查前需禁食≥8 h,由超声科专业技师行肝脏超声检查,根据《超声医学》诊断标准[6]诊断脂肪肝。
1.4 统计学分析
采用 SPSS 25.0 软件进行统计学分析,符合正态分布的计量资料以表示,2组间比较采用t检验,多组间比较采用单因素方差分析,非正态分布的计量资料以M(P25~P75)表示,2组间比较采用Mann-WhitneyU检验,多组间比较采用 Kruskal-Wallis H检验;计数资料以相对数表示,多组间比较采用χ2检验;采用二分类logistic回归分析探讨T2DM患者合并NAFLD的影响因素、T2DM合并NAFLD患者肝纤维化进展的影响因素;采用受试者操作特征(receiver operating characteristic,ROC)曲线评价PWR对T2DM合并NAFLD患者肝纤维化进展的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 单纯T2DM组与T2DM合并NAFLD组患者临床资料和实验室检查指标比较
2组患者的性别、PLT、ALB、ALP、LDL、Cr、NLR、LMR比较,差异均无统计学意义(P>0.05);2组患者的年龄、病程、胰岛素应用史、BMI、WBC、N、M、L、HbA1c、FCP、FINS、FPG、ALT、AST、TC、TG、HDL、UA、HOMA-IR、MHR、PLR、PWR比较,差异均有统计学意义(P<0.05),见表1。
2.2 T2DM患者发生NAFLD的影响因素分析
以发生NAFLD为因变量,以表1中差异有统计学意义的指标为自变量进行二分类logistic回归分析,结果显示,BMI、TG、UA、MHR是T2DM患者发生NAFLD的危险因素,病程是T2DM患者发生NAFLD的保护因素(P<0.05),见表2。

表1 2组临床资料和实验室检查指标比较Tab.1 Comparison of the clinical data and laboratory test indexes between the two groups

表2 T2DM患者发生NAFLD的二分类logistic回归分析Tab.2 Binary logistic regression analysis of NAFLD in T2DM patients
2.3 T2DM合并NAFLD各纤维化亚组临床资料和实验室检查指标比较
3组患者的性别、M、HbA1c、FPG、AST、UA比较,差异均无统计学意义(P>0.05);3组患者的年龄、病程、胰岛素应用史、BMI、WBC、N、PLT、L、FCP、FINS、ALB、ALT、ALP、TC、TG、HDL、LDL、Cr、HOMA-IR、MHR、NLR、PLR、LMR、PWR比较,差异均有统计学意义(P<0.05),见表3。
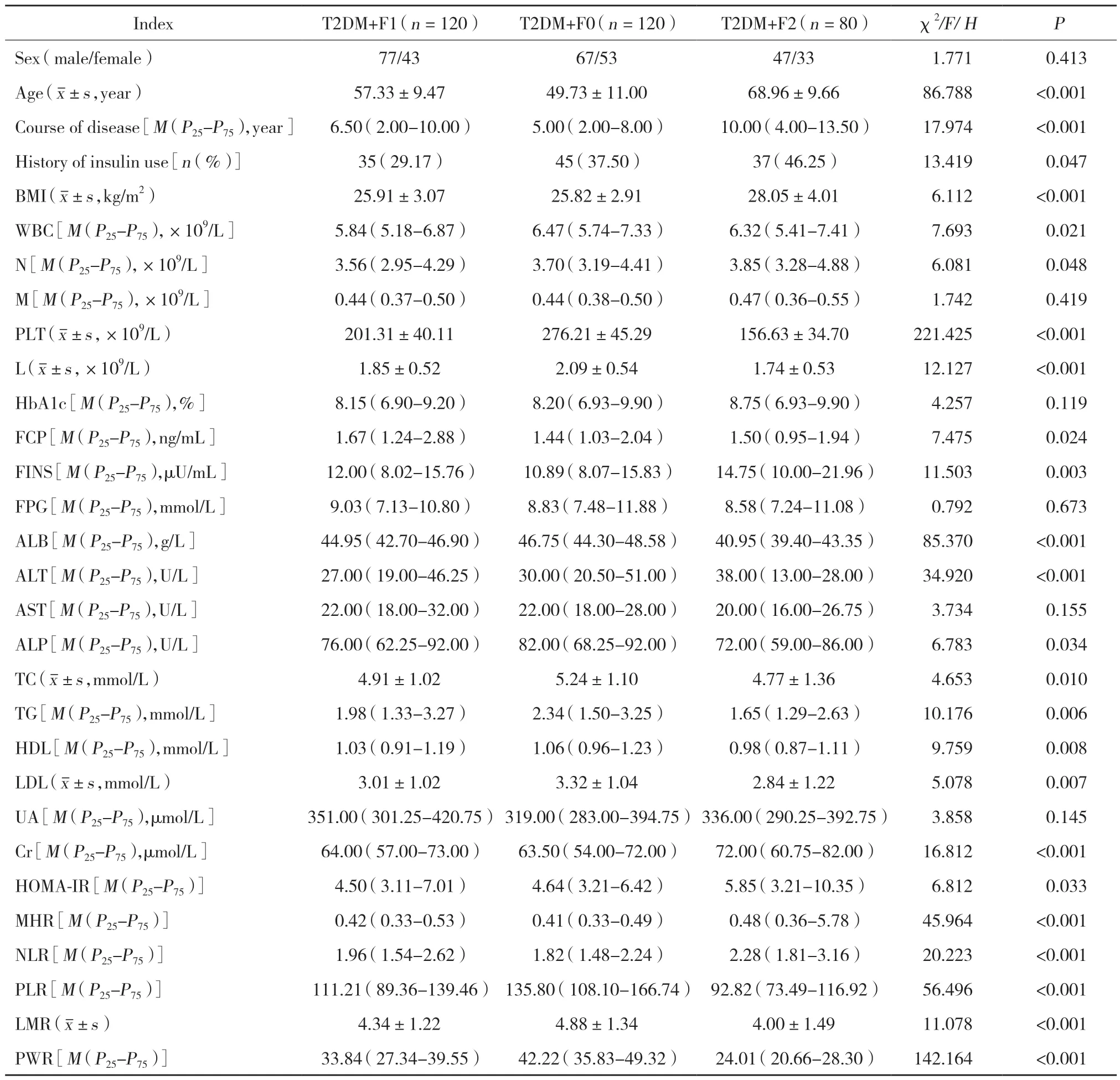
表3 T2DM合并NAFLD各纤维化亚组临床资料和实验室检查指标比较Tab.3 Comparison of clinical data and laboratory examination indices of T2DM and NAFLD fibrosis subgroups
2.4 T2DM合并NAFLD肝纤维化进展影响因素的logistic回归分析
以发生肝纤维化为因变量,以表3中差异有统计学意义的指标为自变量进行二分类logistic回归分析,结果显示,HOMA-IR与T2DM合并NAFLD肝纤维化进展呈正相关,TG、PWR与T2DM合并NAFLD肝纤维化进展呈负相关(P<0.05),见表4。
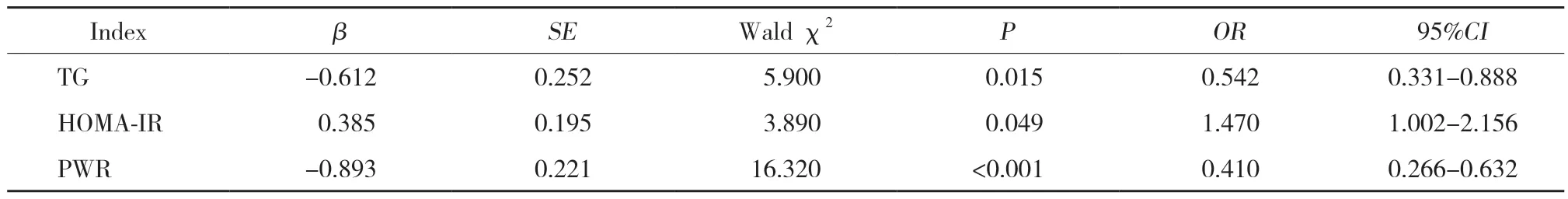
表4 T2DM合并NAFLD肝纤维化进展的二分类logistic回归分析Tab.4 Binary logistic regression analysis of T2DM and NAFLD liver fibrosis progression
2.5 PWR对T2DM合并NAFLD患者肝纤维化的预测价值
PWR可较好地预测T2DM合并NAFLD患者肝纤维化的发生风险,ROC曲线下面积为0.874,当PWR=28.61时,灵敏度为78.8%,特异度为83.3%,约登指数为0.621(图1)。可见PWR对T2DM合并NAFLD患者肝纤维化具有一定的预测价值。

图1 PWR对T2DM合并NAFLD患者肝纤维化的预测价值Fig.1 Predictive value of PWR for liver fibrosis in patients with T2DM and NAFLD
3 讨论
NAFLD进一步发展可出现肝纤维化、肝硬化甚至肝癌。如果能早期识别肝纤维化并及时干预,可能会阻止失代偿期肝硬化的发生发展。PWR作为一个简单易测的指标,已被发现与乙型肝炎患者肝脏纤维化密切相关[1]。
本研究结果显示,MHR是T2DM合并NAFLD的危险因素,单核细胞的募集是肝脏纤维化的关键事件,其参与诱导肝内主要纤维细胞-肝星状细胞的活化过程[7]。MHR可以作为T2DM合并NAFLD的预测因子。研究[8]表明,NAFLD中脂质摄取升高和脂肪从头合成发生率增加导致TG增高,而本研究结果相反,可能与T2DM患者大多长期应用调脂药物,但本研究未纳入药物应用情况有关。
本研究结果显示,PWR与T2DM合并NAFLD患者肝纤维化程度呈负相关,当PWR为28.61时,灵敏度为78.8%,特异度为83.3%,具有较好的临床应用价值。多个研究[9-11]发现WBC计数与NAFLD呈正相关,这可能与IR、氧化应激及全身低度炎症有关。在没有肝硬化的情况下,NAFLD患者的PLT可能会减少,但一般>40×109/L[12]。LIU等[13]认为,肝脏是产生血小板生成素(thrombopoietin,TPO)的重要器官,在NAFLD病程中,过度的脂质沉积和氧化应激可能损害线粒体功能,影响TPO合成,导致PLT减少。也有研究[14]认为PLT减少与脾功能亢进有关,也可能与外周血细胞寿命缩短、维生素缺乏等相关。此外,IR所导致的肝损伤,也可能引发PLT减少,其减少程度与肝组织的脂肪浸润程度有关[15]。本研究发现PWR随纤维化程度的加重而逐渐降低。
本研究未纳入非糖尿病患者,未能在基线水平上进行比较,作为回顾性研究,代表了单中心试验,未排除调脂药物的影响,研究结果具有一定的局限性。综上所述,MHR更适用于NAFLD的早期筛查,而PWR则更适用于纤维化的早期评估,在T2DM人群的筛查中,若MHR增高,应建议患者完善肝脏超声。已有NAFLD的患者发现PWR降低,则应高度警惕肝脏纤维化,及时进行肝纤维化分期,开展多学科诊疗,早期治疗干预,加强临床随访,以降低T2DM合并NAFLD患者肝硬化甚至肝癌的发生风险,提高患者的生活及生存质量。
