神经肽P物质通过Ca2+和CREB诱导自然杀伤细胞的活化作用
2022-06-24赵蔓嘉范世光赵爱农梁再赋傅炜昕
赵蔓嘉,范世光,赵爱农,梁再赋,傅炜昕
(中国医科大学科学实验中心,沈阳 110122)
P物质(substance P,SP)最初被认为是感觉神经递质,广泛分布于中枢和外周神经系统,可参与机体多种生理病理过程,包括疼痛感知,免疫细胞增殖、趋化及炎症等,并在心血管、呼吸和消化系统中发挥作用[1-3]。许多免疫细胞也可产生SP,SP在免疫系统中以旁分泌和自分泌的形式调节免疫细胞功能,如促进免疫细胞增殖和分化,影响免疫球蛋白的合成及细胞因子分泌等[4-5]。SP还通过调节趋化因子和黏附分子的表达,对免疫细胞的迁移发挥重要调节作用[5-6]。SP的生物学功能由3种受体NK-1R、NK-2R、NK-3R介导,其中NK-1R与SP的亲和力最高,故NK-1R为主要介导者[7-8]。研究[9]表明,NK-1R信号转导通路是T细胞活化的最佳Ca2+通量所必需的。CD4和CD8 T细胞都表达功能性NK-1R,在同源T细胞活化过程中自分泌/旁分泌的SP激活NK-1R信号转导通路,从而增加T细胞受体(T cell receptor,TCR)信号转导后的Ca2+通量,这种作用对于后续的启动白细胞介素-2(interleukin-2,IL-2)合成、T细胞存活以及辅助性T(helper T,Th)细胞1和Th17细胞极化的下游信号通路是必需的。
自然杀伤(natural killer,NK)细胞是固有免疫的主要承担者,在机体早期抗感染、抗肿瘤免疫中发挥重要作用[10-11]。NK细胞识别靶细胞后激活,受控于自身共表达的活化性受体和抑制性受体的动态信号平衡[11-13]。研究[14-15]证明,SP对NK细胞功能具有调节作用,SP可刺激NK细胞迁移及细胞毒活性[6,15]。另有研究[16]发现,某些病理状态下,循环SP浓度升高可损伤NK细胞功能,抑制NK细胞杀伤活性。说明SP在不同条件下对NK细胞的作用不同,提示SP对NK细胞的调控作用具有复杂性和多样性,SP主要通过NK-1R调节NK细胞功能[16-17],但确切的信号通路及机制还不十分明确。本研究选用NK92-MI细胞作为研究体系,体外研究SP对NK92-MI细胞增殖、杀伤活性的影响,并探讨SP受体NK-1R在SP调控NK细胞活性中的作用及可能的信号分子机制。
1 材料与方法
1.1 材料
NK92-MI细胞为非IL-2依赖的NK92细胞株,购自中科院上海细胞库。SP购自美国Sigma公司。抗NK-1R单克隆抗体、抗环磷酸腺苷反应元件结合蛋白(cyclic adenosine monophosphate response element binding protein,CREB)/p-CREB单克隆抗体购自美国Abcam公司。FITC标记的二抗购自北京鼎国昌盛生物技术有限公司。
1.2 方法
1.2.1 细胞培养:用含12.5%胎牛血清和12.5%马血清的α-MEM培养基(不含RNA和DNA),在37 ℃、5%CO2培养箱中传代培养NK92-MI细胞。
1.2.2 MTT释放法检测SP对NK92-MI细胞增殖的影响:NK92-MI细胞(1×105/mL)接种于96孔培养板(100 μL/孔),加入10-12mol/L的SP(100 μL/孔),于37 ℃、5%CO2培养箱中孵育;分别于孵育24、48和72 h加入MTT液,继续孵育4 h;加入DMSO和甘氨酸缓冲液溶解甲臜结晶,用酶标仪于570 nm处测定吸光度(optical density,OD)值。用特异性NK-1R拮抗剂[D-Arg1,D-Phe5,D-Trp7,D-Trp9,Leu11] SP(10-7mol/L)预处理NK92-MI细胞30 min,再用10-12mol/L SP作用48 h,MTT法检测NK92-MI细胞的增殖活性。
1.2.3 MTT释放法检测SP对NK92-MI杀伤活性的影响:(1)将4×105/mL的NK92-MI细胞作为效应细胞接种至96孔培养板(100 μL/孔),加入10-12mol/L SP(100 μL/孔)作用24 h;将1×105/mL的K562细胞作为靶细胞,接种至实验孔(100 μL/孔),使效靶细胞比为4 ∶1;效靶细胞共同孵育4 h后,加入MTT液孵育4 h;加入DMSO和甘氨酸缓冲液,振荡15~20 min后,用酶标仪测定570 nm OD值。计算NK-92MI细胞对K562细胞的杀伤率,杀伤率(%)=[1-(杀伤实验组OD值-效应细胞对照组OD值)/靶细胞对照组OD值]×100。(2)用特异性NK-1R拮抗剂预处理NK92-MI细胞30 min,再用10-12mol/L SP作用24 h,MTT法检测NK92-MI细胞对K562细胞的杀伤活性。
1.2.4 荧光定量PCR:采用TRIzol法提取NK92-MI细胞总RNA,经37 ℃、15 min反转录,反应体系10 μL[5×Prime ScriptTMBuffer 4.0 μL,Prime ScriptTMEnzyme MixⅠ 0.5 μL,50 μmol/L Oligo dT primer 0.5 μL,100 μmol/L random 6 mers 0.5 μL,total RNA(﹤500 ng)1.0 μL,RNase Free dH2O 3.5 μL]。PCR反应为两步法,95 ℃30 s预变性;95 ℃5 s,60 ℃34 s,40个循环。PCR反应体系20 μL [SYBY Primix Ex TaqTM(2×)10 μL,PCR上下游引物(10 μmol/L)各0.4 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,模版cDNA 2.0 μL,dH2O 6.8 μL]。用Primer Premier 5.0 软件设计NK-1R引物,由金思特科技有限公司(南京)合成。引物序列,正向5’-TCCACTAACACCTCGGAACC-3’,反向5’-ACA GGCCGTAGTACCATTGG-3’。应用ABI PRISM 7500 Real-Time PCR System进行检测,以18SrRNA作为参照基因,用2-ΔΔCt法比较实验组相对表达量与对照组的倍数差异[18],ΔΔCt=实验组ΔCt-对照组ΔCt。
1.2.5 流式细胞术检测NK-1R的膜表达:用10-12mol/L SP处理NK-92MI细胞24 h,收集、洗涤细胞,加入无标记的抗NK-1R单克隆抗体,4 ℃孵育40 min;洗涤细胞后,再加入FITC标记的二抗,4 ℃继续孵育40 min,洗涤细胞后应用FACScan流式细胞仪进行检测分析。
1.2.6 Fura-2/AM荧光探针法检测NK92-MI细胞胞质钙浓度:用10-12mol/L SP处理NK-92MI细胞1 h,收集、洗涤细胞,加入Fura-2/AM/DMSO液(终浓度为5 μmol/L),37 ℃避光振荡孵育30 min;洗涤细胞后于25 ℃放置30 min,使Fura-2/AM完全去酯化;上机测定荧光强度F,加入10%Triton X-100(10 μL),测定饱和Ca2+溶液的荧光强度Fmax;各管加入EGTA 10 μL,测定零Ca2+溶液的荧光强度Fmin。按下列双波长探针测定的计算公式计算胞质Ca2+浓度,钙含量[Ca2+]=Kd×(R-Rmin)/(R-Rmax)×F2min/F2max,R=Fλ1/ Fλ2,Rmin=F1min/F2min,Rmax=F1max/F2max。Fλ1和 Fλ2分别为在波长λ1与λ2时的荧光强度;F1min和F2min分别为零Ca2+溶液在波长λ1与λ2时的荧光强度;F1max和F2max分别为饱和Ca2+溶液在波长λ1与λ2时的荧光强度。
1.2.7 Western blotting测定CREB磷酸化水平:用10-12mol/L SP作用NK-92MI细胞1 h,收集1×107个细胞,提取细胞总蛋白并定量,行聚丙烯酰胺凝胶电泳。室温、50 V(100 mA)转印PVDF膜3 h。转印膜漂洗后,加入封闭液(10%牛奶)于4 ℃摇床封闭过夜。加入抗CREB/p-CREB单克隆抗体(1 ∶1 000稀释),室温孵育2.5 h;漂洗后,加入二抗(1 ∶2 000稀释)孵育1 h。以β-actin作为内参照。用ECL试剂显影、检测。
1.3 统计学分析
采用SPSS 13.0软件进行统计学分析。数据以表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 SP促进NK92-MI细胞增殖活性
MTT结果显示,10-12mol/L SP可促进NK92-MI细胞的增殖活性,且作用48 h促增殖活性最强(图1A)。NK-1R拮抗剂可完全阻断SP的促增殖活性(图1B)。提示SP通过NK-1R发挥其对NK细胞的促增殖活性。

图1 SP对NK-92MI细胞增殖活性的影响Fig.1 Effects of SP on NK-92MI cell proliferation
2.2 SP对NK92-MI细胞杀伤活性的影响
MTT结果显示,经10-12mol/L SP作用24 h后,NK92-MI细胞对K562细胞的杀伤活性(效靶细胞比为4 ∶1)明显增强(P<0.01),且NK-1R拮抗剂可大部分阻断SP的增强作用(图2)。

图2 SP对NK92-MI细胞杀伤活性的影响Fig.2 Effects of SP on NK-92MI cell killing activity
2.3 SP启动NK-1R受体及Ca2+信号通路
荧光定量PCR结果显示,10-12mol/L SP作用1 h即可促进NK92-MI细胞的NK-1RmRNA表达,作用4 h使NK-1RmRNA表达上调至最高水平;至24 h时,NK-1RmRNA表达水平回落至正常(图3A)。10-12mol/L SP作用1~4 h,NK92-MI细胞的NK-1R膜表达无明显变化,作用至24 h,NK-1R的膜表达明显增加(图3B、3D)。同时发现,SP作用1 h即可引起NK92-MI细胞胞质Ca2+浓度明显升高,而作用至24 h,Ca2+浓度回落至基础水平(图3C)。上述结果表明,SP通过增加NK-1R的表达及激活Ca2+信号通路,发挥对NK92-MI细胞活性的调节作用。

图3 SP对NK-1R及Ca2+信号通路的作用Fig.3 Effects of SP on NK-1R and Ca2+ signaling pathway
2.4 SP诱导NK92-MI细胞CREB磷酸化
选择NK-1RmRNA表达水平和Ca2+浓度均增高的时间点,检测CREB的磷酸化状态。结果显示,未受SP作用的NK92-MI细胞p-CREB水平较低,10-12mol/L SP作用1 h后p-CREB的水平明显增高,表明SP可诱导CREB磷酸化而活化CREB。
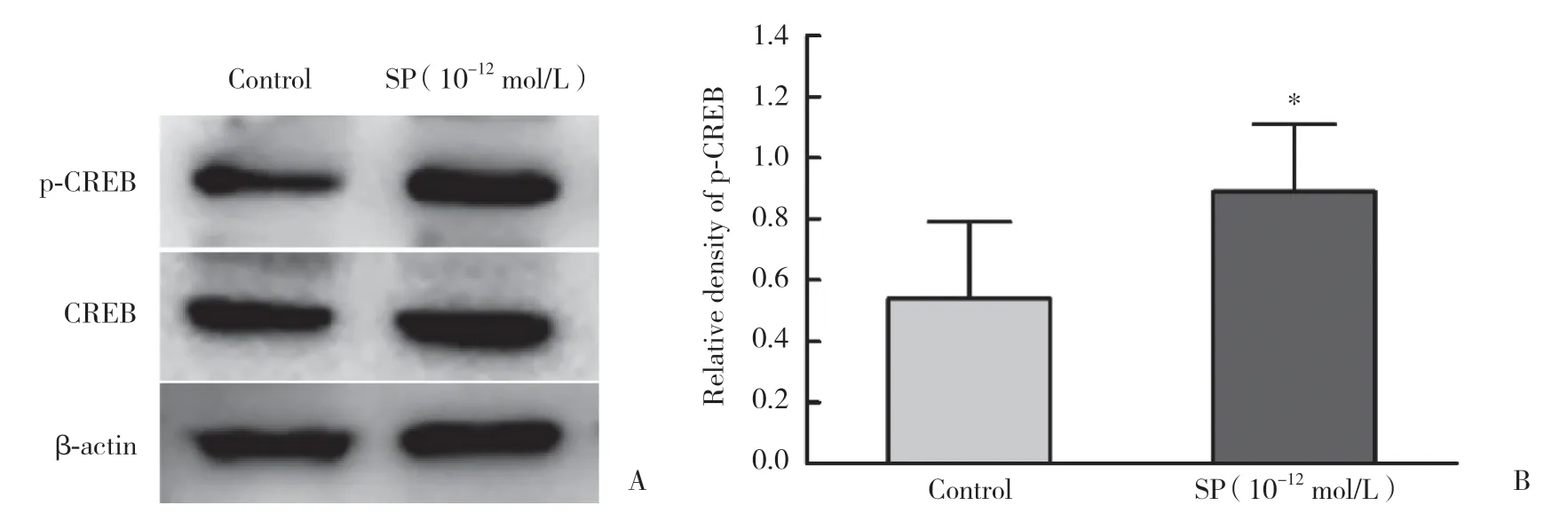
图4 SP诱导NK-92MI细胞CREB磷酸化Fig.4 SP induces CREB phosphorylation in NK-92MI cells
3 讨论
本研究发现,SP可有效促进NK92-MI细胞的增殖和杀伤活性,且该促进作用可被SP受体(NK-1R)拮抗剂完全阻断和大部分阻断。另一方面,SP可诱导NK92-MI细胞NK-1R的表达增加,说明SP可通过NK-1R的表达来介导其对NK92-MI细胞活性的促进作用。
NK-1R广泛分布于神经系统和免疫系统,且在免疫系统中主要参与介导调节功能[6,19]。NK-1R为G蛋白耦联受体(G protein-coupled receptors,GPCRs),与高亲和性配体相互作用,通过不同的G蛋白产生不同的第二信使而发挥作用。主要有2条下游信号转导途径,环磷酸腺苷(cyclic adenosine monophosphate,cAMP)信号途径和磷脂酰肌醇信号途径。NK-1R与Gαq蛋白作用诱导磷酯酶C活化,导致胞内三磷酸肌醇(inositol triphosphate,IP3)和甘油二酯迅速产生,并增加胞质Ca2+作为第二信使[9,11,20]。cAMP则被与NK-1R结合的Gαs蛋白激活[5,11]。NK-1R与SP结合活化可激活几种第二信使,包括钙(Ca2+)、IP3、蛋白激酶C、促分裂原活化蛋白激酶和转录因子核因子κB及CREB等[20-21]。SP与NK-1R结合通过Gαs激活腺苷环化酶,使cAMP水平升高,而激活依赖于cAMP的蛋白激酶A(protein kinase A,PAK);活化的PAK进入细胞核内,使转录因子CREB磷酸化,从而具有转录活性,启动下游基因的转录,完成信号转导途径[21-22]。
前期研究[17]结果显示,SP通过NK-1R介导胞质Gαs的上调和Cαi信号通路参与了其增强NK92-MI细胞杀伤活性及对杀伤介质穿孔素和颗粒酶B表达的促进作用。本研究结果表明,SP可促进NK92-MI细胞胞质Ca2+浓度迅速升高,提示Ca2+依赖的信号通路启动了NK-1R,或部分参与了NK-1R介导的SP活化NK92-MI细胞的信号转导。
本研究结果显示,SP通过增加CREB的磷酸化而活化CREB。CREB是一种碱性亮氨酸拉链转录因子,可由细胞外调节蛋白激酶、Ca2+和应急刺激等信号通过Ser133位点的磷酸化来激活,继而选择性活化一系列下游基因[23-24]。前期研究数据表明,SP可在转录水平调节NK细胞的活性,即上调杀伤介质穿孔素、颗粒酶B以及受体NCRs、NKG2D和NKG2A的mRNA水平。
综上所述,本研究发现cAMP通路参与了NK-1R介导的SP对NK92-MI细胞的活化,且Ca2+和CREB是关键信号分子,这些结果有助于更好地了解SP调控NK细胞功能的作用机制。
