住院癌症患者衰弱风险预测模型的构建与验证
2022-06-23秦岚叶艳欣方庆虹梁静文陈晓薇李菀丹张立力
秦岚,叶艳欣,方庆虹,梁静文,陈晓薇,李菀丹,张立力
数据显示,2020年中国新发癌症人数457万,癌症负担进一步加重[1]。随着临床治疗方法和手段的更新,恶性肿瘤生存率呈现逐渐上升趋势[2],癌症患者的生活质量越来越受到关注。衰弱是由一系列因素引起的,导致个体在一个或多个功能领域(生理、心理、社会)遭受损失,并增加不良后果风险的动态状态[3]。癌症患者由于受到手术、化疗等综合治疗的复杂影响,生理储备下降,极易发生衰弱。衰弱会使癌症患者的依赖性增强,治疗耐受性降低,增加其术后并发症发生、疾病进展及死亡的风险,严重影响患者的生活质量,并且会增加再入院率和医疗费用,给家庭和社会带来沉重的照护负担[4]。如能早期识别衰弱并给予相应处理,衰弱前期可被逆转至健康状态,一些衰弱状态也可被逆转至衰弱前期,还可降低失能患病率、长期照护的需求及医疗资源投入。国外学者对癌症患者的衰弱状况高度重视,已建立数据库开展相关追踪研究[5],我国关于癌症患者的衰弱研究尚处于初级阶段,且主要聚焦于老年癌症人群及化疗期癌症患者的衰弱现况研究,尚未针对住院癌症患者构建衰弱风险预测模型。因此,本研究探讨住院癌症患者衰弱的危险因素,构建基于列线图的风险预测模型,以期为早期识别并预防住院癌症患者的衰弱提供依据。
1 对象与方法
1.1对象 采用便利抽样法,选取入住广州市2所三级甲等医院的570例癌症患者为研究对象。纳入标准:①年龄≥18岁;②经组织学或细胞学诊断为恶性肿瘤;③住院时间≥1 d;④患者和家属知情同意;⑤意识清楚,沟通无障碍。排除标准:①患有其他严重躯体、精神疾病或发生严重并发症;②处于疾病急性期或急性发作后恢复期。采用因变量事件数法[6](Events Per Variable,EPV)计算样本量,即因变量发生的事件数不少于模型中纳入自变量个数乘以的倍数。基于前期调研预计危险因素为 20个,EPV 取值≥5才能保证结果的稳定,可得出本研究所需的有效样本量至少为 100 例,经前期30例小样本测得衰弱发生率为30%,需要纳入的患者数量为 334 例,再考虑10%的失访率,因此建模集样本量应不少于372例。根据风险预测模型外部验证的样本量一般为建模集样本量1/4~1/2 的原则[7],考虑10%的失访率,因此验证集样本量应为104~207例。按照时间顺序将2020年12月至2021年9月入住广州市1所三级甲等医院的422例患者作为建模集,2021年10~11月入住广州市另1所三家甲等医院的148例患者作为验证集。本研究通过南方医科大学南方医院伦理委员会批准(NFEC-2021-063)。
1.2方法
1.2.1调查工具
1.2.1.1一般资料调查表 由研究者自行编制,包括社会人口学特征和疾病资料两部分。前者包括年龄、性别、文化程度、居住情况等;后者包括疾病信息和实验室检查结果,如疾病类型、病程、TNM分期、手术类型、转移情况、白细胞介素-6、C-反应蛋白、降钙素原、红细胞计数、血红蛋白浓度、红细胞沉降率、D-二聚体、三酰甘油等,以上结果均来源于患者的病历和衰弱评估当天的实验室检查报告,若评估当天没有检测,则选取病历中与衰弱评估日期最近1次的实验室检查结果。
1.2.1.2Fried衰弱表型 用于评估研究对象的衰弱状态,共5条诊断指标。①非意向性体质量下降:在过去1年内体质量下降≥3 kg或≥5%。②疲乏:在过去1周中出现“我感觉做任何事情都比较费力,缺乏干劲”超过3 d,患者自评是或否。③行走速度下降:行走5 m所需要的时间。判断标准为:男性,身高≤173 cm,用时≥7 s;身高>173 cm,用时≥6 s。女性,身高≤159 cm,用时≥7 s;身高>159 cm,用时≥6 s。④握力低:使用CAMRY电子握力计(型号EH101)测量,本研究在纸质版问卷调查当天测量,左右手各测量1次,取2次平均值。判断标准为:男性,BMI≤24,握力≤29 kg;BMI为24.1~26.0,握力≤30 kg;BMI为26.1~28.0,握力≤30 kg;BMI>28,握力≤32 kg。女性,BMI≤23,握力≤17 kg;BMI为23.1~26.0,握力≤17.3 kg;BMI为26.1~29.0,握力≤18 kg;BMI>29,握力≤21 kg。⑤躯体活动量降低:以国际体力活动问卷-短卷(IPAQ)评估,≤600 MET-min/周为活动降低。满足3项及以上为衰弱,满足1~2项为衰弱前期[8]。
1.2.1.3安德森症状评估量表 用于评估研究对象过去24 h症状的严重程度,包含13个症状条目。各条目采用0~10分计分,0分表示无症状,1~3分为轻度,4~6分为中度,7~10分为重度。中文版量表具有良好的信效度[9]。本研究中该量表的Cronbach′s α系数为0.848。
1.2.1.4医院焦虑抑郁量表 用于评估研究对象的焦虑、抑郁情况。每个分量表各7个条目,采用0~3分评分,分量表得分0~7分为无症状,8~10分为症状可疑,11~21分为肯定存在症状[10]。本研究中焦虑、抑郁分量表的Cronbach′s α系数均为0.833。
1.2.1.5中文版失志量表 由Kissane等[11]编制,共24个条目。选项“非常不同意”至“非常同意”分别计0~4分,总分96分。得分越高表明失志现象越严重,高于30分诊断为高失志。采用洪晓琪等[12]汉化的中文版量表,在本研究中的Cronbach′s α系数为0.908。
1.2.1.6营养风险筛查2002 用于评估研究对象是否存在营养不良风险,该工具包括疾病严重程度评分、营养受损评分(体重指数、近期体质量变化和膳食摄入变化)、年龄评分(>70岁),评分≥3分为存在营养风险[13]。
1.2.1.7Barthel指数量表 用于评估研究对象的日常活动能力,包括10个条目。根据患者完成每项内容所需要帮助的程度分别计10分、5分、0分,总分100分,61~100分为生活基本自理,41~60分为生活部分自理,0~40分为生活完全不能自理,依赖明显或完全依赖。
1.2.2资料收集方法 由经过统一培训的5名研究者采用统一指导语说明研究目的,获得知情同意,并由患者签署知情同意书。随后评估患者衰弱情况,并发放纸质问卷。对部分填写问卷困难者采用问询的方式,由研究者代为填写。发放问卷577份,7份问卷填写不完整视为无效问卷,共回收570份有效问卷,问卷有效率为98.8%。
1.2.3统计学方法 应用SPSS25.0软件进行数据分析。计量资料不符合正态分布,采用M(P25,P75)表示,均数作为辅助评价数据。采用探索性因子分析,结合方差最大正交旋转法,提取特征值>1且因子载荷>0.35的症状组成症状群,症状群内症状得分总和作为自变量,采用非参数Mann-WhitneyU检验进行组间比较。计数资料采用频数、百分比表示,组间比较采用χ2检验。将单因素分析有统计学意义的变量纳入logistic回归。通过R Studio(4.1.1)软件构建列线图风险预测模型。采用Bootstrap自抽样法对模型进行内部验证,利用验证集数据对模型进行外部验证。绘制ROC曲线、校正曲线及临床决策曲线(Decision Curve Analysis,DCA)。
2 结果
2.1住院癌症患者一般资料 570例患者中,男361例,女209例;年龄18~85(54.08±12.58)岁。食管癌22例,胃癌52例,结直肠癌105例,肝癌126例,肺癌125例,鼻咽癌37例,乳腺癌16例,子宫内膜癌16例,其他癌症71例。TNM分期:Ⅰ期29例,Ⅱ期82例,Ⅲ期149例,Ⅳ期310例。未手术442例,姑息性手术58例,根治性手术70例。病程<1个月110例,1~个月102例,3~6个月102例,>6个月256例。首次确诊436例,复发46例,转移75例,有肿瘤病史的新发肿瘤13例。有化疗史327例,有放疗史96例。
2.2住院癌症患者衰弱发生情况 570例患者中,无衰弱91例,衰弱前期287例,衰弱192例,衰弱发生率为33.7%。非意向性体质量下降259例,疲乏267例,行走速度下降154例,握力低253例,躯体活动量降低192例。焦虑发生率19.1%,抑郁发生率24.7%,高失志状态41.6%。
2.3住院癌症患者症状发生情况及症状群 对建模集安德森症状评估量表中的13个症状进行探索性因子分析显示,KMO统计量为0.855,Bartlett球形检验χ2=1 556.020(P<0.01),适于因子分析。提取特征值>1的因子共3个,对总方差的贡献率为52.843%。根据症状特点,将因子命名为神经心理症状群、消化道症状群及躯体症状群。见表1。
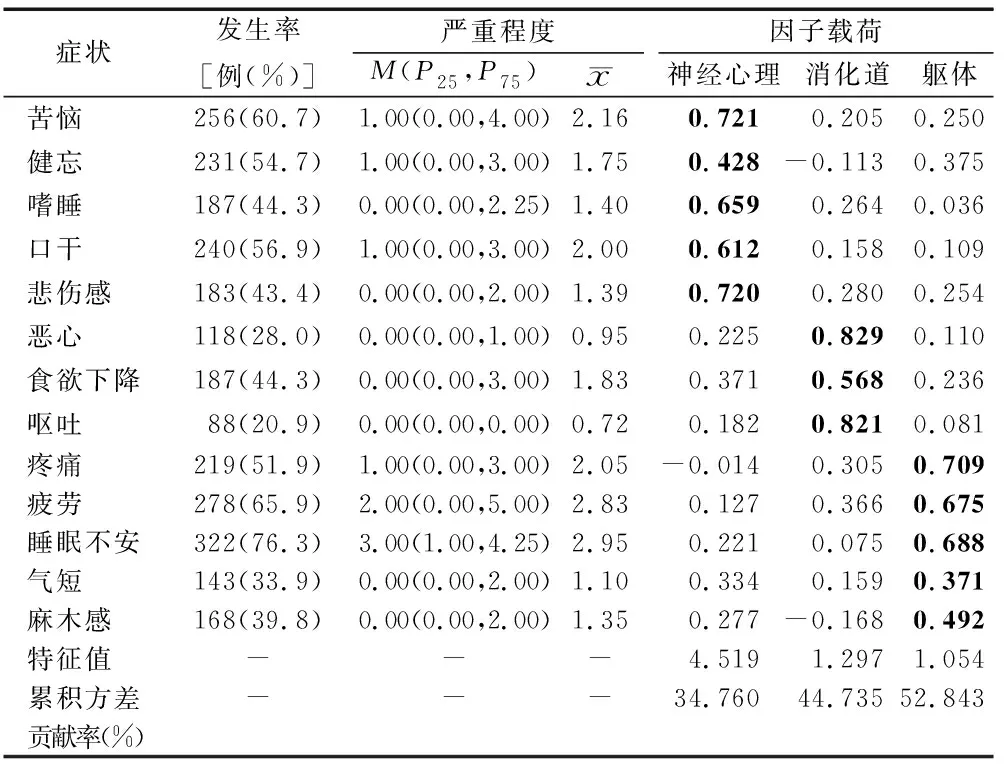
表1 住院癌症患者症状发生情况及症状群提取(n=422)
2.4无衰弱与衰弱住院癌症患者资料比较有统计学意义的项目 见表2。
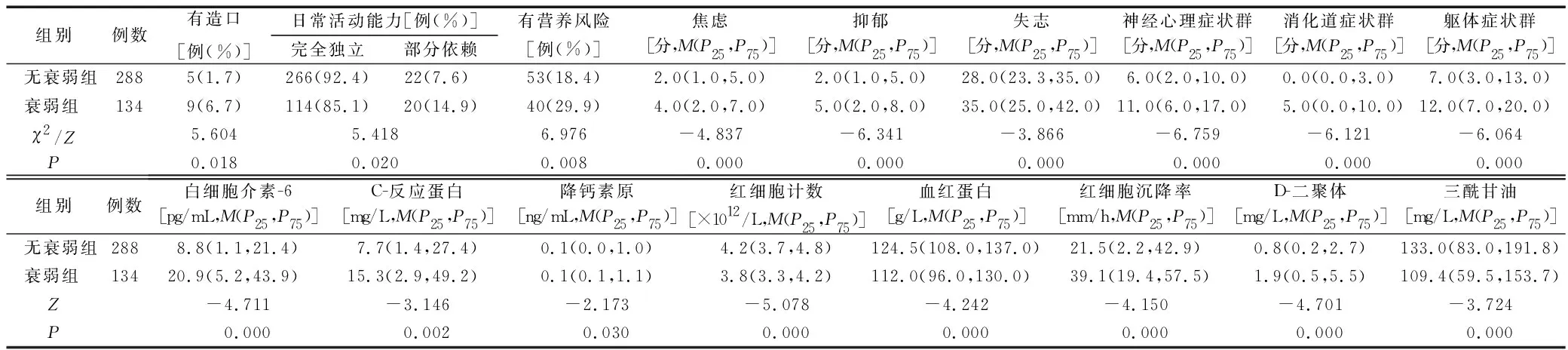
表2 无衰弱与衰弱住院癌症患者资料比较有统计学意义的项目
2.5住院癌症患者衰弱的多因素logistic回归分析 为方便统计分析及临床应用,将实验室指标转化为分类变量,通过ROC曲线确定各变量的最佳截断值(白细胞介素-6=16.637 pg/mL,C-反应蛋白=39.621 mg/L,降钙素原=0.0425 ng/mL,红细胞计数=4.29×1012/L,血红蛋白=165 g/L,红细胞沉降率=26.729 mm/h,D-二聚体=2.815 mg/L,三酰甘油=170.094 mg/L为最佳截断值)。以衰弱为因变量(无衰弱及衰弱前期=0,衰弱=1),单因素分析中有统计学意义的变量为自变量,对自变量进行共线性诊断,结果显示方差膨胀因子(VIF)均小于5,说明变量间不存在共线性。最终,造口(X1)、营养状况(X2)、抑郁(X3)、神经心理症状群(X4)、消化道症状群(X5)、白细胞介素-6(X6)、D-二聚体(X7)为住院癌症患者发生衰弱的独立危险因素(见表3)。由回归结果可得:logitP=-2.823+1.491X1+0.703X2+0.117X3+0.058X4+0.054X5+0.849X6+0.644X7。
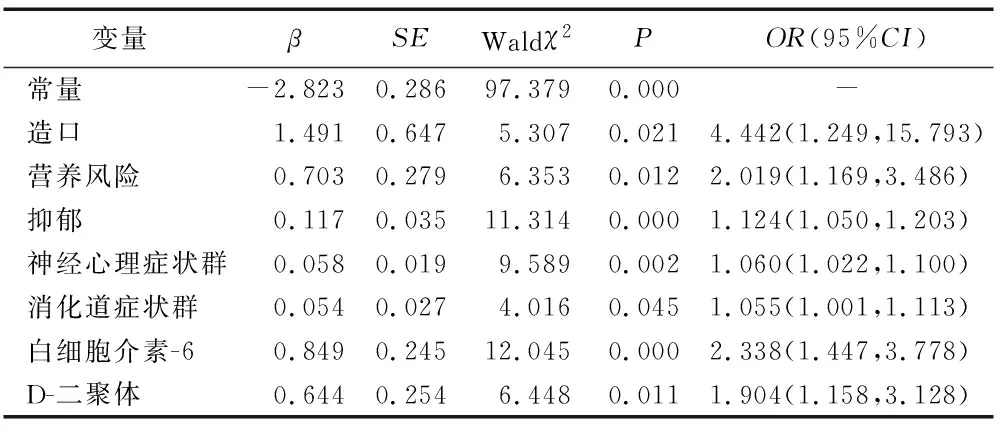
表3 住院癌症患者衰弱的logistic回归分析结果
2.6住院癌症患者衰弱风险预测模型的构建 将logistic回归分析中衰弱发生的独立危险因素纳入R Studio(4.1.1)软件,构建列线图,见图1。将各个危险因素的实际值作一垂线与分数轴相交,相交点对应的水平轴得分即为此危险因素的得分。如1例有造口、D-二聚体为1.94 mg/L、白细胞介素-6为20 pg/mL、有营养风险、抑郁得分4分、神经心理症状群5分、消化道症状群10分的患者、风险得分分别为56分、0分、32分、26分、18分、12分、20分,总分值为164分,投影到列线图中“风险”的定位即该患者发生衰弱的风险概率约为80%。建模集ROC曲线下面积为0.788(95%CI:0.741~0.835),灵敏度为74.6%,特异度为73.3%。Hosmer-Lemeshow检验:χ2=8.480,P=0.388。验证集ROC曲线下面积为0.735(95%CI:0.653~0.817)。Brier得分为0.205,校准斜率为0.625,校准曲线实际值和预测值一致性较高,见图2、3。

图1 住院癌症患者衰弱风险预测的列线图模型
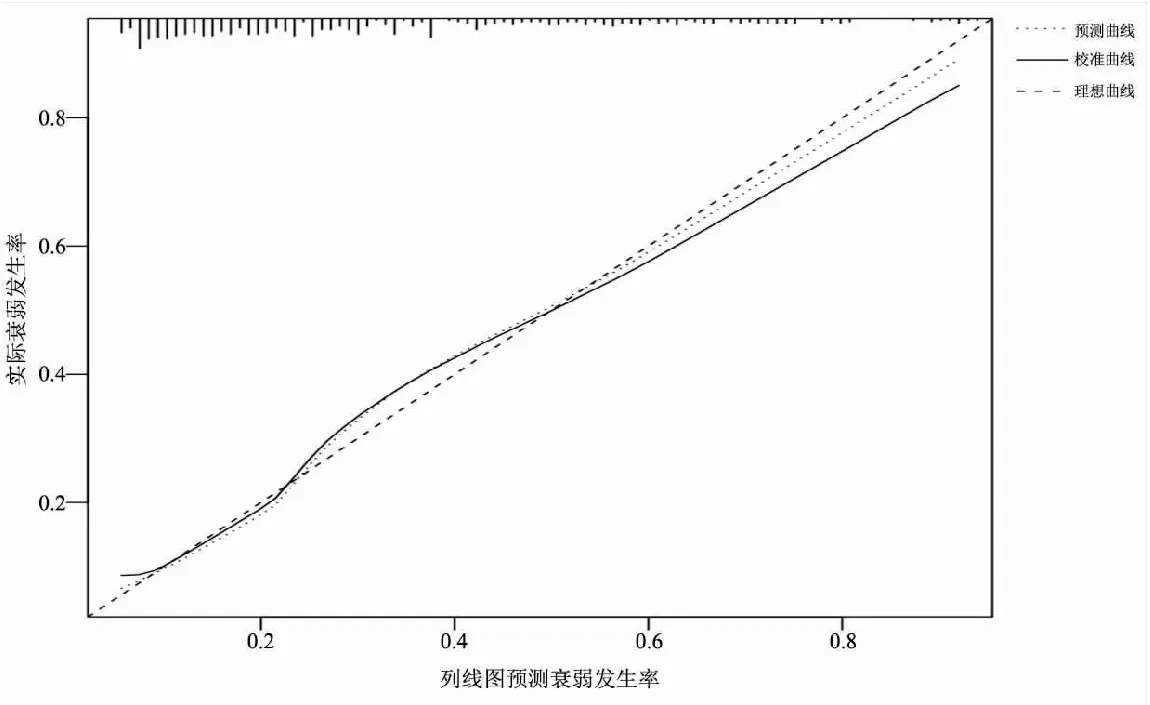
图2 列线图模型预测住院癌症患者衰弱风险的内部验证校准图
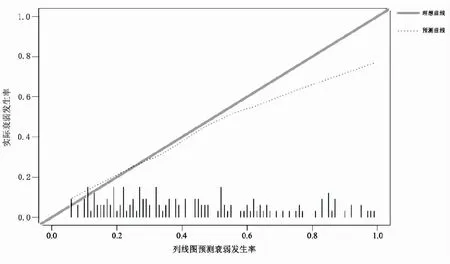
图3 列线图模型预测住院癌症患者衰弱风险的外部验证校准图
2.7风险预测模型的临床可用性评价 本研究构建的风险预测模型的DCA如图4所示,横坐标代表阈值概率,纵坐标代表净获益率。粗黑虚线和灰虚线代表两种极端情况(粗黑虚线假设患者均未接受干预措施,净获益率为0。灰虚线表示患者均接受干预措施,净效益是斜率为负值的反斜线)。灰实线则表示本预测模型的净获益率。灰实线不靠近两条极端情况线,且整体靠近右上角,表明利用本模型对衰弱高危人群进行干预具有临床应用价值。
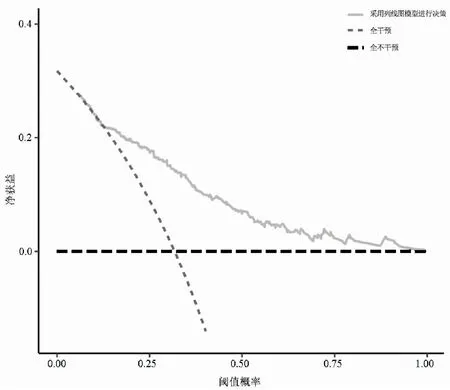
图4 列线图模型的决策曲线分析图
3 讨论
3.1住院癌症患者衰弱现状 国外研究显示,癌症患者衰弱发生率为6.0%~86.0%,中位报告衰弱发生率为42%[4],成年癌症患者衰弱发生率为9.1%~59.0%,是年龄、性别和种族匹配人群衰弱发生率的2~4倍[14]。本研究显示,住院癌症患者衰弱检出率为33.7%,低于陈霞[15](67.3%)和陈菲菲等[16](36.3%)的研究结果,但高于Hayek等[17]的研究结果(6.4%)。造成差异的原因可能是:①本研究与前两者使用的评估工具不同,会造成检出率差异;②化疗作为压力源可能加速衰弱的发生,因而陈霞[15]调查化疗期患者的衰弱检出率较高;③Hayek等[17]纳入的对象平均年龄(37.6±9.6岁),低于本研究对象平均年龄(54.08±12.58岁)。随着年龄的增长,患者发生衰弱的可能性会增高[16]。提示医护人员应运用可靠的工具对住院癌症患者进行衰弱筛查,早期识别、预防及干预。
3.2住院癌症患者衰弱的相关危险因素分析 本研究显示,有造口的癌症患者衰弱风险是无造口患者的4.442倍,且有造口患者每周总体力活动时间少于无造口患者(P<0.05)。造口和癌症的双重打击导致患者的锻炼自我效能感降低[18]。一方面,患者需要护理造口,运动锻炼时间减少;另一方面,很多患者担心外出时自我形象受损或无力处理造口突发情况,而选择在室内活动,导致中等以上强度的体力活动减少。规律运动能有效提高机体肌肉力量,改善炎症反应和氧化应激,促进新陈代谢和细胞修复,从而预防衰弱的发生[19]。因此,可开展造口知识讲座,提供延续性护理等支持手段来促进患者对造口的正确认识,增加身体锻炼等健康促进行为。但本研究纳入的造口患者较少,可能存在入院率偏倚,今后可开展大样本研究进一步证实造口对癌症患者衰弱的影响。
本研究表明,高D-二聚体的癌症患者衰弱风险增加,与郭红菊等[20]在老年住院患者中的研究结果一致。D-二聚体是纤维蛋白形成和降解的产物,其水平升高对诊断血栓性疾病具有重要意义。衰弱主要表现为躯体功能下降和抗应激能力减退,血栓事件是影响身体功能下降的重要因素[21]。此外,D-二聚体参与的凝血系统激活以及继发性凝血改变的炎性反应可能与衰弱的发生直接或间接相关[22],但横断面研究无法证实衰弱与高D-二聚体的因果关系,有待进行纵向研究及机制研究。在癌症治疗过程中,内在的(如慢性炎症)和外在的(如放疗和分子损伤)应激源都可能损害身体细胞修复和生理稳态的能力,从而导致过早衰弱[14]。
白细胞介素-6是住院癌症患者衰弱的独立危险因素,与施红等[23]在老年人中的调查结果一致。白细胞介素-6可促进破骨细胞成熟分化和骨质流失,引起骨密度降低,加速骨骼肌减少,从而加速衰弱[24]。一项系统综述表明,身体、心理和社会衰弱领域最常见的组成部分有行动平衡能力、营养状况和认知功能[25]。本研究中,有营养风险的癌症患者发生衰弱的风险是营养正常患者的2.019倍,癌症患者发生营养不良的风险与肿瘤的影响、癌症治疗的毒副反应、恶病质和厌食症有关,若长期营养不良则会导致机体肌肉质量降低,生理储备下降,引发肌少症和衰弱[26],而衰弱的出现又会进一步加重营养不良,两者相互影响[27]。欧洲营养与代谢学会推荐肿瘤患者首选口服营养补充(Oral Nutritional Supplement,ONS),表明即使在炎症情况下,ONS添加必需氨基酸或大剂量亮氨酸也可以改善肌肉蛋白质合成,且强调了营养干预必须伴随运动训练[28]。Liao等[29]研究表明,蛋白质补充法联合运动治疗在老年人肌少症和衰弱中的作用显著,今后应早期评估癌症患者出现营养不良的风险;进行多方面广泛评估,如测量身体成分、静息能量消耗;使用多模式营养干预和个性化计划,包括增加营养摄入,减轻炎症和高代谢压力,并增加体力活动[30]。
本研究中,住院癌症患者抑郁发生率为24.7%,且抑郁是住院癌症患者发生衰弱的独立危险因素,与既往研究[31-32]一致。有研究显示,存在抑郁情绪的患者C-反应蛋白、白细胞介素-6明显升高,而这些炎性因子与衰弱症状中的肌肉质量下降和肌肉功能受损密切相关[33]。衰弱与抑郁之间的正相关关系已被证明,但两者是相互影响还是存在共同病理生理基础还存在争议[34]。
本研究发现,住院癌症患者存在3个症状群,其中神经心理症状群和消化道症状群为衰弱的独立危险因素。癌肿本身及化疗药物等可能会导致机体出现周围神经病变,表现为急性或慢性神经毒性反应,急性期会出现恶心、呕吐等消化道症状,加之各种原因导致的食欲下降会影响患者的能量摄入,出现营养不良,提高罹患衰弱风险;慢性神经毒性则会表现为健忘、感觉迟钝、肌无力与萎缩等躯体功能异常。已有研究表明,衰弱还与情绪困扰有关[35],突发的癌症事件严重影响患者的正常工作及社交活动,可能会导致患者对生活产生迷茫感和无助感,易出现苦恼、悲伤感等负性情绪,悲伤感又可作为抑郁症的预测因子[36]。以上症状同时发生,相互作用形成相对稳定的症状群,对癌症患者的机体、身心造成更为突出的困扰,增加了衰弱发生的风险。从症状群的角度探讨癌症衰弱患者的症状经历对开展相关症状管理,延缓或逆转衰弱进程具有重要的现实意义。
3.3构建的风险预测模型具有较好的区分度和校准度 目前对癌症患者的衰弱评估主要借助于评估量表,但众多量表的开发大多是基于老年人,尚未考虑癌症因素和其他年龄段人群,故不适用于癌症患者。并且现有的评估量表仅能评估衰弱程度,而无法对衰弱风险进行预测,不利于衰弱的早期预防。临床风险预测模型是指利用多因素模型估算某种疾病或结局发生的概率[37],为治疗干预或健康教育提供更直观、更有效的科学依据。列线图是一种通过带有刻度线段所展示的平面图形,使预测结果更可读易懂[38]。本研究在获取患者衰弱的资料时,基于Gobbens衰弱整合模型[3],在躯体维度的基础上,加入心理学指标及实验室指标等客观指标,能够较全面地反映癌症患者的衰弱情况。 构建的列线图模型外部验证结果显示,ROC曲线下面积为0.735;校准图中的预测曲线与校准曲线均与理想曲线贴合,Brier得分为0.205。提示风险预测模型能有效识别住院癌症患者的衰弱风险。
4 小结
本研究显示,住院癌症患者衰弱检出率较高,造口、D-二聚体、白细胞介素-6、有营养风险、抑郁、神经心理症状群及消化道症状群是住院癌症患者发生衰弱的独立危险因素。医护人员应针对癌症患者衰弱进行早期筛查,建议纳入入院评估范畴,针对性地进行衰弱分级管理,从而减少衰弱的发生及延缓衰弱进展,最终达到减轻衰弱对患者造成的身体伤害和经济负担。本研究样本仅限于广州市,调查的影响因素有限;今后应进行大样本量、多中心的研究;进行深入的机制研究以发现癌症衰弱的生物学标志物;全面纳入影响因素,改进模型的预测效能;开发网页版计算器,使临床应用更便捷,从而促进癌症患者衰弱的预防和管理。
