4种杂粮提取物组分分析及体外降脂功能评价
2022-06-23姚轶俊李枝芳王立峰鞠兴荣
姚轶俊, 李枝芳, 王 博, 王立峰, 鞠兴荣
(江南大学食品学院1,无锡 214122) (南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心2,南京 210023)
中国的杂粮总产量占世界粗粮总产量的17.1%,薏米、赤小豆、青稞、荞麦是4种具有我国特色的杂粮。薏米壳提取物已被证明其酚类成分部分与抗氧化和抗炎活性有关,薏米有可能成为一种针对慢性疾病的功能性食品[3]。德国营养协会最近证明全谷类食物可以降低低密度脂蛋白胆固醇,能减少Ⅱ型糖尿病的风险,在一定程度上减少了成年人肥胖的风险,但针对减少代谢综合征的风险证据不足[4]。现代药理学研究证明,赤小豆具有抗氧化[5]、降血糖[6]、降血脂[7]的作用。青稞中含有多种活性物质,如酚类化合物、黄酮类化合物,β-葡聚糖、γ-氨基丁酸等[8]。洛桑旦达等[9]对我国75个品种青稞中的β-葡聚糖含量进行测定,得到不同品种β-葡聚糖的平均质量分数为5.25%,质量分数最高的品种达8.62%,相较于国外上百个品种的β-葡聚糖含量测定结果,西藏青稞的β-葡聚糖含量最高。荞麦是一种营养丰富、药用价值极高的植物。甜荞蛋白是甜荞麦中的主要营养成分之一,同时也是目前甜荞麦的一个重要的研究方向[10]。芦丁是苦荞中含量最丰富的多酚类物质之一,芦丁具有降低毛细血管脆性,改善微循环的作用,在临床上被用于糖尿病和高血压的辅助性治疗。苦荞麦中还包含了丰富的生物类黄酮、矿物质、维生素、膳食纤维等活性物质,其中膳食纤维质量分数高达1.6%,是普通米面的8倍多[11]。
近年来,相关研究发现杂粮具有良好的降脂功能,其中含有的一些生物活性成分能有效改善脂质代谢异常导致的相关疾病。因此研究人员开始聚焦于谷物饮食对健康的影响[12]。相关研究表明,杂粮中富含的多酚类物质可以通过调节机体脂质代谢从而降低血脂,有效预防心血管疾病的发生[13]。此外,杂粮中膳食纤维的摄入有助于改善肠道菌群的构成,其中益生菌的发酵会给人体带来所必需的营养物质。因此,本实验以薏米、赤小豆、青稞、荞麦为原料,对其提取物中的可溶性总糖、蛋白质、氨基酸、总酚、总黄酮含量进行分析。并通过构建高脂HepG2细胞模型,以TG、T-CHO、LDL-C、AST、ALT作为指标,对其降脂功能进行评价,进一步明确几种我国特色粮食作物的营养价值,为肥胖人群的膳食提供一定的指导。
1 材料与方法
1.1 材料与试剂
薏米(辽宁5号Coixlachryma-jobiL.)、赤小豆(天津红AbrusprecatoriusL.)、青稞(北青3号HordeumvulgareLinn. var. nudum Hook.f.)、荞麦(大三棱FagopyrumesculentumMoench.),当季采收后在阴凉避光条件下储藏,并在3个月内使用。人体HepG2肝癌细胞株、DMEM培养基、胎牛血清(FBS)、青霉素-链霉素溶液、0.25%胰蛋白酶消化液、脂肪酶测试盒 (A054-2)、甘油三酯(TG)测试盒 (A110-1)、低密度脂蛋白胆固醇(LDL-C)测试盒(A111-1)、总胆固醇(T-CHO)测试盒(A112-1)、GOT试剂盒(C010-2, 酶标仪法)、GPT试剂盒(C009-2, 酶标仪法)、BCA蛋白浓度测定试剂盒(A1933-5)、牛血清白蛋白(Bovine Serum Albumin),试剂均为分析纯。
1.2 仪器与设备
DFT-50A粉碎机,SHZ-82A水浴恒温振荡器,SpectraMax M2e多功能酶标仪,K-360凯式定氮仪,TG16-WS台式高速离心机,SN-210高压灭菌锅,ST-16 高速冷冻离心机,CIB-191C CO2培养箱,倒置生物显微镜,SJ-CJ-2FD生物超净工作台。
1.3 方法
1.3.1 杂粮提取物的制备
将薏米、赤小豆、青稞、荞麦洗净烘干,磨粉过60目筛,用纱布包裹并一同置于烧杯中,加入正己烷,料液比1∶4,水浴1 h,水浴温度60 ℃,脱去多余的脂质。取出纱布包,加入蒸馏水,料液比为1∶8,水浴4 h,水浴温度70 ℃;取出纱布包,将水提物离心收取上清液,离心转速为6 000 r/min,离心时间为10 min,重复离心2次;所取得的上清液旋转蒸发除去有机溶剂,再经冷冻干燥得到4种杂粮提取物粉末。
1.3.2 蒽酮比色法测定杂粮提取物的可溶性总糖含量
标准曲线的制作:将葡萄糖在80 ℃的烘箱中烘至质量恒定,取0.1 g定容至100 mL,再取出10 mL,定容至100 mL,即可得到0.1 mg/mL的葡萄糖标准溶液,分别取葡萄糖标准溶液0、0.1、0.2、0.3、0.4、0.6、0.8 mL,用蒸馏水定容到1 mL,再分别加入蒽酮试剂5 mL,沸水浴中加热10 min,在620 nm波长中进行测定。以OD值为纵坐标,葡萄糖标准液浓度为横坐标,作图得到葡萄糖的标准曲线。
4种杂粮可溶性总糖的提取及测定:分别准确称取0.1 g的薏米粉、赤小豆粉、青稞粉和荞麦粉,并加入50 mL质量分数为80%的乙醇,恒温45 ℃加热10 min,取其滤液1 mL,同时用蒸馏水做空白对照,冷却后备用。测定4种杂粮中可溶性总糖的含量,计算公式为:
可溶性总糖质量分数(以葡萄糖计)=p×稀释倍数×10-4×100%
式中:p为从标准曲线中查得的糖质量浓度/μg/mL;10-4为将μg/mL换成百分数的系数。
1.3.3 杂粮提取物中蛋白质及氨基酸含量的分析
蛋白质含量测定参考GB 5009.5—2016。将4种杂粮用料理机进行匀浆,放置于低温冰箱中冷冻保存,使用时再将其解冻。准确称取一定量的样品,精确到0.000 1 g,在水解管内加入15 mL 6 mol/L盐酸,加入新蒸馏的苯酚3滴,再将水解管放入冷冻剂中,冷冻5 min,在接到真空泵的抽气管上,抽真空后充入高纯氮气,重复3次后封口。将封好口的水解管放在110 ℃的恒温干燥箱内水解22 h,取出冷却,过滤水解液转移到50 mL容量瓶内,用去离子水定容。吸取1 mL滤液放入5 mL容量瓶内,在45 ℃的真空干燥器中干燥,残留物用1 mL水溶解,再进行干燥,重复2次最后蒸干后用1 mL pH 2.2的缓冲溶液溶解,供仪器测定用。准确吸取0.2 mL混合氨基酸标准,用pH 2.2的缓冲液稀释到5 mL,此标准稀释浓度为5 nmol/50 μL,作为上机测定用的氨基酸标准,用氨基酸自动分析仪以外标法测定样品测定液的氨基酸含量。
1.3.4 杂粮提取物的总酚及总黄酮含量测定
总酚测定:取4种杂粮各个阶段提取物的冻干样品0.1 g,溶于1 mL 80% 丙酮后,过0.45 μm的滤膜,用蒸馏水稀释10倍后,加入1 mL的5倍稀释的福林酚试剂混匀,反应5 min后加入2 mL的15% Na2CO3溶液,用蒸馏水定容到10 mL,避光2 h,用酶标仪测定760 nm下的吸光度。标准曲线的绘制:称取0.1 g的没食子酸标准品,用蒸馏水定容于100 mL的容量瓶,然后从容量瓶中再取5 mL用蒸馏水定容到50 mL的容量瓶中。分别取0、0.2、0.4、0.6、0.8、1.0 mL的没食子酸标准溶液(0.1 mg/mL)加入1 mL的5倍稀释的福林酚试剂混匀,反应5 min后加入2 mL的15% Na2CO3溶液,用蒸馏水定容到10 mL,避光2 h,用酶标仪在96孔板上每孔150 μL测定760 nm下的吸光度。以浓度为横坐标,吸光度为纵坐标作标准曲线,得回归方程y=82.89x+0.044,R2=0.999。总酚含量以每克薏米等同于没食子酸(GAE)的毫克数表示[14]。
总黄酮测定:准确称取芦丁标准品15 mg,用50%乙醇溶解并定容至50 mL,得到质量浓度为0.3 mg/mL的芦丁标准溶液。取7支试管编号,分别按表1中所给的量加入各种试剂,并测定其吸光值。加入5% NaNO2溶液0.4 mL后,摇匀,放置6 min;加入10% Al(NO3)3溶液0.4 mL后,摇匀,放置6 min;加入5% NaOH溶液4 mL,再加入2.2 mL蒸馏水,摇匀,放置15 min。以0号试管为空白,于510 nm处测吸光值。以芦丁的含量(mg/mL)为横坐标,OD值为纵坐标绘制标准曲线[15]。
1.3.5 细胞培养
HepG2细胞培养在含8% 胎牛血清、50 units/mL青霉素和50 μg/mL链霉素的DMEM培养液中,培养环境为37 ℃,5% CO2。
1.3.6 细胞毒性测试(MTT)
采用MTT法对薏米、赤小豆、青稞、荞麦的提取物进行细胞毒性实验。将HepG2细胞以5 000~10 000 cells/孔的数量接种到96孔板中,每孔100 μL,边缘用PBS填充,铺好板后盖上盖子,十字摇匀,不要旋转摇晃,于CO2培养箱(5% CO2、37 ℃)中培养24 h。将4种杂粮的消化产物用培养液溶解,配置成不同的梯度,换掉96孔板中的培养液,加入样品液,不含样品的培养液视为对照组。每孔100 μL,设5个重复。继续培养24 h后,吸弃上清液,每孔加入120 μL MTT(0.1 mg/mL)溶液,继续培养4 h。终止培养,小心吸弃孔内液体,每孔加入100 μL DMSO,置于摇床上低速振荡10 min或置于培养箱中30 min,使结晶充分溶解。酶标仪下检测490 nm下各孔的吸光值[13]。实验中设凋零孔、对照孔及加药孔。凋零孔:不含细胞的完全培养基、MTT、DMSO;对照孔:细胞悬液、药物溶剂、MTT、DMSO;实验孔:细胞悬液、不同杂粮提取物、MTT、DMSO。

1.3.7 HepG2高脂细胞模型建立及降脂活性测定
蛋白吸附法配制油酸溶液:70 ℃振荡水浴下将油酸溶于0.1 mmol/L NaOH中,配成 100 mmol/L 的储存液;55 ℃振荡水浴下将储存液滴入10% BSA 的PBS溶液中,配成浓度5 mmol/L的使用液,过滤除菌,-20 ℃ 冷冻保存,使用前55 ℃水浴15 min并冷却至室温,用完全培养基稀释至0.25 mmol/L。将 HepG2 细胞接种于6孔板,孵育24 h后取出,对照组加含8%~10% FBS的高糖DMEM培养基,模型组加入含终浓度2.5 mmol/L油酸的8%~10% FBS高糖DMEM培养基,继续培养24 h,高脂模型构建完成[13,16]。
细胞经分组培养后,分别加入4种杂粮提取物,并设置空白对照。继续培养24 h后,吸除培养液,PBS轻柔洗涤3次,加入IP细胞裂解液,冰浴裂解细胞30 min,按照甘油三酯(TG)、总胆固醇(T-CHO)、低密度脂蛋白(LDL-C)、天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)试剂盒操作说明测定细胞内照甘油三酯(TG)、总胆固醇(T-CHO)、低密度脂蛋白(LDL-C)、天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)的含量。按照BCA蛋白浓度测定试剂盒操作说明测定细胞中蛋白质含量。用蛋白含量校准细胞中甘油三酯(TG)含量。
1.4 数据统计分析
采用SPSS 20.0软件进行数据分析,结果均表示为“平均值±标准偏差”,应用GraphPad 7.0进行图形绘制,每组实验重复3次。不同小写字母表示差异显著(P<0.05)。
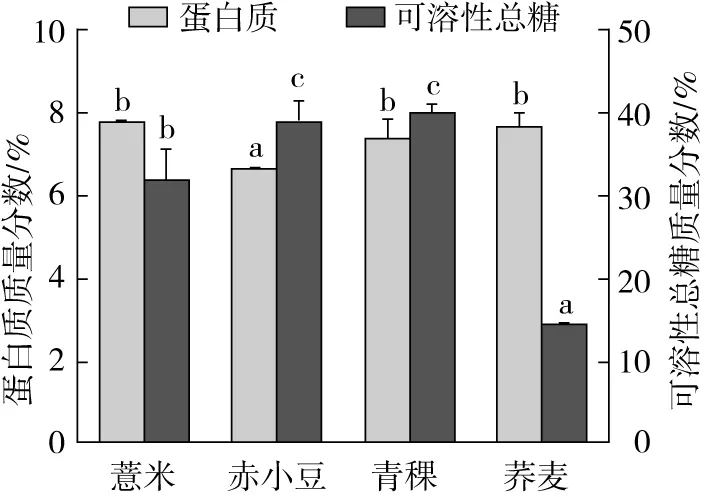
注:不同小写字母表示相同指标下4种杂粮差异显著(P<0.05),余同。图1 薏米、赤小豆、青稞、荞麦提取物中的蛋白质及可溶性总糖含量
2 结果与分析
2.1 4种杂粮中蛋白质及可溶性总糖含量的分析
薏米、赤小豆、青稞和荞麦提取物中所含有的蛋白质及可溶性总糖含量如图1所示。其中赤小豆和青稞提取物中所含的可溶性总糖最高可达到39.43%和40.24%。赤小豆和青稞提取物中的可溶性总糖含量相当,薏米提取物次之,荞麦提取物最少。采用蒽酮比色法测定4种杂粮提取物中可溶性总糖的含量,利用强酸可使糖类脱水成糖醛,生成的糖醛或羟甲基糖醛与蒽酮脱水缩合,形成蓝绿色的糖醛衍生物来测定[17]。可溶性糖如葡萄糖在植物的生命周期中具有重要作用。它不仅为植物的生长发育提供能量和代谢中间产物,而且具有信号功能,它也是植物生长发育和基因表达的重要调节因子[18]。从蛋白质总量上来看,薏米和荞麦提取物中的蛋白质质量分数较高,分别可以达到7.79% 和7.66%。青稞提取物中蛋白质的含量次之,赤小豆提取物中含有的蛋白质含量最低。有研究结果证明,赤小豆的矿物质价值要比赤豆高,如赤小豆的钙、锌含量是赤豆的3.1倍和1.6倍,但赤小豆的粗蛋白含量比赤豆低13.95 g/100 g[19]。
2.2 4种杂粮提取物中氨基酸含量的分析
由表1可知,4种杂粮提取物中含有16种氨基酸,其中7种为必需氨基酸,9种为非必需氨基酸。其中荞麦提取物中谷氨酸、天冬氨酸、丝氨酸、甘氨酸和精氨酸含量较高。青稞提取物中半胱氨酸、缬氨酸、酪氨酸和苯丙氨酸的含量较高。赤小豆提取物中甲硫氨酸和赖氨酸的含量较高。薏米提取物中丙氨酸、亮氨酸和组氨酸的含量较高。谷氨酸是肌肉中最丰富的游离氨基酸,约占人体游离氨基酸总量的60%。谷氨酸被人体吸收后可以与血氨形成谷酰氨,能解除代谢过程中的氨毒害作用,因而能预防和治疗肝损伤[20]。天冬氨酸参与鸟氨酸循环,促进氧和二氧化碳生成尿素,降低血液中氮和二氧化碳的量,增强肝脏功能,消除疲劳。L-半胱氨酸是一种氨基酸类解毒药,它参与细胞的还原过程和肝脏内的磷脂代谢,有保护肝细胞不受损害,促进肝脏功能恢复和旺盛的药理效应[21]。缬氨酸能促进身体正常生长,修复组织,调节血糖,并提供需要的能量[22]。荞麦提取物中含量较多的氨基酸,如谷氨酸和天冬氨酸,对人体的肝脏有很好的保护作用。青稞提取物中富含的氨基酸,如半胱氨酸、酪氨酸、苯丙氨酸等,可用于面团改良剂、食品添加剂等。
Emebiri等[23]在研究谷物中天冬氨酸含量的遗传变化率时发现92个品种的谷物中游离天冬氨酸含量为137~471 mg/kg。本实验结果表明,薏米和青稞提取物中天冬氨酸的含量为99.3、128.4 mg/kg,与其结果相较偏低,这可能是由于谷物品种的原因,日照时间、生长周期、成熟度等都会影响,与国外品种在成分组成上可能略有差异。

表1 薏米、赤小豆、青稞荞麦提取物中的氨基酸含量/g/100 g
2.3 4种杂粮提取物中总酚及总黄酮含量的分析
图2结果表明,青稞提取物中的总酚含量最高可以达到84.24 mg GAE/100 g;薏米和赤小豆提取物中的总酚含量次之,为83.21、81.17 mg GAE/100 g;荞麦提取物中的总酚含量最低68.54 mg GAE/100 g。因为多酚的酚羟基结构中的邻位酚羟基很容易被氧化成醌类结构,并在此过程中消化环境中的氧,同时捕捉活性氧等自由基,所以多酚含量的多少与其抗氧化能力成正比[24]。

图2 薏米、赤小豆、青稞、荞麦提取物中的总酚含量
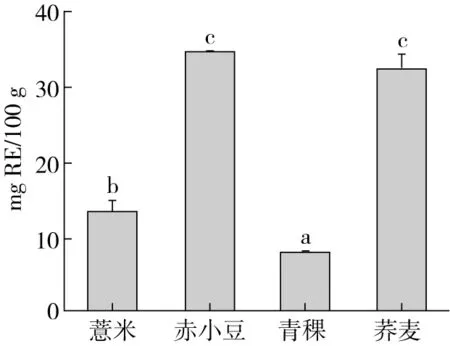
图3 薏米、赤小豆、青稞、荞麦提取物中的总黄酮含量
如图3所示,赤小豆提取物中总黄酮含量最高 (34.794 mg RE/100 g)。这可能与赤小豆的种皮有关。赤小豆种皮含有多种潜在生物活性的色素,包括多酚类物质,如原花青素[25]。这也是赤小豆中总黄酮含量最高的原因。荞麦提取物的总黄酮含量次之,为32.57 mg RE/100 g;薏米和青稞提取物中的总黄酮含量较少,分别为13.49 mg RE/100 g和7.81 mg RE/100 g。目前,类黄酮作为抗氧化剂和自由基清除剂被广泛应用。如王兰等的研究表明,葛根异黄酮具有降血糖活性,能够使糖尿病小鼠的抗氧化能力增强,改善糖尿病小鼠的糖脂代谢,对其有很好的保护作用[26]。
2.4 4种杂粮提取物对HepG2细胞毒性测试
很多研究证明杂粮具有一些潜在的功能,如抗氧化,抗肥胖和抗炎。然而,也有一些抗营养因素可能产生某些不良反应[27]。当它们被浓缩时,可能引起免疫反应并被代谢生成有毒产物[28]。因此,有必要评估其对HepG2细胞的安全性。如图4所示,随着青稞提取物浓度的升高HepG2细胞的存活率在逐渐下降。当从青稞提取物的浓度高于1 000 μg /mL,HepG2细胞生存开始低于90%,这个结果表明添加物的剂量对于维持HepG2细胞处于一个良好的生存状态十分重要的。Rao等[29]证明麦片甲醇提取物浓度为500 μg/mL时对人类结肠癌细胞株没有表现出任何明显的细胞毒作用。然而,本实验采用了一种更加简单安全的方法,水提取,使提取物具有更高的安全性。在陈超等的研究中用丙酮提取脱脂后的薏米当其质量浓度达到25~500 μg/mL时,HepG2细胞的活力就开始明显地被抑制[30]。但是采用水提法提取的组分当其浓度达到5 mg/mL时,HepG2细胞显示仍然没有毒性。因此鉴于提取方法,当4种杂粮提取物质量浓度为1 000 μg/mL时,对于HepG2不产生细胞毒性。
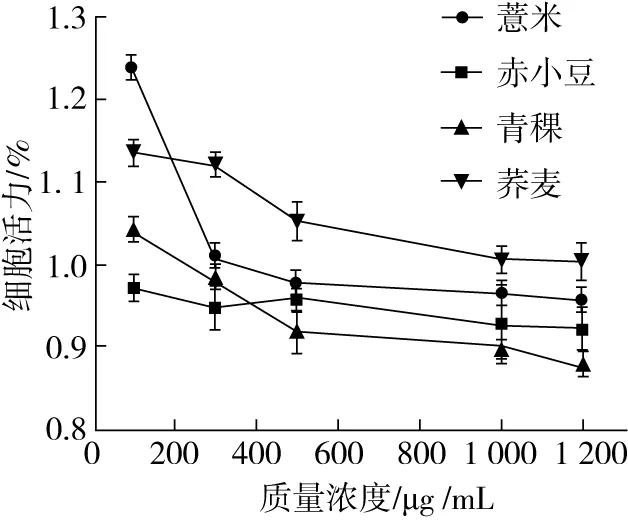
图4 薏米、赤小豆、青稞、荞麦的提取物对细胞活力的影响
2.5 4种杂粮提取物对HepG2高脂细胞内TG、T-CHO、LDL-C、AST和ALT水平的影响
油酸诱导的HepG2细胞内的TG和T-CHO浓度较正常的HepG2细胞明显升高,如图5所示。油酸诱导后,细胞内TG和T-CHO含量明显升高,4种种杂粮提取物的添加均有效地降低了其TG和T-CHO的浓度。与没有添加杂粮提取物的高脂细胞相比较,薏米提取物、赤小豆提取物、青稞提取物和荞麦提取物分别使高脂细胞内的甘油三酯的含量降低了36.5%、24.4%、34.4%和16.9%。在针对降低细胞内甘油三酯的功能上来看薏米和青稞的提取物的效果更为突出。高脂细胞内T-CHO的含量在添加了薏米、赤小豆、青稞、荞麦提取物后,T-CHO的质量分数分别降低了11.4%、11.5%、21.4%、5.9%。其中综合来看青稞提取物的作用效果最为显著。青稞提取物处理后细胞内TG和T-CHO含量较油酸对照组明显降低。结果表明,与未加1 mg/mL青稞提取物的高脂血症HepG2细胞相比,细胞内TG质量分数降低34.4%,T-CHO质量分数降低21.4%。Veronika等[31]研究了青稞中的β-葡聚糖对小鼠胆固醇代谢的影响。结果表明,经β-葡聚糖处理后,TG降低24.14%,T-CHO降低15.53%。相比之下,实验中从青稞中提取的混合物比单一的β-葡聚糖效果更好。青稞提取物中含有丰富的多酚类物质,能有效降低甘油三酯的含量。

图5 薏米、赤小豆、青稞、荞麦的提取物对经过油酸处理的HepG2细胞内甘油三酯和总胆固醇的影响
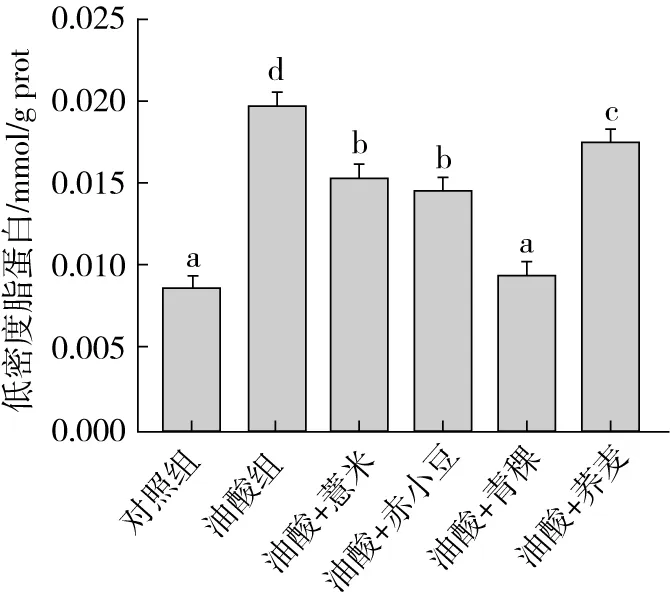
图6 薏米、赤小豆、青稞、荞麦的提取物对经过油酸处理的HepG2细胞内低密度脂蛋白的影响
如图6所示,经油酸处理后,低密度脂蛋白的含量显著升高,是对照组含量的约2.3倍,在加入4种杂粮的提取物后,其含量都有明显的降低,可以观察到青稞提取物的效果尤为显著,经青稞提取物处理后LDL-C降低了51.8%。薏米提取物、赤小豆提取物和荞麦提取物的添加分别使高脂细胞中低密度脂蛋白的质量分数降低了21.8%、26.1%和10.6%。
天冬氨酸转氨酶和丙氨酸转氨酶是肝脏健康的指标。只要有1%的肝细胞坏死,血液中的酶活性就会增加1倍,所以尤其是丙氨酸转氨酶是急性肝细胞损伤的敏感标志物。从图7可以看出,青稞和荞麦的提取物可以明显地降低AST的含量,经过青稞和荞麦提取物处理后AST分别下降了21%和16.8%,而薏米和赤小豆提取物对AST的效果并不明显。细胞内ALT的含量在经油酸诱导后有极其显著的上升,4种杂粮的提取物均有效地降低了其含量,与没有添加杂粮提取物的细胞相比,添加了薏米、赤小豆、青稞和荞麦提取物的细胞中ALT的质量分数分别降低了35.2%、28.1%、51.5%和44.3%。其中青稞提取物的效果更为突出,有研究表明酚酸是青稞中的主要酚类物质,大部分集中在麸皮和胚芽,芦丁、阿魏酸、p-香豆酸和表儿茶素是青稞总多酚提取物中的主要成分,可增强小鼠体内抗氧化防御系统以及棕色脂肪相关基因表达[32]。青稞对细胞内AST和ALT降低有显著的作用,进而对肝脏有很好的保护作用,也可能与青稞中富含的酚酸类活性成分的组成以及相对含量有关。将在后期的实验中利用该质谱技术分析其中全部的酚酸化合物,并结合体内实验利用分子生物技术进一步研究其调控脂质代谢的作用机理。
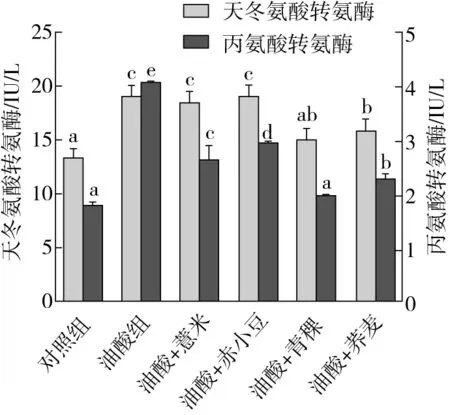
图7 薏米、赤小豆、青稞、荞麦的提取物对经过油酸处理的HepG2细胞内天冬氨酸转氨酶和丙氨酸转氨酶的影响
3 结论
对4种杂粮进行了脱脂提取,系统分析了其提取物的组分含量,并基于HepG2高脂模型对其降脂功能进行评价。结果表明,赤小豆和青稞提取物中的可溶性总糖含量相当,薏米提取物次之,荞麦提取物最少。此外,青稞提取物中的总酚含量最高可以达到84.24 mg GAE/100 g;赤小豆由于其种皮含有多种潜在生物活性的色素,因此其提取物中总黄酮含量最高(34.794 mg RE/100 g)。4种杂粮提取物在一定程度上均能有效降低高脂细胞内TG、LDL-C、T-CHO、AST、ALT的含量。从整体上看,青稞提取物的效果较为突出,青稞提取物处理后细胞内TG和T-CHO含量较油酸对照组明显降低。结果表明,与对照组相比,添加1 mg/mL青稞提取物后,高脂HepG2细胞细胞内TG质量分数降低34.4%,T-CHO质量分数降低21.4%,LDL-C降低了51.8%,ALT下降51.5%,AST下降21%,表现出最佳的降脂功能。因此后续将对青稞的活性成分进行进一步的探究,通过对机体内相关通路的调控作用探明其降脂机理。
