乳积方对乳腺癌MDA-MB-231细胞株miRNA表达谱的影响
2022-06-23李宏良田华琴王斌李岩王凯梁贵文陈学彰朱志霞陈锡康
李宏良,田华琴*,王斌,李岩,王凯,梁贵文,陈学彰,朱志霞,陈锡康
(1.广州中医药大学附属佛山中医院肿瘤中心,广东 佛山 528000;2.中国科学院生物物理研究所,北京 100101;3.广东中科康仪生物技术有限公司,广东 佛山 528300)
乳腺癌是女性最常见的恶性肿瘤。在乳腺癌的发生发展过程中,癌基因起了重要作用。近年来国内外的研究发现[1],微小RNA(microRNA,miRNA)参与了这些癌基因的表达调控。亦有研究报道[2],中药及其活性成分对miRNA具有广泛调节作用,通过上调或下调miRNA进一步促进其靶基因降解或抑制其靶基因的翻译可能发挥抗肿瘤作用。乳积方是本研究组用以防治乳腺癌复发转移的经验方。前期研究结果发现[3],乳积方制剂对乳腺癌MCF-7及MDA-MB-231细胞株的生长具有抑制作用,其中对MDA-MB-231效果更为明显。本研究拟探讨乳积方对乳腺癌MDA-MB-231细胞miRNA表达谱的影响,利用差异化miRNA靶基因预测及GO&Pathway分析获取其相关的生物学功能,通过QPCR验证差异化表达miRNA,以明确乳积方抗肿瘤的作用靶点,进而为指导乳腺癌中医治疗方案的优化提供实验依据。
1 材料
1.1 药物
乳积方由柴胡、白芍、党参、八月札、瓜蒌皮、浙贝母、穿山甲、海藻等组成,购自广州至信药业有限公司。
1.2 细胞株
人乳腺癌细胞MDA-MB-231由中山大学肿瘤医院提供。
1.3 主要仪器和试剂
MultiskanFC酶标仪(美国Thermo公司);BDS400倒置荧光显微镜(重庆奥特光学仪器有限责任公司);NanoDrop ND-1000分光光度计(美国NanoDrop科技有限责任公司);MAUI生物芯片杂交仪(美国BioMicro Systems);GenePix4000B芯片扫描仪(美国Axon公司);Gene Amp PCR System 9700(美国Thermo公司);ViiATM7 Real-Time PCR System(美国Thermo公司);miRCURYTM LNA Array (v.19.0)芯片(丹麦Exiqon公司);RNasey Mini Kit 试剂盒(德国QIAGEN公司);2X PCR master mix试剂盒(美国Arraystar);TRIzol试剂(美国Invitrogen公司);miRCURYTM Array Power Labeling kit (Cat # 208032-A)试剂盒(丹麦Exiqon公司);DMEM 培养基、胎牛血清、胰蛋白酶(美国Hyclone公司)。
2 方法
2.1 药物制备
乳积方由柴胡10 g,白芍15 g,党参15 g,八月札15 g,瓜蒌皮15 g,浙贝母10 g,穿山甲10 g,海藻15 g等组成,药材经品种鉴定后用文火煎煮2次,合并药液,过滤,弃去药渣,将滤液煎煮浓缩至每1mL含生药2 g。取适量药液用无菌水将乳积方配制成2 mg/mL的浓度,以0.22 μm微孔滤膜过滤器过滤除菌,置4 ℃冰箱保存备用。
2.2 细胞培养
人乳腺癌细胞MDA-MB-231在37 ℃、5% CO2条件下,用含有链霉素(50 units/mL),青霉素(100 units/mL)、胎牛血清(10%)等试剂的DMEM培养基培养。根据细胞生长状态达到培养瓶80%空间密度按照常规的细胞传代方法传代。
2.3 实验分组及药物处理
以密度1×106个/孔接种人乳腺癌细胞MDA-MB-231于6孔板中,分为对照组和处理组,每组设3个复孔,对照组3孔标记为对照1(CK1)、对照2(CK2)、对照3(CK3);处理组3孔标记为Treatment1、Treatment2、Treatment3。对照组用上述DMEM培养基培养,处理组用含乳积方药物的上述DMEM培养基培养,药物浓度为0.04 g/mL(IC50),于37 ℃、5% CO2条件下培养72 h。
2.4 RNA提取及质检
收集对照组和处理组MDA-MB-231细胞,使用Trizol提取总RNA,并用RNasey Mini Kit进行纯化,使用NanoDrop测定纯化后的RNA浓度。使用甲醛电泳试剂进行变性琼脂糖凝胶电泳,检测纯化后的RNA纯度和完整性。
2.5 miRNA芯片试验
使用miRCURYLNATM Array Power Labeling kit对miRNA进行标记,即用Hy3TM荧光基团标记miRNA。标记完成后,将标记好的样品与杂交缓冲液混合,95 ℃变性2 min,置于冰上2 min;再将上述混合物与芯片56 ℃下杂交16 h,杂交完成后,用清洗液清洗芯片。将芯片放入扫描仪中进行扫描,使用GenePix Pro 6.0读取芯片扫描图像,并提取探针的信号值。
2.6 芯片数据预处理及差异基因的筛选
通过芯片中位值对miRNA芯片原始信号值进行标准化。通过标准化的信号值计算出每个miRNA在不同样品间(即对照组和处理组)的表达变化(差异倍数foldchange),并通过t-test计算样品间miRNA表达量变化的统计学显著性。表达变化倍数在2倍以上,为差异化表达miRNA;表达倍数在2倍以上且P值<0.05的miRNA,为显著性差异表达的miRNA。此外,对不同样品组之间差异表达的miRNA进行图形化展示,即火山图分析。
2.7 miRNA靶基因预测及相关分析
通过汇总两大数据库(mirdbV5和TaregetScan7.1)的已知miRNA靶点信息,将两大数据库的结果交集作为最终miRNA的靶基因结果,以降低靶基因预测的假阳性率。此外,通过GO分析和pathway分析预测miRNA及其靶基因可能具有的生物学功能。
2.8 RT-PCR验证
首先将总RNA反转录成cDNA,然后将所有cDNA样品进行实时定量PCR反应,以U6为内参对照,具体实验步骤及引物序列如下,最后采用2-△△CT分析方法计算目的基因的表达差异。
2.8.1 将总RNA反转录成cDNA
①RNA模板加Poly A尾 Poly A尾的反应体系由300 ng总RNA模板,1 μL ATP(10 mmol),1 μL 10×A-Plus 反应缓冲液,0.5 μL A-Plus Poly(A) 聚合酶 (4 U/uL),0.2 μL RNA酶抑制剂(40 U/μL),加水至10 μL。反应条件:37 ℃孵育10 min后立即于-20 ℃保存20 min备用。
②制备RT引物混合液 将1 μL的oligo dT接头引物(0.5 μg/μL)和0.3 μL的U6(下游引物)(0.1 μmol/L)混匀,然后将RT引物混合液加入上述加Poly A尾反应体系中,轻轻吹打混匀后,5 000 r/min短暂离心,于60℃孵育5 min后冷却至室温放置3 min备用。
③制备RT混合反应液 将4 μL的dNTP(每一种均为2.5 mmol),2 μL的10×RT缓冲液,0.4 μL的MMLV反转录酶(10U/μL)和0.3 μL的RNA酶抑制剂(40U/μL)混匀,然后将RT混合反应液加入上述反应体系,总体积为20 μL,在PCR仪进行RT反应。反应条件37 ℃孵育60 min后,保存于-20 ℃备用。
2.8.2 实时定量PCR反应
实时定量PCR反应体系由5 μL的2×Master Mix,0.5 μL的10 μmol/L的PCR特异引物F,0.5 μL的10 μmol/L的PCR特异引物R,2 μL的cDNA加水至10 μL组成。
反应条件:95 ℃预变性10 min;变性95 ℃ 10 s,退火、延伸60 ℃ 60 s,重复40个循环。
扩增反应结束后,条件为95 ℃10 s,60℃ 60 s,95 ℃ 15 s;从60℃~99℃绘制熔解曲线。
2.8.3 引物序列信息
内参及目的基因的引物序列见表1、表2。
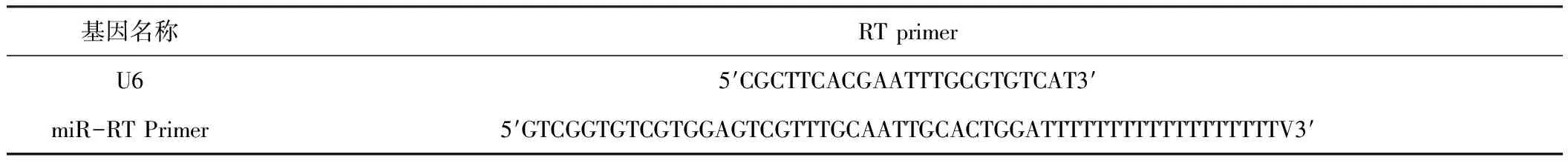
表1 cDNA合成涉及引物序列
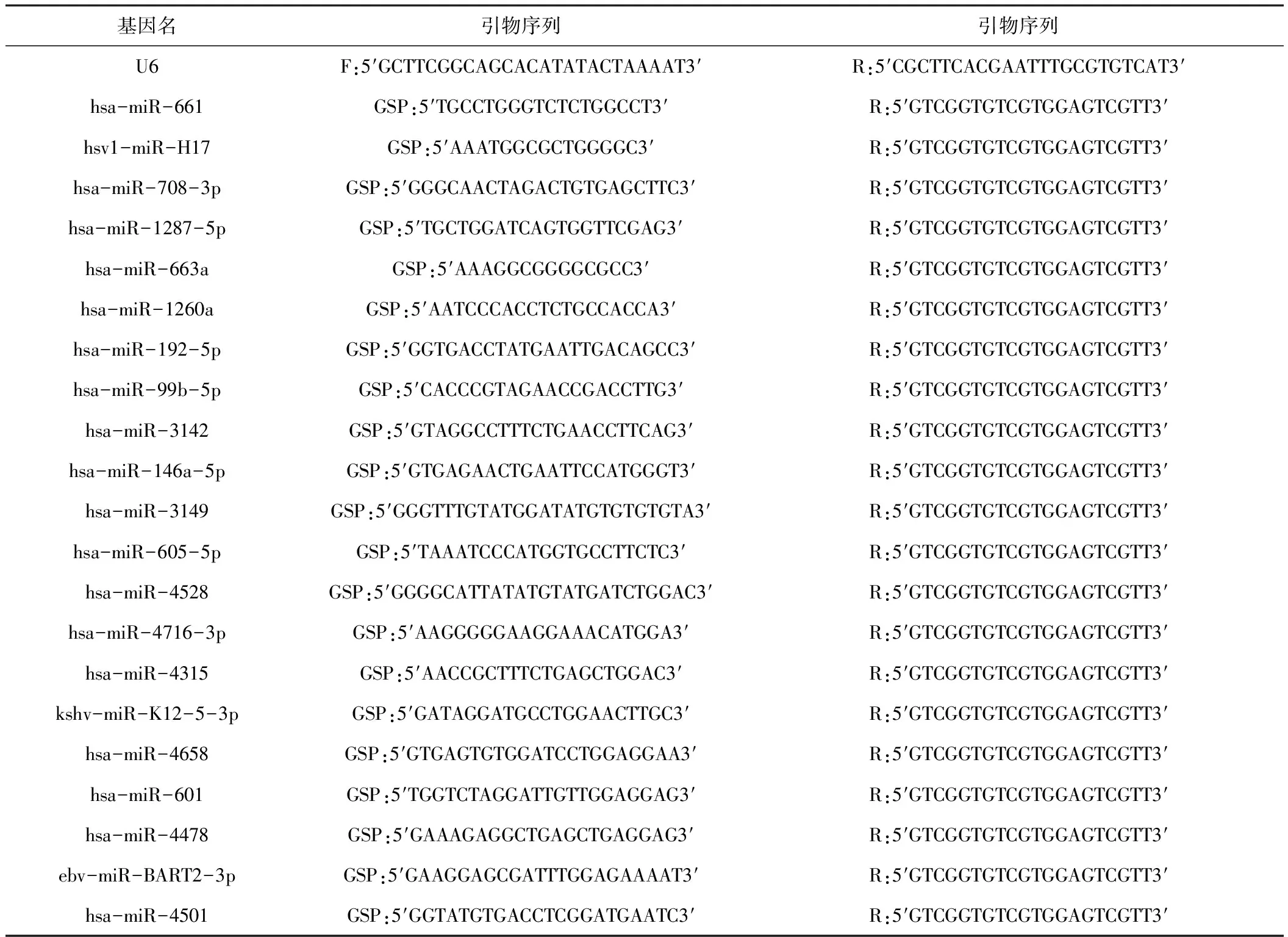
表2 实时定量PCR涉及引物序列
2.9 统计学分析
运用SPSS 17. 0统计软件进行数据统计。两组间比较采用配对t检验,P<0.05为差异有统计学意义。
3 结果
3.1 miRNA差异化分析
前期MTT结果显示,乳积方制剂对乳腺癌细胞和正常细胞均有抑制其生长的效果,其中对乳腺癌细胞MDA-MB-231效果更为明显;本次选择IC50值乳积方处理MDA-MB-231细胞,miRNA芯片表达图谱研究发现:乳积方诱导了hsa-miR-661、hsv1- miR-H17、hsa- miR-708-3p、hsa-miR-1287-5p、hsa-miR-663a、hsa-miR-4716-3p、hsa-miR-4315、hsa-miR-4658、hsa-miR-601等近百个差异上调或下调倍数大于2的miRNA;通过增加其挑选条件,最终25个显著差异化miRNA进行靶基因预测GO及Pathway结果显示,近1 000个基因与此25个miRNA相关,信号通路多涉及proteoglycans in cancer、pathways in cancer、pi3k-akt signaling pathway等;基因分布最广的pathways in cancer相关的信号通路近172个基因。挑选其中21个显著差异化的miRNA进行QPCR验证结果显示,除hsa-miR-601外其他20个显著差异化的miRNA变化趋势同基因芯片趋势相符合,更加证明了结果的可靠性。
采用基因芯片法研究药物作用下miRNA的差异化表达情况。
3.1.1 样本质量检测结果
NanoDrop ND-1000检测 OD260/280≈2.0,OD260/230>1.8,表明提取的RNA纯度高,杂质少;变性琼脂糖凝胶电泳进一步检测RNA的完整性,其中完整的RNA应出现3条带,其中28 s带的亮度应是18 s的两倍,结果说明制备的RNA样本是高纯度的、完整性强的合格样品,见图1。
3.1.2 差异基因聚类分析
采用Agilent人类全基因表达芯片检测两组样的差异表达基因,筛选两组间差异倍数(经log2转换)2倍以上的基因为差异表达基因,共筛选出219个差异表达基因,其中109个表达上调,110个表达下调,进一步增大筛选标准至2倍表达差异且ForeGround强,筛选出25个差异化基因,对这25个基因进行聚类分析,结果如图2所示,两组样本间基因表达差异大。
更进一步增大筛选标准至2倍表达差异且ForeGround强且P值≤0.05,筛选出10个显著差异化表达的基因,其中5个上调,5个下调,差异基因火山图见图3,具体数值见表3。
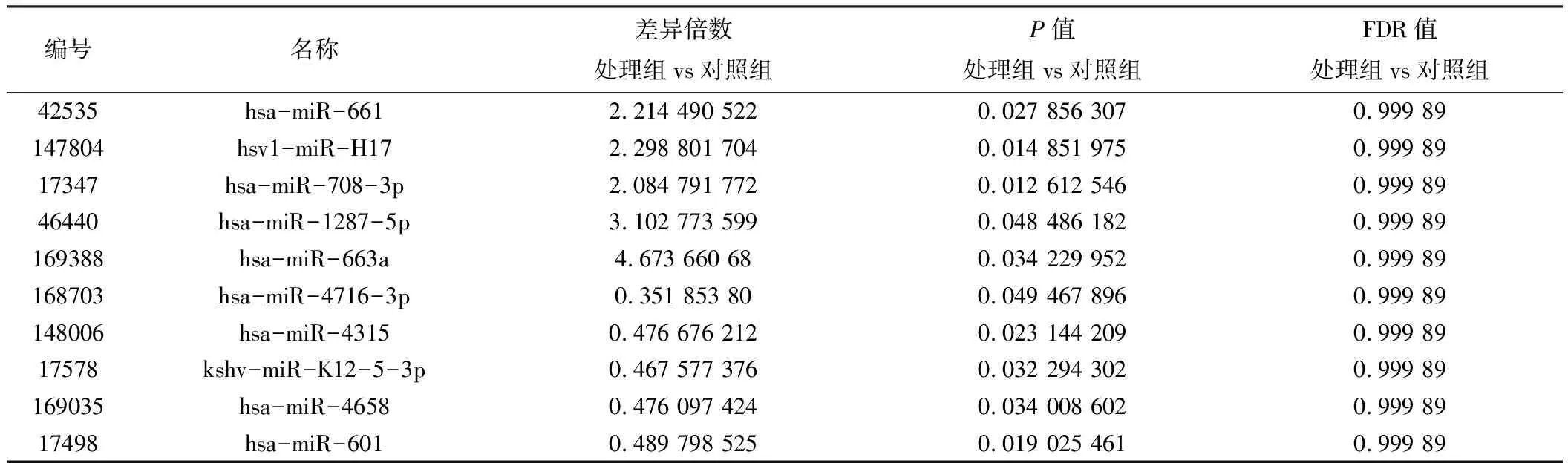
表3 两组差异基因的差异倍数、P值与FDR值
3.2 差异化miRNA的靶基因预测及GO Pathway分析
将筛选出来的差异化25个miRNA进行靶基因预测分析,选择同时出现在targetscan7.1数据库及mirdbv5数据库的基因为目标靶基因,有效降低了靶基因假阳性率。结果显示,共有1 044个基因,差异基因韦恩图见图4。
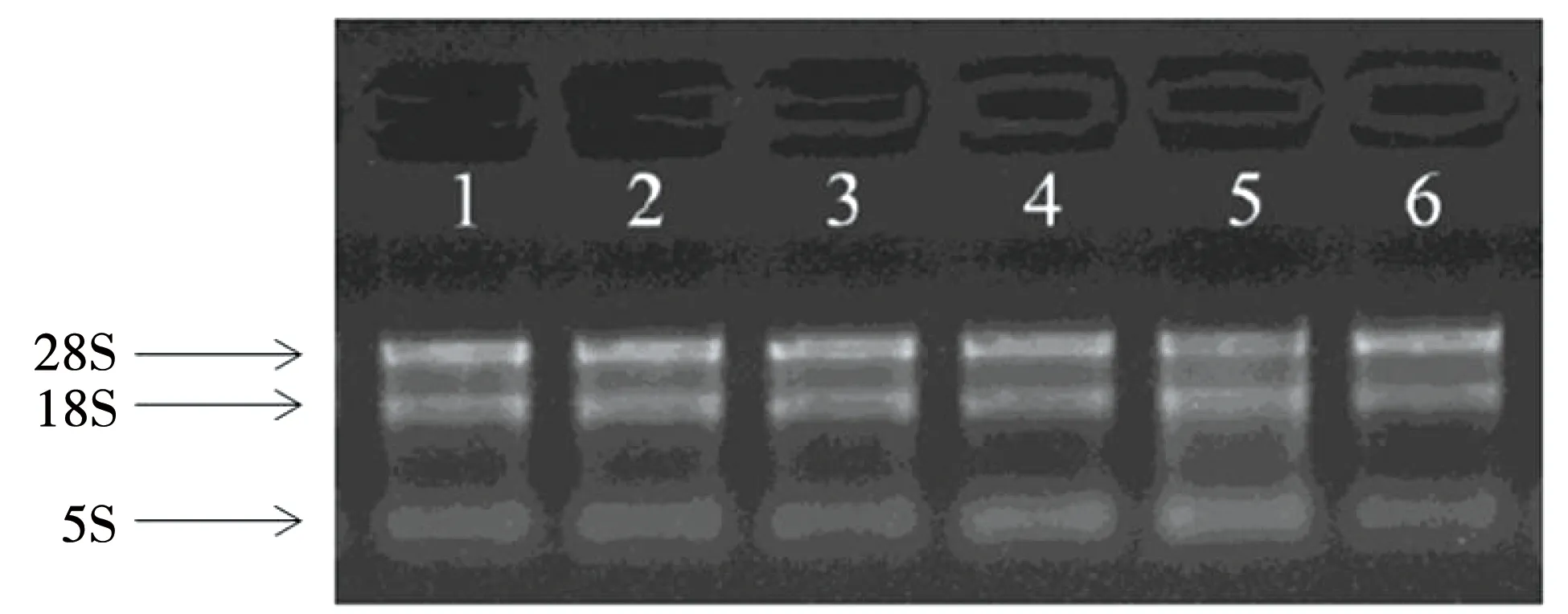
注:1.对照1(CK1)中的总RNA;2.对照2(CK2)中的总RNA;3.对照3(CK3)中的总RNA;4.处理组1(Treatment1)中的总RNA;5.处理组2(Treatment2)中的总RNA;6.处理组3(Treatment3)中的总RNA。图1 变性琼脂糖凝胶电泳图
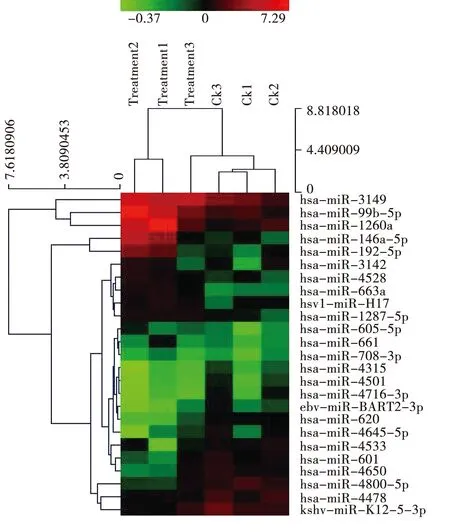
注:红色到绿色代表差异化基因在样本中的表达量从高到低。图2 两组样本差异化基因聚类分析图
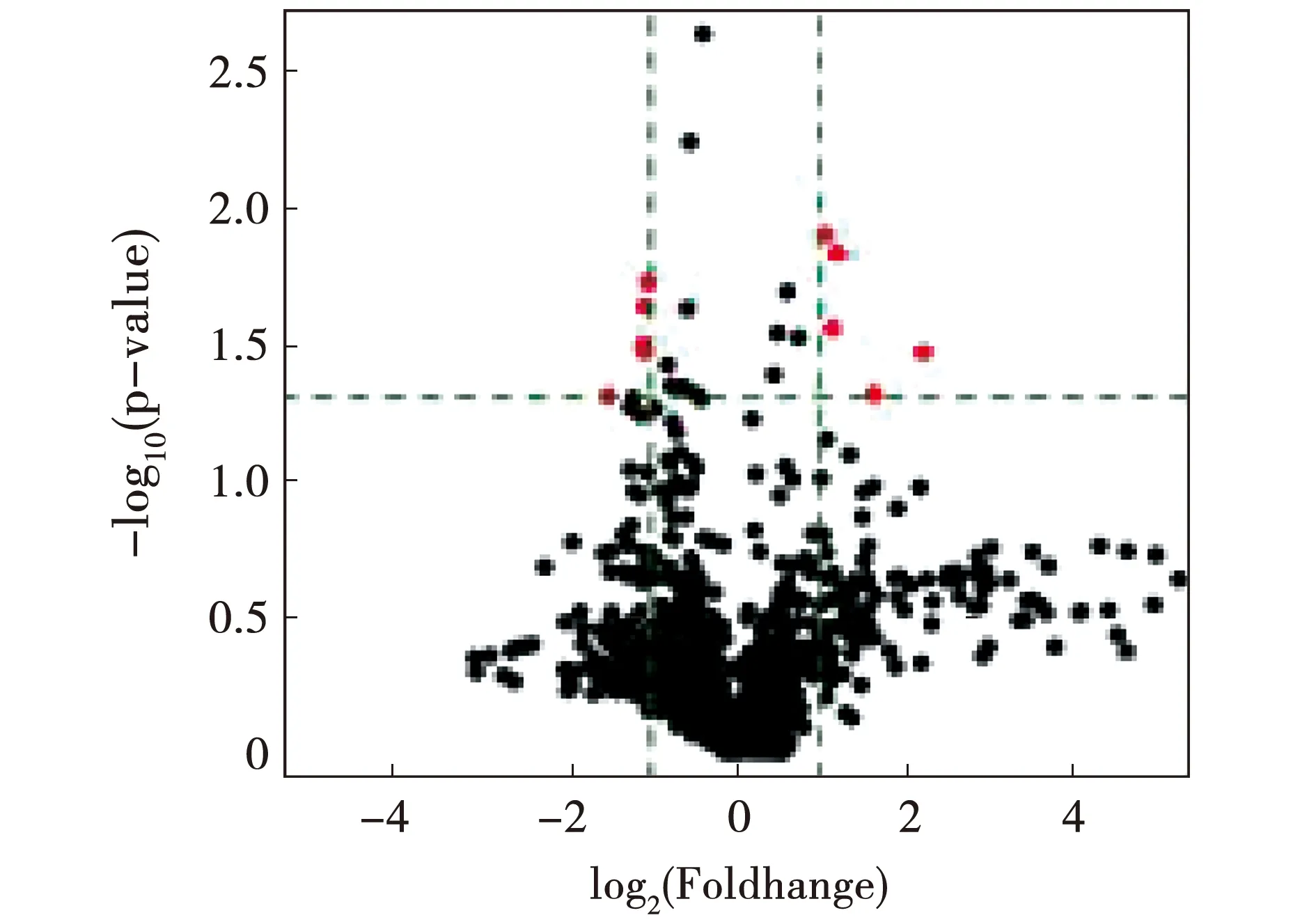
注:横轴代表处理组和对照组之间miRNA表达倍数的变化(log2转化),纵轴代表相应的P值(-log10转化)。纵向绿线分别对应2倍上调和下调,绿色平行线对应0.05的P值。红色区域为具有统计学显著性差异的miRNA。图3 差异基因火山图
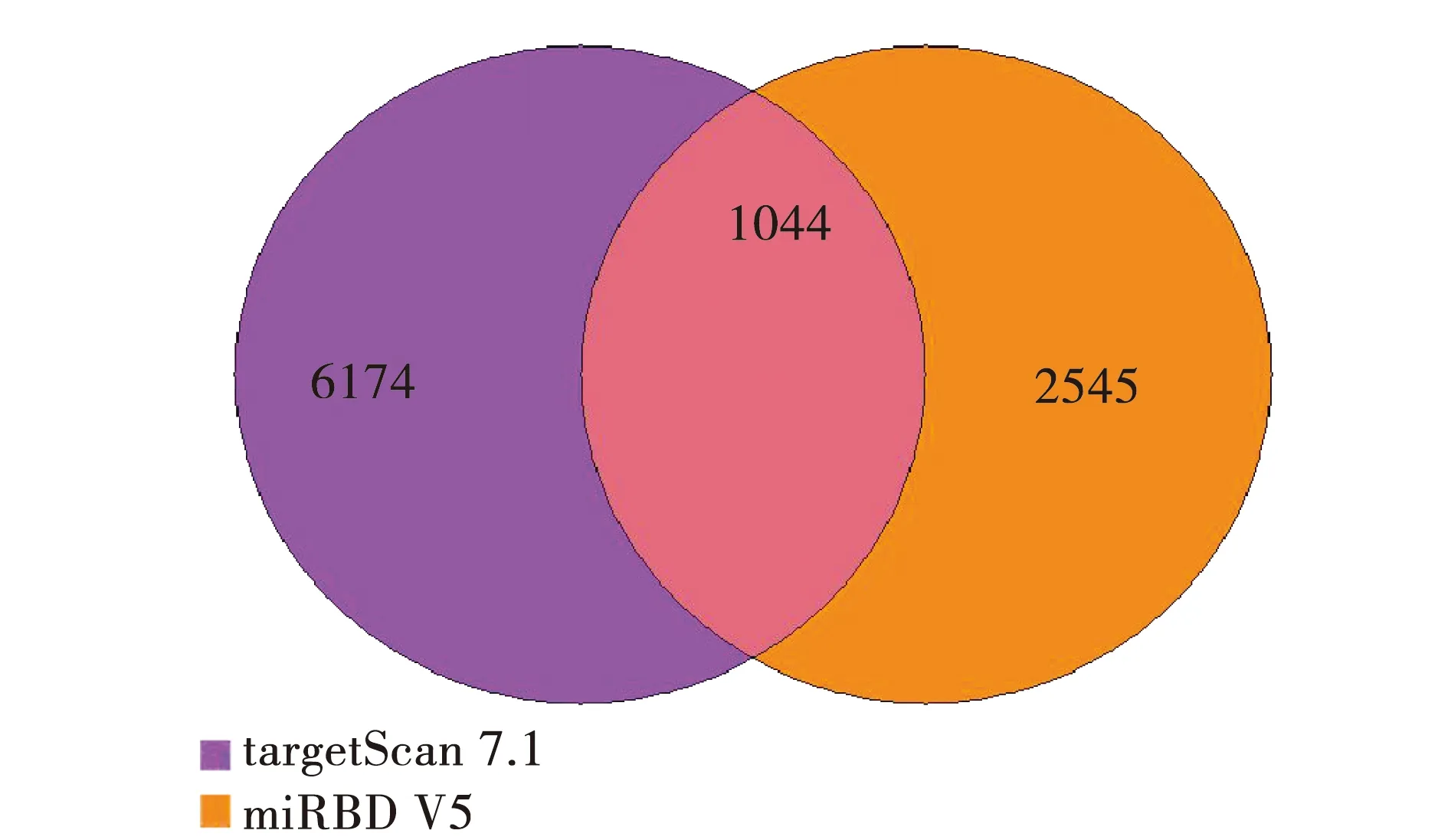
注:紫色表示targetscan7.1数据库预测的靶基因数目,橘色代表mirdbv5数据库预测的靶基因数目。图4 差异化miRNA的靶基因venn图
将筛选出来的25个差异基因进行GO功能分析,涉及生物过程1 000(Biological Process)个、细胞组分(cell component)180个、分子功能(molecular fuction)150个。GO富集分析中,P值<0.05的GO为显著性GO。
Pathway分析结果显示差异化基因主要涉及癌症中蛋白聚糖、癌症的信号通路、PI3K-Akt signaling pathway (human)、Ras signaling pathway、FoxO signaling pathway (human)、Endocytosis (human)等。部分结果如图5所示。
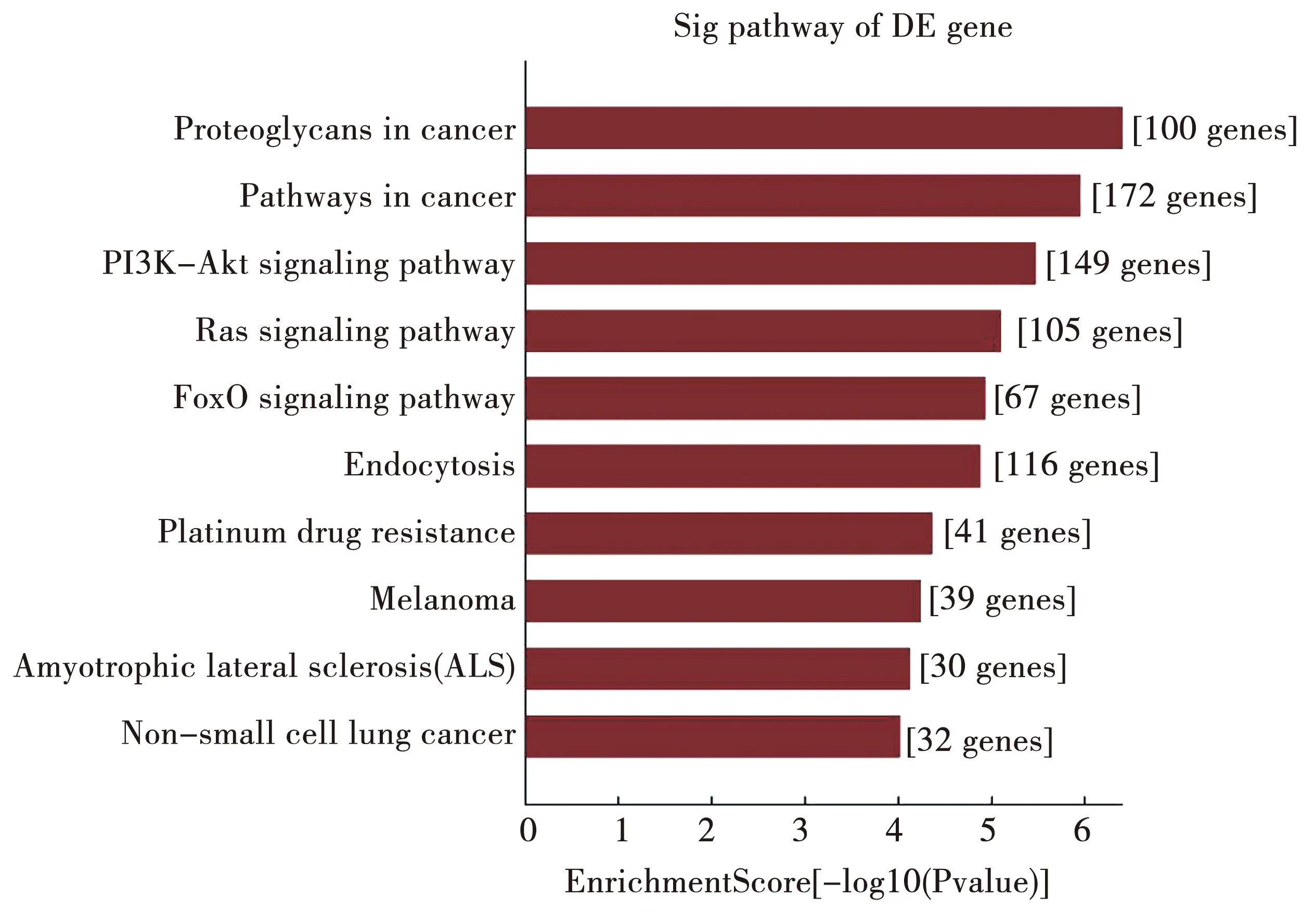
图5 部分Pathway的功能分析结果
3.3 实时荧光定量PCR验证miRNA芯片结果
从筛选出来的(25个)差异化表达基因中选择差异化倍数及ForeGround较高的21个基因进行验证。芯片结果显示,hsa-miR-661、hsv1-miR-H17、hsa-miR-708-3p、hsa-miR-1287-5p、hsa-miR-663a、hsa-miR-1260a、hsa-miR-192-5p、hsa-miR-99b-5p、hsa-miR-3142、hsa-miR-146a-5p、hsa-miR-3149、hsa-miR-605-5p、hsa-miR-4528基因表达上调;hsa-miR-4716-3p、hsa-miR-4315、kshv-miR-K12-5-3p、hsa-miR4658、hsa-miR-601、ebv-miR-BART2-3p、hsa-miR-4501基因表达为下调。荧光定量PCR结果显示,hsa-miR-661、hsv1-miR-H17、hsa-miR-708-3p、hsa-miR-1287-5p、hsa-miR-663a、hsa-miR-1260a、hsa-miR-192-5p、hsa-miR-99b-5p、hsa-miR-3142、hsa-miR-146a-5p、hsa-miR-3149、hsa-miR-605-5p、hsa-miR-4528基因在实验组的相对表达量高于对照组,hsa-miR-4716-3p、hsa-miR-4315、kshv-miR-K12-5-3p、hsa-miR4658、ebv-miR-BART2-3p、hsa-miR-4501在实验组的表达量低于对照组,除却hsa-miR-601基因外,其他结果均同基因芯片相吻合,见图6、图7。
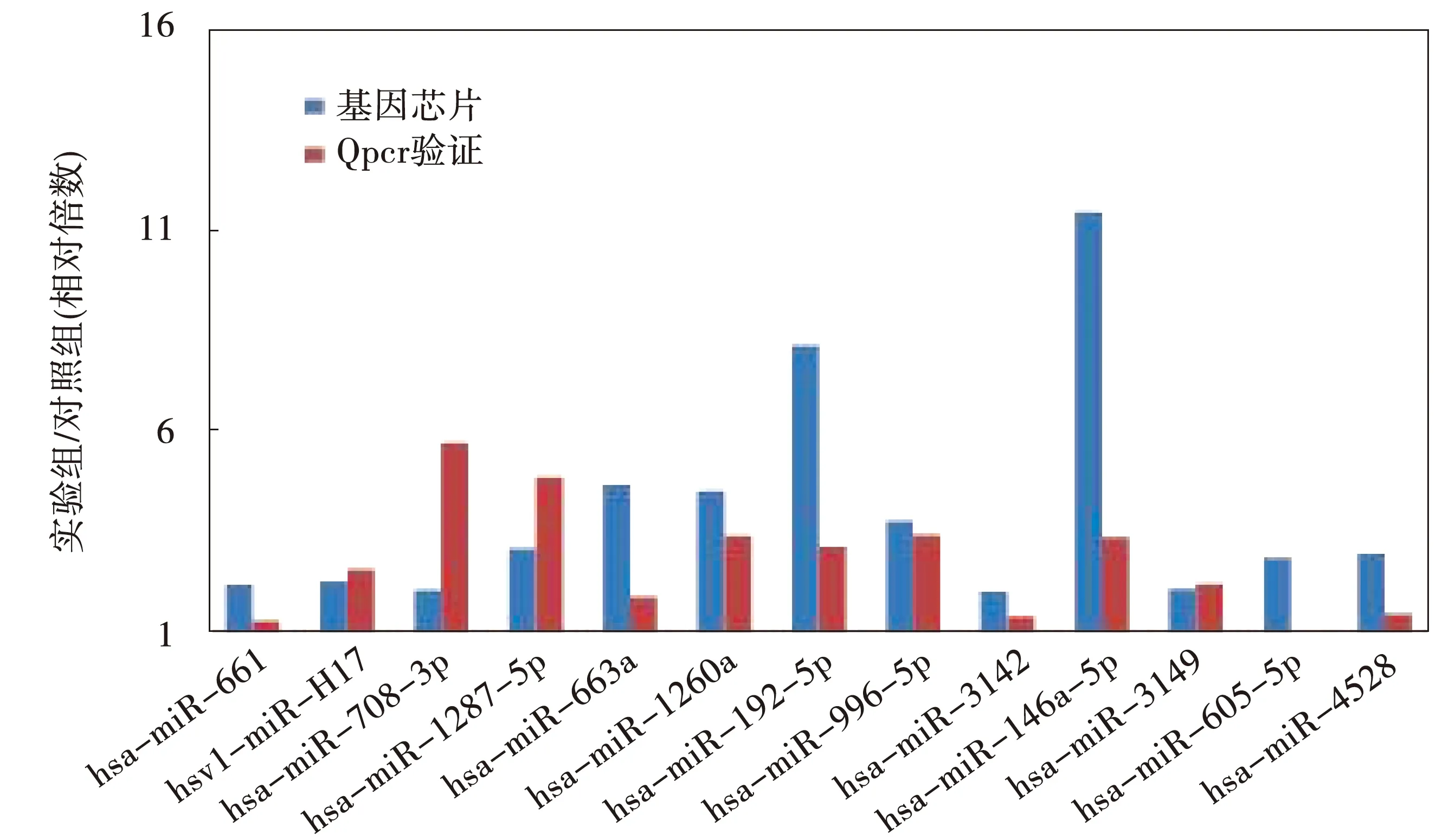
图6 基因芯片中基因表达上调的基因QPCR验证结果
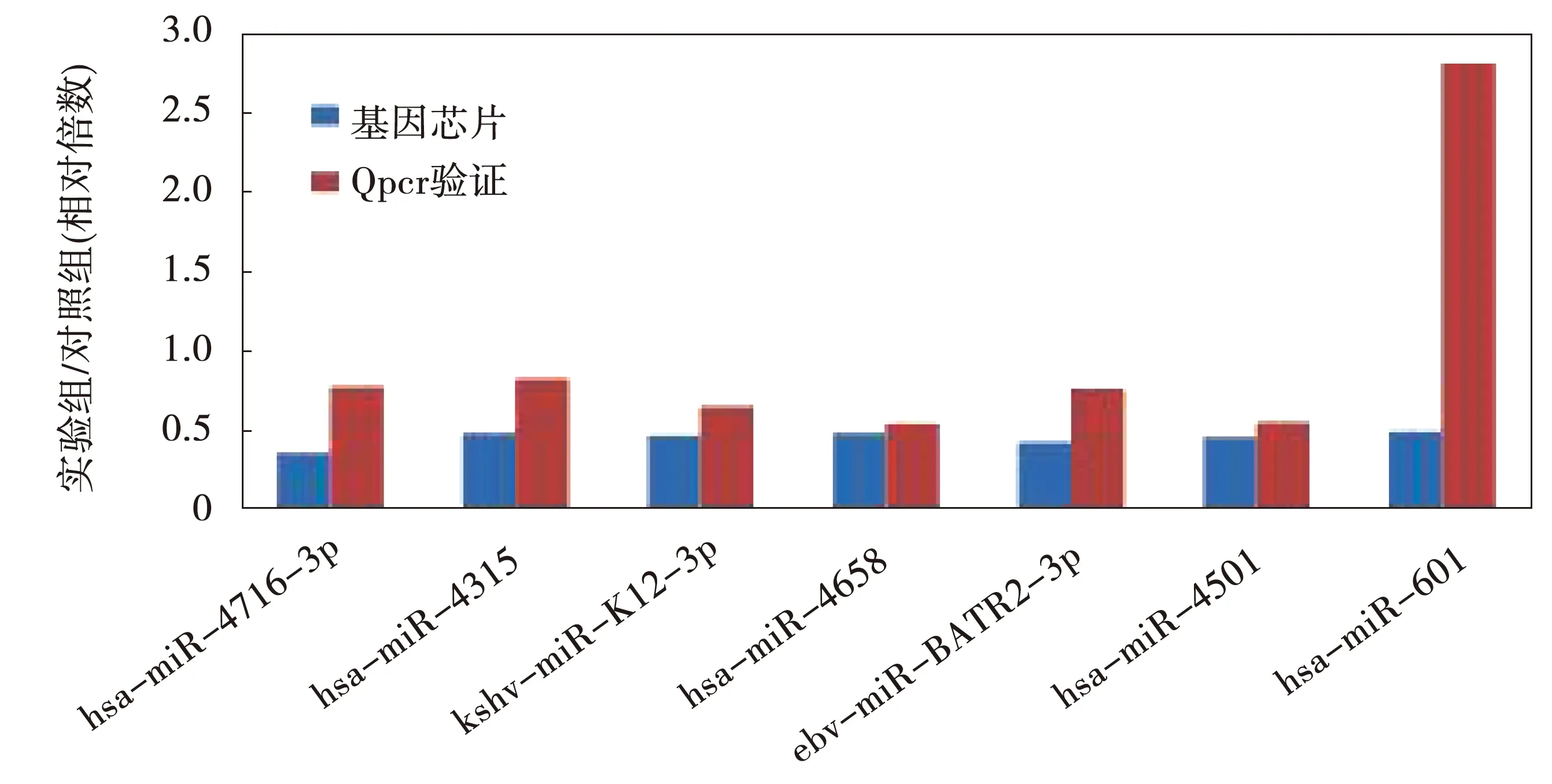
图7 基因芯片中基因表达下调的基因QPCR验证结果
4 讨论
微小RNA(microRNA,miRNA)是一类长度约22个核苷酸的单链非编码小分子RNA,广泛存在于真核生物中,主要通过与靶 mRNA3’非翻译区完全或部分互补结合,导致靶 mRNA 降解或转录后的翻译抑制,从而调控靶基因的表达[4]。研究发现[5-10],肿瘤细胞与正常组织来源的细胞间miRNA的表达谱具有明显差异,推测miRNA在肿瘤形成过程中可能扮演着重要的角色。有研究发现,乳腺癌抑癌miRNA,如miR-200家族、miR-7、miR-30a、miR-125(125a和125b)、let-7、miR-206、miR-31、miR-342、miR-335和miR-126等表达下调,而致癌miRNA,如miR103/107、miR-10b、miR-221/222和 miR-21等表达上调,提示miRNA的失调在乳腺癌中起着重要的作用[11]。WANG等[12]对乳腺癌 MCF-7肿瘤细胞及正常组织miR-205的表达情况进行了检测,发现其在乳腺细胞中表达下调,miR-205的高表达可以诱导乳腺癌细胞凋亡,发挥抑制肿瘤的作用。SHAO等[13]研究认为,高水平的血浆miR-200a和miR-210与转移性乳腺癌患者的化疗耐药性相关,可能是转移性乳腺癌患者化疗耐药性预测的有效生物标志物。
乳积方是作者根据多年临床经验结合乳腺癌多肝气郁滞、癌毒难除的病因病机而设,具有舒肝健脾,化痰散结,软坚消积之功效。本方由柴胡、白芍、党参、八月札、瓜蒌皮、浙贝母、穿山甲、海藻等组成。方中柴胡苦辛微寒,归肝胆经,具有舒肝理气、升举阳气功效,为君药;杭白芍苦酸,归肝脾经,养血柔肝,柴芍相合,疏肝柔肝、养血理气;党参甘平,补肺脾气,补血生津,扶助正气,方中大剂量党参意在辅助机体正气,加强祛除癌毒。上二者为臣药。八月札、瓜蒌皮,性味均为甘寒,分别具有舒肝理气和宽胸利气的作用,此二者进一步加强柴胡理气舒肝功效,又可活血止痛助杭芍柔肝缓急;浙贝母与穿山甲同有化痰散结作用,其中浙贝母苦寒,重在清热化痰、软坚散结,海藻苦咸寒,软坚散结,消痰,利水,穿山甲咸微寒,重在活血散瘀、软坚化痰,此三者重在化痰软坚,祛除痰瘀热毒。海藻苦、咸、寒,能够软坚、消痰、利水、退肿,山慈菇甘微辛,清热解毒,化痰散结,此二者皆有化痰散结作用,且皆可用于痰瘀日久化热化毒,因此,同为佐助药物。纵观全方,扶正与驱邪相结合,化痰散结与清热解毒相配,气血痰瘀同治。
现代研究显示[14-19],柴胡皂苷D作用于乳腺癌MDA-MB-231细胞后,能通过抑制细胞周期阻滞和促进凋亡抑制乳腺癌细胞的增殖,通过抑制上皮间充质转化(EMT)转化从而抑制乳腺癌细胞的远处转移,并呈时间及浓度依赖性;浙贝母有效成分贝母碱,具有抗肿瘤并能够逆转肿瘤耐药;穿山甲能够治疗乳腺疾病、瘰疬、肿瘤等疾病;党参含多种糖类、酚类、甾醇、挥发油、黄芩素葡萄糖甙、皂甙及微量生物碱,具有抗炎、免疫调节以及抗癌等多种生理活性,对化疗放疗引起的白细胞下降有提升作用;山慈菇水煎剂可以抑制MDA-MB-231细胞增殖,并可将细胞周期阻滞在G期,同时可以促进细胞凋亡,并有效抑制其迁移;海藻所含的海藻多糖直接作用于肿瘤细胞,能够激活人体免疫细胞,增强机体免疫功能,并诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖。
本课题前期研究[20-23]提示乳积方对化疗乳腺癌患者具有增效减毒及提高机体免疫功能的作用,治疗后未出现明显骨髓抑制、肿瘤相关抗原 CA153下降、反映细胞免疫功能的CD3+/HLA-DR+(活化 T 淋巴细胞) 等指标呈明显升高趋势。长期服用乳积方可以明显改善乳腺癌术后患者的无疾病生存时间及生活质量。
MDA-MB-231细胞是一种激素受体阴性的乳腺癌细胞株,研究发现[3],乳积方对乳腺癌MDA-MB-231细胞株的生长具有明显的抑制作用。为阐明乳积方抑制乳腺癌的机制,本文运用miRNA芯片检测乳积方作用后乳腺癌MDA-MB-231细胞中miRNA表达谱的改变特征。研究发现0.04 g/mL 乳积方药物作用MDA-MB-231细胞72 h,miRNA的表达谱存在219个差异表达的miRNA,其中109个表达上调,110个表达下调。进一步增加差异miRNA筛选条件(ForeGround强),miRNA的表达谱存在25个差异表达的miRNA,通过GO&Pathway分析这25个差异表达miRNA对乳腺癌细胞株MDA-MB-231生物学功能的影响,发现这25个miRNA 共靶向接近1000个基因,涉及生物过程1000个、细胞组分180个、分子功能150个。这些基因显著富集于PI3K-Akt通路、癌症通路、Ras通路、FoxO通路、Endocytosis通路等信号通路,涉及细胞增殖、凋亡和迁移等生物过程。实时定量RT-PCR结果表明21个miRNA中,除hsa-miR-601外,其余20个miRNA的RT-PCR验证结果与miRNA芯片检测结果一致,具体为hsa-miR-661、hsv1-miR-H17、hsa-miR-708-3p、hsa-miR-1287-5p、hsa-miR-663a、hsa-miR-1260a、hsa-miR-192-5p、hsa-miR-99b-5p、hsa-miR-3142、hsa-miR-146a-5p、hsa-miR-3149、hsa-miR-605-5p、hsa-miR-4528基因表达上调,hsa-miR-4716-3p、hsa-miR-4315、kshv-miR-K12-5-3p、hsa-miR4658、ebv-miR-BART2-3p、hsa-miR-4501基因表达下调。
乳积方之中药活性成分众多,miRNA可能参与了中药活性成分的抗肿瘤作用,从miRNA的角度探究乳积方对乳腺癌细胞的分子机制为中医治疗乳腺癌提供新的切入点。但是在众多的活性成分中,调节miRNA表达以致发挥抗肿瘤作用的完整通路及关键成分还未知,可能需要结合中药网络药理学、中药化学物质组、基因组、蛋白质组和代谢组等方法进一步展开研究。
