生物炭对紫色土中氟苯尼考吸附与迁移的影响
2022-06-22李嘉慧欧阳峰郑世界刘欣雨任帅帆
李嘉慧,欧阳峰,郑世界,刘欣雨,何 杨,任帅帆
西南交通大学地球科学与环境工程学院,四川 成都 611756
近年来,我国抗生素使用量逐年增加,抗生素污染问题受到广泛关注,其主要通过废水排放、动物粪便和污水污泥的土地施用以及再生水灌溉作物的方式进入土壤环境[1-2],而多数抗生素的生物降解性并不好[3]. 氟苯尼考(florfenicol,FFC)是一种氯霉素类抗生素,具有不易离子化且难吸附于土壤颗粒的特点[4],广泛应用于水产与畜禽养殖业,在我国兽用抗生素中其使用量处于较高水平,2013 年使用量高达10 000 t[3,5]. Zhang 等[5]研究表明,FFC 在我国黄河、海河、珠江等流域水体中均具有较高的检出浓度,但在土壤中残留浓度相对较低,在紫色土集中分布的嘉陵江流域FFC 在水体中的检出浓度约为254 ng/L,在土壤中的残留浓度约为0.37 ng/g. 上海市自来水中FFC 的检出浓度处于ng/L 级[6]. 可见,随粪污进入土壤的FFC 可通过淋失作用快速迁移出土壤,对地下水、地表水甚至饮用水造成威胁.
紫色土是我国西南地区重要的土壤资源,其抗侵蚀能力弱,土层浅薄,水土流失严重,土壤中养分、农药等污染物可快速流失[7];有机质含量(约<2%)低,对污染物的吸附性能差〔对磺胺类、氯霉素类抗生素的分配系数(Kd)为0.09~1.47 L/kg〕,加之大孔隙发育而引发优先流作用,会进一步促进弱吸附性污染物快速淋失出土体,严重威胁地下水安全[2].
生物炭具有比表面积大、孔隙高、含碳量高等特点,被广泛应用于环境和农业等领域[8-9]. 生物炭不仅广泛用作土壤改良剂,改善土壤孔隙结构,还可用作缓释肥料的载体制备炭基肥,有效提高肥料利用率[9].同时,作为一种高吸附的环保材料,生物炭既具备调控土壤水分的能力,也对土壤中污染物具有可观的吸附能力[10]. Mitchell 等[11]研究表明,多种生物炭能够高效吸附土壤中的FFC;同时针对紫色土的研究也表明,生物炭的添加可以提高其对FFC 的吸附效果(提高8~40 倍)[12]. 然而,土壤中反应性溶质运移不仅受到吸附作用的影响,还与水分运动有着密切联系[6].生物炭的田间施用也可通过水分控制影响抗生素运移,野外坡底生物炭可渗透反应墙的试验[6]表明,紫色土中FFC 的迁移主要受到土壤水分运移的强烈影响,且生物炭可渗透反应墙可通过水分控制影响FFC在土体中的迁移. 上述研究更多侧重于吸附能力或水分循环,相对缺乏生物炭对二者的耦合影响研究.
鉴于此,该研究通过批量平衡吸附试验与填装土柱淋溶试验,探究FFC 在生物炭改良土(biocharamended soil,BS)及对照紫色土(control soil,CS)中的吸附与淋溶特性,并运用两点化学非平衡模型(two-site model,TSM)反演FFC 迁移参数,探究生物炭阻控FFC 在紫色土中迁移的机制,以期为长江上游紫色土地区土壤抗生素污染防控提供参考.
1 材料与方法
1.1 仪器与试剂
氟苯尼考(纯度≥98%,罗恩试剂),分子式为C12H14Cl2FNO4S,相对分子质量为358.20,溶解度为1 320.00 mg/L,酸式解离常数(acidity coefficient,pKa)为9.00,辛醇-水分配系数(octanol-water partition coefficient,lgKOW)为—0.04. 供试生物炭(biochar,BC)为商品生物炭,于2015 年购自商丘市三利新能源有限公司,由农作物混合秸秆在500 ℃下无氧热解而成,经有机元素分析仪(Elementar Vario EL,Thermo Fisher,德国)测定生物炭中C、N、O 的质量分数分别为80.18%、1.53%、16.04%,pH(水土比为1 g∶2.5 mL)为10.20,BET 比表面积为10.04 m2/g,阳离子交换量(cation exchange capacity,CEC)为16.63 cmol/kg[12].CaCl2与KBr 为分析纯,乙腈为分析色谱纯,试验用水为超纯水.
通过分析天平秤(FA224,上海力辰仪器科技有限公司)对抗生素等化学药品与材料进行称量;采用往复式恒温振荡箱(SH2-A,上海助蓝仪器科技有限公司)进行批量平衡吸附试验;通过蠕动泵(BT-100F,保定兰格恒流泵有限公司)控制淋溶试验流速;采用程控自动收集器(CBS-A,上海青浦沪西仪器厂)对出流液进行收集;采用溴离子仪(Bante931,上海般特仪器制造有限公司)对水分示踪剂溴离子浓度进行定量检测;采用电导率仪(DDS-307A,上海仪电科学仪器股份有限公司)对溶液电导率进行检测;采用精密台式酸度计(PH3-3E,上海仪电科学仪器股份有限公司)对酸碱度进行定量检测;采用配有Eclipse plus C18 色谱柱(4.6 mm×150 mm)的高效液相色谱仪HPLC(LC-2030 Plus,岛津公司,日本)对批量平衡吸附试验中液相及填装土柱淋溶试验出流液中FFC 浓度进行定量检测.
1.2 供试土壤
供试土壤采自四川省绵阳市盐亭县(105°28′E、31°16′N). 2015 年5 月,将质量分数为1%的供试生物炭混施于紫色土坡耕地小区(20 m×5 m,坡度5°)耕作层(0~20 cm),经历1 年玉米-小麦轮作后(2016年5 月),分别在每个小区采集坡上、坡中与坡底耕作层三点混合土样,于阴凉处自然风干后过2 mm 筛,密封保存. 两种土样的基本理化性质如表1 所示.
1.3 批量平衡吸附试验
准确称取1.00 g 供试土壤于50 mL 离心管中,分别加入FFC 初始浓度为0、0.2、0.5、1.0、2.0 和5.0 mg/L 的1 mL 0.01 mol/L CaCl2溶液(含抑制微生物的1.0 g/L NaN3),每个浓度设置3 个平行. 在25 ℃避光恒温条件下,以180 r/min 振荡24 h 后取出,4 000 r/min 下离心10 min,取上清液待测.
1.4 填装土柱淋溶试验
按照图1 所示装置开展湿法填柱,向层析柱(Φ4.8 cm×30 cm)中填装2 cm 石英砂后,添加超纯水使液面超过石英砂0.5 cm,通过药匙将土样向层析柱中均匀填装0.5 cm 高度后压实,当土壤中水分达到饱和状态时,再次添加超纯水使液面超过土壤0.5 cm,重复以上操作直至填装饱和土壤高度达15 cm,并填装2 cm 石英砂,固定密封层析柱. 对照土柱(control soil column, CSC)与生物炭改良土柱(biocharamended soil column,BSC)基本性质见表2,其中,水分特征曲线参数采用Hydrus-1D 中人工神经网络模块通过表1 中机械组成予以模拟求得.

表 1 供试土壤理化性质Table 1 Physicochemical properties of soil samples
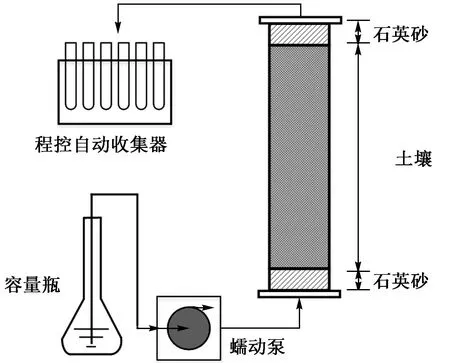
图 1 土柱试验装置示意Fig.1 Schematic diagram of the soil column experiments
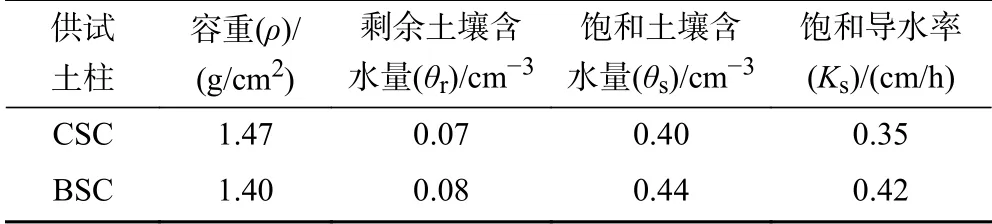
表 2 供试土柱基本性质Table 2 Basic properties of the tested soil columns
试验开始前,首先通过蠕动泵以400 μL/min 的流速自下而上向层析柱中缓慢注入超纯水,充分饱和土壤并去除空气,直到系统形成稳定流场;然后改为注入含50 mg/L KBr 和1 mg/L FFC 的溶液,出流端使用程控自动收集器设置每0.5 h 自动收集一次,持续淋洗4 个孔隙体积(pore volume,PV)后,更换注入溶液为超纯水,淋洗至无法检出Br—为止.
1.5 分析检测方法
填装土柱淋溶试验出流液通过0.45 μm 聚醚砜水系滤膜过滤后,分别采用溴离子仪、电导率仪、台式酸度仪对Br—浓度、电导率及pH 进行检测.
批量平衡吸附试验上清液与填装土柱淋溶试验出流液通过0.22 μm 聚醚砜水系滤膜过滤后,采用HPLC 对FFC 进行检测,流动相比例为V乙腈∶V水=25∶75,进样量为20 μL,流速为1 mL/min,柱温为30 ℃,紫外波长为224 nm,FFC 保留时间为9.5 min;标准曲线浓度范围为0.01~10 mg/L (R2=0.999),检出限为0.01 mg/L.
1.6 模型构建与数据处理
所有吸附数据采用Origin 2021 软件进行拟合,对流弥散方程与两点化学非平衡模型采用Hydrus-1D进行参数反演,所有图件采用Origin 2021 软件绘制.
1.6.1 等温吸附方程
分别使用Linear 线性模型和Freundlich 等温吸附模型对FFC 的等温吸附线进行拟合[12]:
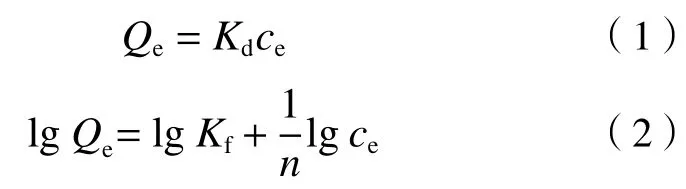
式中:Qe为固体表面的目标物吸附容量,mg/kg;Kd为吸附质在固液两相中的分配系数,L/kg;ce为平衡溶液中目标物浓度,mg/L;Kf为吸附容量常数,mg1—n·Ln/kg;n为吸附亲和力值.
1.6.2 对流弥散方程(convection-dispersion equation,CDE)
水分示踪剂Br—的迁移行为采用CDE 方程进行参数反演[13]:

式中:c为溶质浓度,mg/L;t为时间,h;D为水动力弥散系数,cm2/h;r为阻滞因子;x为距离,cm;v为平均孔隙水速度,cm/h;ρ为土壤干容重,g/cm3;θv为体积含水率,cm3/cm3.
1.6.3 两点化学非平衡模型(two-site model,TSM)
非平衡包括与运移相关的非平衡和与吸附相关的非平衡,分别称为物理非平衡和化学非平衡,有些化学物质在土壤中不发生化学反应,但可被土壤固体颗粒吸附,属于化学非平衡. 对于稳定流态,吸附过程比较简单的溶质的等温吸附可以利用线性等温吸附进行描述,其运移的方程式[14]如下:
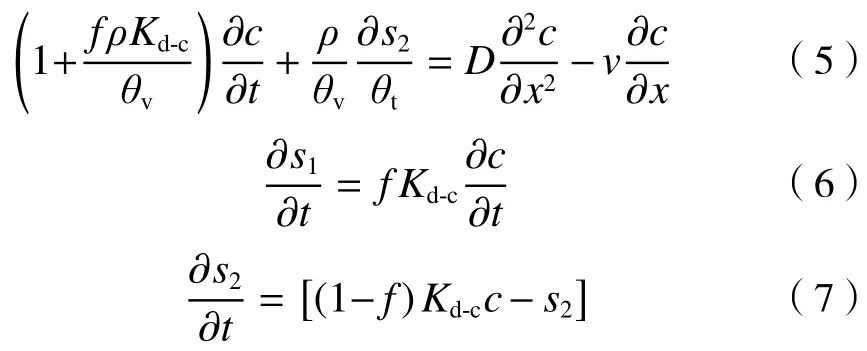
式中:f为平衡时发生瞬时吸附交换所占分数;s1为瞬时吸附点的吸附浓度,mg/kg;s2为动力学吸附点的吸附浓度,mg/kg;α为一阶动力学速率系数,h—1;Kd-c为两点化学非平衡模型中瞬时吸附常数,L/kg.
采用相关系数(coefficient of determination,R2)及均方根误差(root mean square error,RMSE)作为模拟值与观测值吻合度的判定指标,R2越趋近于1,说明模型拟合程度越好,RMSE 越小,说明误差越小. 采用纳什效率系数(Nash-Sutcliffe efficiency coefficient,NSE)分析供试土柱中惰性溶质迁移行为的差异,NSE 越趋近于1,说明可信度高,差异越小.
2 结果与讨论
2.1 供试土壤对氟苯尼考的吸附特征
供试土壤对FFC 的吸附常数如表3 所示,整体上Freundlich 等温吸附模型拟合结果优于Linear 线性模型,说明CS 和BS 对FFC 的吸附主要是多层非均相吸附[8]. 在Linear 线性模型中,生物炭的添加导致CS 中分配系数(Kd)由(0.89±0.06) L/kg 提至(11.26±0.28) L/kg,约提高了11.65 倍;在Freundlich等温吸附模型中,吸附容量常数(Kf)提高了9.69 倍.随着生物炭的添加,FFC 吸附等温线的非线性(1/n)显著增加,但CS 的吸附过程更加接近线性吸附(1/n=0.99±0.07),说明CS 对FFC 的吸附过程更接近于疏水分配作用. 相比于水土比为1∶10 的同类研究,FFC 在更高的水土比(1∶1)条件下更易与CS 和BS发生相互作用,分配系数(Kd)分别提高了7.70、8.45 倍[12].
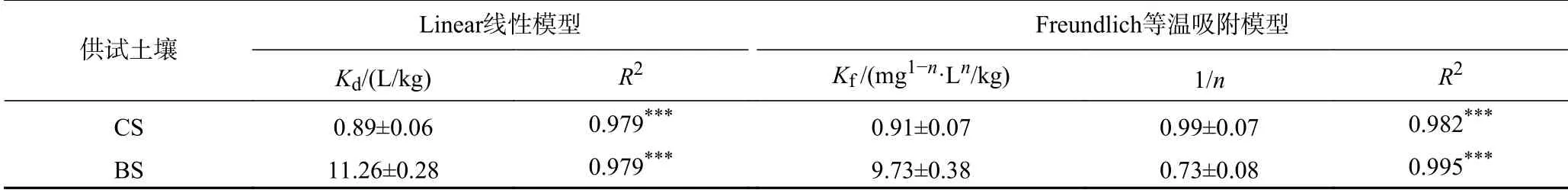
表 3 供试土壤中的Linear 线性模型与Freundlich 等温吸附模型参数Table 3 Parameters of the fitted Linear and Freundlich adsorption models in tested soils
紫色土中生物炭的添加导致吸附机制变得更加复杂. 首先,生物炭的施用直接引入了高效能吸附剂,生物炭对有机污染物的平衡吸附能力是普通土壤的400~2 500 倍[9],生物炭的添加直接提高了土壤有机碳比例,BS 中有机碳含量较CS 提高了1.06 倍,作为土壤中重要的吸附剂,有机碳含量与四环素、氟喹诺酮类抗生素等的吸附量均与吸附能力呈显著正相关[15-16];其次,BS 的比表面积是CS 的1.10 倍,生物炭表面存在的疏松多孔结构可能为FFC 提供了更易吸附的点位[17];最后,当生物炭与紫色土混合后,由于生物炭的强碱性(pH=10.20),施入生物炭的紫色土水溶液pH 显著提高(P<0.05),从而改变了吸附环境. 更重要的是,由于FFC 的pKa=9.0,在紫色土中离子化程度相当微弱,仅有1.2%呈现离子态,而在生物炭表面碱性物质进入土壤溶液后,其碱性增强,并且生物炭表面形成的碱性水膜将进一步增强分子解离,从而促进离子交换与静电吸引作用的发生[18].
2.2 氟苯尼考在供试土壤中的迁移行为
如图2 所示,CSC 与BSC 出流液pH 的范围分别为7.8~8.1 与7.4~8.0,均为弱碱性;EC 的范围分别为121~178 与113~337 μS/cm,生物炭表面大量的阴阳离子释放导致其EC 的波动显著高于CSC,供试土柱的EC 变化趋势均与水分示踪剂(Br—)和FFC 的穿透曲线(break though curves,BTCs)具有较高相似性(见图3). Br—在CSC 中的穿透发生在1.0~2.1 PV,在BSC 中则发生在1.3~1.8 PV,当Br—相对浓度C/C0=0.5时,所用孔隙体积分别为1.3 与1.5 PV,均大于1 PV.虽然Br—在BSC 中的穿透时间较CSC 明显降低,但并未对水分运动过程造成显著影响,仍均以基质流为主. 然而,FFC 在CSC 与BSC 中的穿透则比Br—分别迟0.1 与0.7 PV,并且在BSC 中出现拖尾现象,说明生物炭强大的吸附能力对其迁移造成了影响,这与已有研究结果[7]一致. 根据质量守恒定律,FFC 在CSC与BSC 中的回收率分别为96.57%和95.20%,这与大多数高迁移性的磺胺类抗生素迁移行为类似[13,19].生物炭的施加对FFC 的滞留率提高了38%,表明生物炭对FFC 的迁移起到了一定阻控作用,但与平衡吸附能力提高约10 倍的幅度相比,生物炭在迁移过程中表现出的吸附能力远低于平衡吸附过程,这是因为在填装土柱淋溶试验中水土接触时间较吸附平衡试验中明显减少,无法达到吸附平衡,污染物分子与土壤颗粒的吸附是受到速率限制(依赖于时间)的土壤水分运动引发的动力学吸附过程[20].
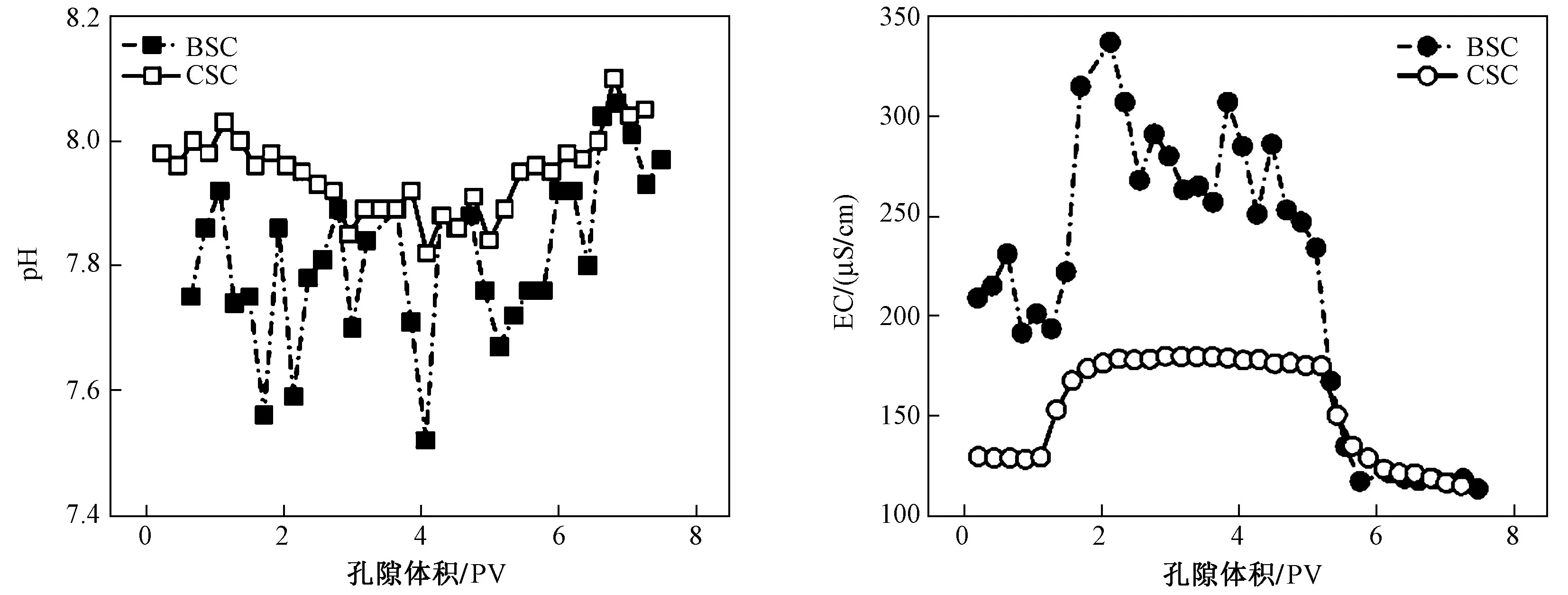
图 2 生物炭改良土柱与对照土柱流出液的pH 与ECFig.2 Effluent pH and EC from BSC and CSC
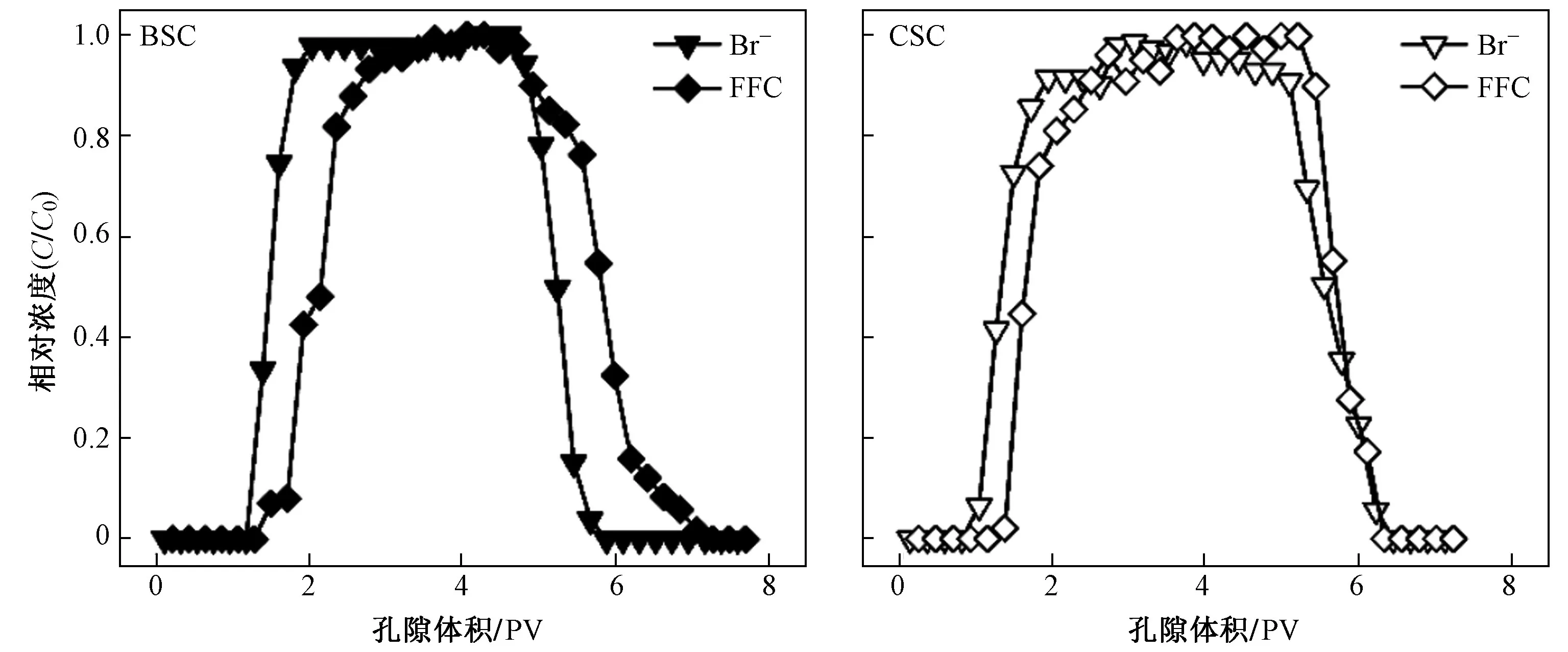
图 3 Br—与FFC 在生物炭改良土柱与对照土柱中的穿透曲线Fig.3 BTCs of Br— and FFC in BSC and CSC
2.3 生物炭对供试土壤中水分运移的影响
Br—作为惰性示踪剂,土壤对它的吸附作用可忽略不计(Kd=0),并且其在水中的分子扩散作用极小(分子扩散系数为1×10—9~2×10—9m2/s),因此认为水动力弥散系数(D)为机械弥散系数,得到式(4)中迟滞系数r=1,运用Hydrus-1D 软件中CDE 模型反演供试土柱中Br—的穿透曲线以获得弥散度(λ)和弥散系数(D)(见表4),其中,R2均大于0.95,RMSE 均小于0.1,证明反演结果是可以接受的[21]. BSC 与CSC 中Br—相对浓度的实际观测值及拟合穿透曲线结果见图4.
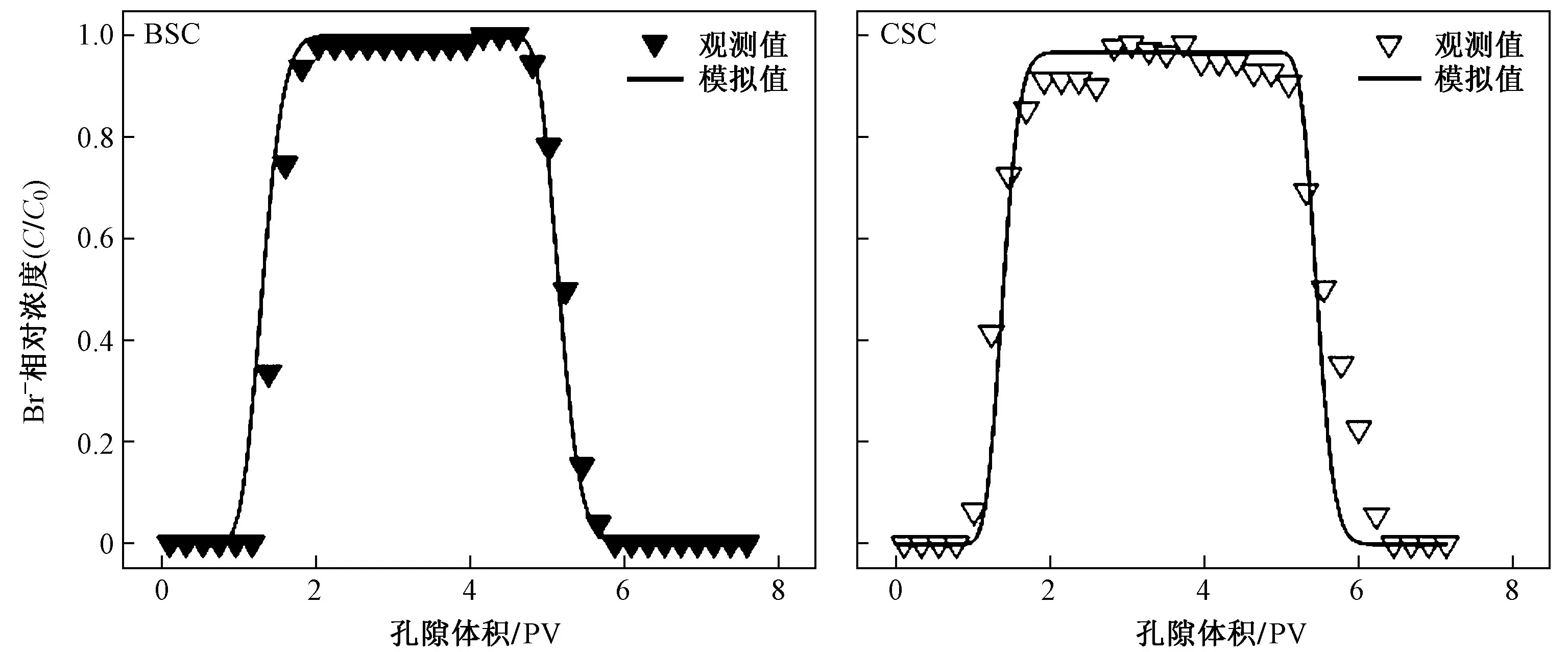
图 4 生物炭改良土柱与对照土柱出流液Br-的相对浓度实测值与模拟值Fig.4 Relative concentrations of Br- in the effluent of BSC and CSC
表 4 Br—穿透曲线反演的土壤水力学参数Table 4 Hydraulic parameters inversed based on BTCs of Br— in the tested soil columns
由于结构性孔隙的存在,填装土柱中弥散系数远低于原状土柱[22-23],例如,在大孔隙存在的条件下,紫色土耕地原状土柱中弥散系数甚至高达12.64 cm2/h[24].Razzaghi 等[25]通过对82 篇生物炭对水分影响的文献进行Meta 分析,表明生物炭施用后,土壤孔隙增多,容重降低,含水率增加,水分运移加快. 王红兰等[26]在紫色土中施用1%生物炭后发现,生物炭小区表层与亚表层土壤饱和导水率(Ks)分别提高了45%和35%. 然而,不同于上述研究,Lei 等[24]以生物炭施加比例分别为0、1%和2%的紫色土为研究对象,通过原状土柱淋溶试验获取示踪剂Br—穿透曲线,并运用STANMOD 软件对穿透曲线进行两区物理非平衡模型拟合,结果发现,生物炭在原状土柱中降低了弥散系数,并随着施用比例的提高,弥散系数的降幅逐渐增大. 这种差异可能是由于生物炭对土壤中水分运移的影响与多种因素相关,如土壤性质、耕作方式、采样尺度、生物炭施用方式及试验条件等[25].
为了消除孔隙水渗流速度的影响,弥散度(λ)可更好地衡量BSC 与CSC 之间的差异. BSC 的弥散度明显高于CSC,这与黄绵土和风砂土施加生物炭后的弥散度变化相似[27]. 弥散度的差异来自土壤的质地与结构,在质地较粗和均质土壤中的弥散度要小于质地较好和非均质土壤[21]. 生物炭的施加增强了土壤的非均质性,从而提高了弥散度. 然而,弥散度的差异对紫色土惰性溶质迁移的影响却并不显著(P>0.05),并且NSE=0.93,这说明两土柱Br—的穿透曲线较为相似,以上均说明生物炭对填装土柱水分运动的促进并不显著. 而在原状紫色土土柱中,弥散度(4.74~18.59 cm)明显高于填装土柱,这可能是由于原状土柱中优先流引起的[24],一般来说,弥散度在室内土柱试验中为0.01~1 cm,而在原状土柱和野外小区试验中则较高,为0.1~10 m[28].
2.4 生物炭对氟苯尼考在供试土柱中迁移的影响
基于表4 所示水分运移参数,采用式(5)~(7)反演FFC 在BSC 与CSC 中的迁移参数(见表5),并绘制穿透曲线(见图5). 与已有研究结果[4,23,29]相似,两点化学非平衡模型可较为准确地刻画FFC 在供试土柱中的迁移行为(R2>0.99,RMSE≤0.05). 由表5 可见,FFC 在供试土柱中的瞬时吸附常数(Kd-c)仅为0.07~0.17 L/kg,明显小于其在粉质壤土中的瞬时吸附常数(Kd-c)[4],也同样低于其他药物在填装土柱中的瞬时吸附常数(Kd-c),例如,奥美普林和磺胺二甲氧基嘧啶在美国东南部代表性土壤(10 cm)中的瞬时吸附常数(Kd-c)为3.32~40.44 L/kg[14],但在稻油轮作和菜地紫色土中,3,5,6-三氯-2-吡啶醇(3,5,6-trichloro-2-pyridinol,TCP)的分配系数(Kd)也仅为1.22 和1.02 L/kg[24],且施用不同质量分数(0.5%~5%)的生物炭后,农业紫色土对TCP 的分配系数(Kd)仍不超过2.09 L/kg[30]. 这说明污染物在土壤中的迁移也受到土壤与污染物性质的影响,虽然施用生物炭可提高土壤对FFC 的吸附能力,但FFC 在供试土壤中仍具有较强的迁移性.
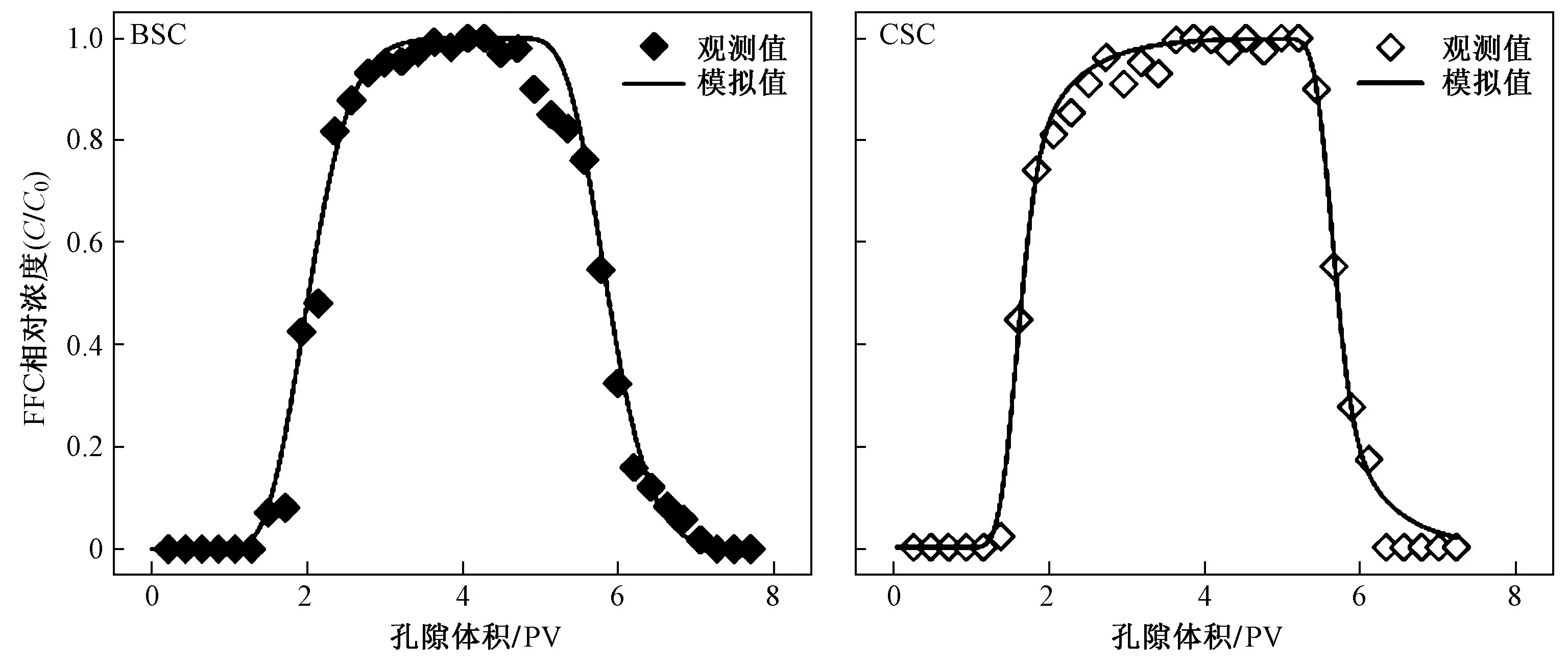
图 5 生物炭改良土柱与对照土柱出流液FFC 的相对浓度实测值与模拟值Fig.5 Relative concentrations of FFC in the effluent of BSC and CSC

表 5 FFC 在供试土柱中的两点化学非平衡模型迁移参数Table 5 Transport parameters of FFC fitted by TSM in the tested soil columns
在填装土柱淋溶试验中,生物炭的施加提升了瞬时吸附常数(Kd-c),并使得土柱中发生瞬时吸附交换所占分数(f)从0.54 升至0.68,但均小于1,这说明FFC 在供试土柱中的迁移过程整体上受到吸附速率的限制[14],并且施加生物炭后FFC 与土壤颗粒的结合更加倾向于瞬时吸附过程(快速吸附-解吸). 这与外源溶解性有机质(dissolved organic matters,DOMs)对FFC 迁移的影响具有一定相似性,在模拟雨水中添加牛粪DOMs 后,其较FFC 更易与土壤颗粒结合,通过竞争吸附与尺寸排阻,而非胶体辅助迁移,将更多吸附点位转化为快速吸附-解吸点位,加速了FFC迁移,在模型参数上表现为发生瞬时吸附交换所占分数(f)提高. 但与外源牛粪DOMs 降低了一阶动力学速率系数(α)不同,生物炭施用促使一阶动力学速率系数(α)从0.45 h—1升至1.56 h—1,增加了247%. 虽然紫色土施用生物炭会加速土壤有机碳的溶出[10],溶出的有机质可能通过上述机制引起瞬时吸附交换所占分数(f)的增加,但仅添加1%的生物炭就能将一阶动力学速率系数(α)提高,并且有效提高了FFC 滞留率,这都说明强吸附性生物炭为FFC 提供了更多的吸附点位是吸附点位类型转变的关键. 因此,生物炭的施用不仅提高了对FFC 的动力学吸附能力,也同时提供了更多的瞬时吸附点位,从而强化了其对FFC 迁移的阻控能力. 但值得注意的是,在土柱淋溶试验中,瞬时吸附常数(Kd-c)却均远低于批量平衡试验中获得的分配系数(Kd)和吸附容量常数(Kf)[20,23,29].这种现象与磺胺类抗生素在土壤中的迁移行为相似[22],可归因于,在恒温振荡下的批量平衡吸附试验中土壤有机质等与FFC 的接触时间更长且更均匀,为吸附过程的发生提供了更好的条件[13].
另外,紫色土中生物炭施用不仅带来了吸附性能的改变,也不可逆地改变了水分运动与污染物弥散过程. 虽然生物炭对填装土柱中弥散作用的影响有限,但在原状土柱中,施用质量分数为1%~5%的生物炭有效降低了TCP 的弥散系数(D),阻控了其在紫色土中的迁移行为[30]. 在田间,紫色土坡耕地坡底生物炭墙也可通过水分控制影响低浓度(<2 mg/L)FFC 的淋溶迁移[6]. 由此可知,生物炭对填装土柱(以基质流为主)和原状土柱(有优先流存在)中溶质弥散作用的影响是存在差异的,这可能是因为土壤孔隙分布与水分运动对生物炭施用的响应不同. 例如,王红兰等[26]通过采用双指数模型拟合水分特征曲线参数,结果表明,表层与亚表层紫色土施加1%生物炭后,基质性孔隙含水量均有所增加,而结构性孔隙含水量均减少,并且半径小于250 μm 的孔隙对饱和导水率(Ks)的贡献率增加了16%~86%,而大于250 μm 的孔隙对饱和导水率(Ks)的贡献率最高可减少37%.
综上,在紫色土填装土柱中,生物炭施用虽然提高了弥散作用,加速了FFC 的淋失,但仍可通过提高瞬时吸附能力,增加瞬时吸附交换所占分数(f),提高一阶动力学速率系数(α),从而实现对FFC 的迁移阻控.
3 结论
a) FFC 在供试土壤上的吸附行为符合Freundlich等温吸附模型,生物炭施用可有效提高紫色土对FFC的吸附容量常数(Kf),且非线性增强.
b) FFC 在供试土柱中具有高迁移性且符合两点化学非平衡模型. 施用生物炭可提高紫色土对FFC的瞬时吸附能力与动态吸附能力,但提高幅度远小于批量平衡吸附试验.
c) 生物炭对FFC 在紫色土中迁移行为具有物理-化学耦合影响,虽然促进了水分运动,但仍可通过增强吸附来实现对FFC 的阻控.
