磷限制条件下单胞藻胞内磷储量差异机理研究
2022-06-22魏晓雪冯剑丰
魏晓雪,田 晨,冯剑丰,2,朱 琳*
1. 南开大学环境科学与工程学院,天津 300350
2. 天津市跨介质复合污染环境治理技术重点实验室,天津 300350
营养盐浓度过高是造成水体富营养化的必要因素,然而研究发现,有害藻华形成后,水环境中某种营养盐浓度反而处于较低水平,并形成营养盐限制状态. 以N/P(摩尔比,下同)为营养盐限制判断标准,其大于16∶1 时,藻类生长受磷限制. 研究表明,中国长江口、辽东湾、大鹏湾、渤海湾等水域N/P 范围为17~490,浮游植物生长主要受磷限制. 磷是浮游植物生长和繁殖必需的营养元素,参与有机体的化学组成和物质传递,也是导致有害藻华形成过程中,是否产生营养限制的重要因子. 在磷限制条件下,有害藻华生态系统中磷元素的能量流和物质流同浮游植物体内的组分存在供需动态平衡关系,藻细胞内的不同组分在磷限制环境中具有高度可变性. 研究表明,微藻存在磷储存现象,以应对营养匮乏的环境条件,而不同种类藻的磷储存能力存在显著差异. 这种差异可能与藻的生长速率、营养盐吸收、细胞形态等密切相关,并且可能与有害藻华的形成存在重要联系.
近年对长江口邻近海域大规模赤潮的研究表明,营养盐浓度和构成的变化是导致赤潮大规模暴发和有害藻华优势类群演替的重要原因. Ji 等通过分析赤潮异湾藻()藻华前后的差异表达基因发现,赤潮异湾藻对磷的快速吸收和对溶解性有机磷的有效利用可能促进藻华的形成. 已有研究表明,微藻可以根据水体中磷浓度的改变,调整胞内磷储量及其代谢过程,以优化其细胞的生长.
利用Droop 模型,可以计算细胞内磷的最小配额(, the minimal cell quota for P),以量化表征海洋微藻细胞内磷储量,并且设定为磷限制的研究条件. 有研究表明,与最大生长速率和营养盐最大吸收速率相比,最小胞内配额更易影响Droop 模型的输出结果,且对微藻生长影响较大. Baklouti 等利用以为基础建立的浮游生物功能类型(PET,Plankton Functional Type)模型,从细胞内磷配额的角度深入解释了地中海西北部藻华的发生.
综上,研究不同微藻细胞内磷最小配额的差异,可以更好地了解有害藻华的形成过程. 因而,该文选择硅藻门的三角褐指藻()和多列拟菱形藻()、定鞭藻门的球等鞭金藻()以及甲藻门的海洋原甲藻()等4 种海洋藻华代表性种类为研究对象,在磷限制条件下分析其细胞内磷储量与生长速率的关系及种间差异性,探究胞内磷的最小配额与藻类性状的关系,以期为后续深入研究藻类生长状态与有害藻华形成机制提供支持.
1 材料与方法
1.1 试验材料
试验所用藻种三角褐指藻购自中国科学院海藻种质库,藻种编号MASCC17,分离自中国黄海海域;多列拟菱形藻购自中国科学院淡水藻种库,藻种编号FACHB-2584,分离自台湾海峡;球等鞭金藻和海洋原甲藻购自上海光语生物科技有限公司,分别分离自中国厦门和东海海域. 用人工海水和f/2 改良培养基培养至指数期后饥饿3 d 开始试验,所有藻种均以1 000 mL 锥形玻璃瓶为培养容器,并将其置于光照培养箱(KRG-250BP,上海柏欣仪器设备厂)内培养,温度设为(20±1) ℃,光照强度为110 μmol/(m·s),光暗比为12 h:12 h,每天摇动3~4 次,每天在同一时间取样.
1.2 试验设计
预试验中设计N/P 为50:1、100:1、150:1、200:1,结果表明,当N/P 为150:1 时Droop 模型能较好地拟合海洋微藻比生长速率和其胞内磷含量之间的关系,因而后续试验磷限制培养条件N/P 为150:1,即f/2改良培养基中NaNO浓度为75 mg/.L,NaHPO·HO浓度为0.811 mg/.L,其他营养元素浓度不变.
该研究采用光密度法测定并计算微藻干质量,以计算比生长速率();利用Droop 模型计算胞内磷的最小配额(). 试验采用批次培养的方式,分两个批次进行.
a) 第一批次:确定光密度曲线. 4 种微藻的接种密度均为1×10cells/mL. 以正常f/2 改良培养基培养,每组设3 个平行. 每日取100 mL 摇匀后的藻液(三角褐指藻、多列拟菱形藻和球等鞭金藻,共计8 d,海洋原甲藻共计10 d),用0.22 μm 醋酸纤维膜过滤,滤得藻样品经真空冷冻干燥后在恒温干燥器中放至恒重并称量;同时用UV755B 紫外分光光度计(上海精密科学仪器有限公司)测定藻液在680 nm(预试验结果表明该波长下微藻光密度曲线线性最佳,其>0.9,<0.01)下的吸光度,绘制藻液干质量(Mass)-吸光度(Abs)标准曲线.
b) 第二批次:确定Droop 模型参数. 4 种海洋单胞藻的初始接种密度均为1×10cells/mL. 以磷限制条件(N/P=150:1)培养,每组设3 个平行. 每天取40 mL藻液在5 000下离心10 min(共计12 d),弃去上清液,用去离子水洗涤并再次离心、弃去上清液,如此反复3 次. 所得样品采用钼酸盐分光光度法测定其胞内磷含量(均以正磷酸盐计),即加入4 mL 50 g/L 的过硫酸钾后将其置于温度为120 ℃、压力为1.08×10Pa的高压灭菌锅(HVE-50,日本HIRAYAMA 公司)内消解30 min,冷却后加入钼酸盐等显色剂,颜色稳定后测定其在700 nm 下的吸光度. 用UV755B 紫外分光光度计测定过滤前藻液在680 nm 下的吸光度,并用显微镜(HFX,日本Nikon 公司)和图像分析系统观察藻类生长状态,测定细胞长()、宽().
1.3 光密度曲线与Droop 模型
a) 第一批次试验结果. 三角褐指藻(Pt)、多列拟菱形藻(Pnm)、球等鞭金藻(Ig)、海洋原甲藻(Pm)的光密度曲线拟合结果分别为Mass=476.53×Abs、
Mass=851.23×Abs、 Mass=363.29×Abs、 Mass=1 232.84×Abs,其相关性系数均大于0.95,表明这4 种单胞藻样品干质量与吸光度均为显著线性相关,所得光密度曲线可用于磷限制条件下藻类比生长速率计算,其计算公式:

式中:为藻类比生长速率,d;为某一时间间隔终结时的藻类生物量,μg/mL;为某一时间间隔开始时的藻类生物量,μg/mL;—为某一时间间隔,即1 d.
b) 第二批次试验结果. 用Droop 模型作-1/线性分析,得到线性回归方程.
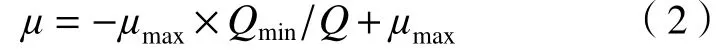
式中:为藻类最大比生长速率,d;为胞内磷的最小配额,μg/g;为微藻胞内磷含量(以干质量计),μg/mg.
从式(2)可知,该回归方程在轴的截距为藻细胞生长所能达到的最大比生长速率(),回归系数为与乘积的负值,由此可知磷限制条件下4种藻的和.
1.4 细胞体积
根据Hillebrand 等方法,假设三角褐指藻、球等鞭金藻、海洋原甲藻的相似几何形状分别为椭圆底棱镜、球形、椭圆体,以此计算细胞体积,计算公式:
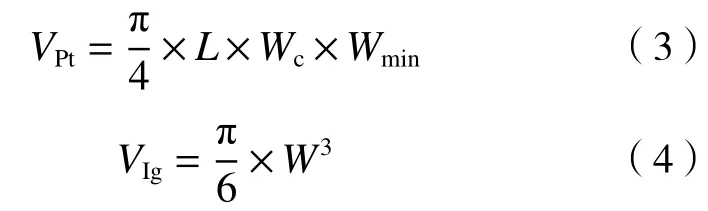
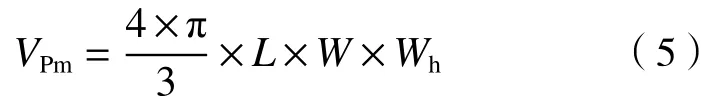
式中:、、分别为三角褐指藻、球等鞭金藻、海洋原甲藻的细胞体积,μm;为藻细胞长度,μm;为藻细胞宽度,μm;为三角褐指藻细胞中心宽度,μm;为三角褐指藻细胞最小宽度,μm;为海洋原甲藻高度,μm.
多列拟菱形藻的细胞体积计算公式根据Hillebrand 等和Lundholm 等的描述修改为

式中:为多列拟菱形藻的细胞体积,μm;为藻细胞长度,μm;为藻细胞宽度,μm.
1.5 数据分析
采用Pearson 相关性分析,4 种微藻与、与藻细胞体积的关系. 采用线性回归分析(linear regression analysis)构建上述指标之间的线性回归方程. 在线性回归分析前,对和藻细胞体积进行对数转换,与不做对数转换.
2 结果与讨论
2.1 藻类胞内磷含量随时间的变化
如图1 所示,4 种藻的随时间均呈先升后降的趋势. 三角褐指藻在第2 天达(3.02±0.08) μg/mg,增加了18.43%,随后迅速下降;多列拟菱形藻和球等鞭金藻的在第3 天分别增至(4.20±0.06)和(5.37±0.25) μg/mg,分别增加了117.62%和25.17%;其中球等鞭金藻在第4 天降至(4.88±0.23) μg/mg,而后迅速下降,多列拟菱形藻在第4 天逐渐降低;海洋原甲藻在10 d 内逐渐增至(100.70±4.99) μg/mg 且呈S 型生长趋势,增加了319.06%,而后迅速降低. 不同微藻随时间变化的差异可能与其生物量随时间变化不同有关.

图 1 磷限制条件下不同海洋微藻胞内磷含量(Q)随时间的变化Fig.1 Temporal variation of phosphorus content in different marine microalgae (Q) under phosphorus limitation
由图2 可知,三角褐指藻和球等鞭金藻的生长趋势呈近S 型,其最大生物量分别为196.01 和126.97 μg/mL,三角褐指藻和球等鞭金藻的生物量分别增加了28 和32 倍;多列拟菱形藻和海洋原甲藻的生物量随时间逐渐增加,分别增加了6 和3 倍,其最大生物量分别为129.10 和44.79 μg/mL.
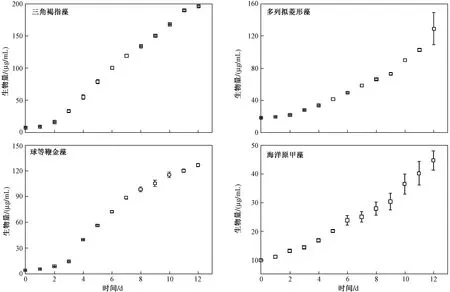
图 2 磷限制条件下不同海洋微藻生物量随时间的变化Fig.2 Temporal variation in the biomass of different marine microalgae under phosphorus limitation
易文利等研究发现,磷限制条件下处于饥饿状态的微藻会快速吸收并储备磷,但细胞内磷含量会随微藻的生长而逐渐降低;这可能是该试验中微藻出现先升后降的原因. 与其余3 种微藻相比,海洋原甲藻生长缓慢,其生物量较低(见图2),对外部磷需求量较小,这可能导致海洋原甲藻胞内磷增长时间较长. 与其余3 种微藻相比,海洋原甲藻的对磷限制响应不明显,可能与其胞内磷储量较大,对磷胁迫耐受力较强有关. 研究表明,藻细胞的磷储存能力与其对磷胁迫的耐受能力相关,并且不同微藻磷储存能力的差异对种群的竞争能力具有重要作用. 该文研究结果与野外调查结果类似,如中国东海长江口和舟山海域连续3 年赤潮的监测结果表明,在磷限制条件下,甲藻门具有比其他门类更强的种间竞争力,这对解释藻华的诱发和维持具有重要意义.
2.2 不同藻类Qmin 与μmax 的差异分析
磷限制条件下,4 种微藻的-1/线性曲线如图3 所示. 4 种微藻的与呈正相关. Droop 模型认为藻细胞的生长速率与细胞配额有关,并且适用于硝酸盐、磷酸盐和硅酸盐等营养盐限制条件,与该研究的结果一致. 海洋原甲藻样品间平行性较差,可能与其个体较大、生长速率慢、生物量较小有关.

图 3 磷限制条件下不同海洋微藻的Droop 模型曲线Fig.3 Droop model of different marine microalgae under phosphorus limitation
磷限制条件下,4 种微藻1/曲线拟合结果、与(以干质量计)如表1 所示. 由表1 可知,4种微藻的与1/显著相关(<0.01).和存在种间差异,即不同门间和差异明显,同门不同种间和也存在较大差异. Sterner 等提出的生长速率假说认为,细胞的生长速率对胞内元素含量变化起决定性作用,即微藻的与1/存在相关性,与该研究的结果一致. 而不同藻种间与表现出的差异可能是因生物种类生长策略的不同,或不同微藻对环境变化生理响应的差异.
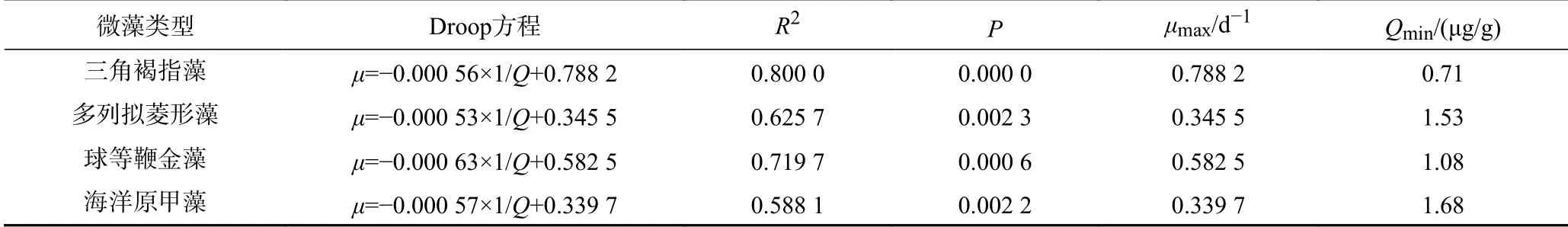
表 1 磷限制条件下不同海洋微藻的主要试验结果Table 1 Main experimental results of different marine microalgae under phosphorus limitation
浮游植物在不同营养盐浓度中存在不同生理响应策略. Kilham 等认为微藻r-策略者具有较高的最大生长速率和死亡率,不能长时间维持种群的高密度;而k-策略者则具有较低的最大生长速率和死亡率,其将资源用于非增殖性活动中,如获得并储存资源、产生藻毒素、增大藻细胞体积和共生等,以保证个体的生存机会最大化. 研究表明,硅藻属于r-策略者,具有较高的,吸收的营养物质主要用于细胞增殖;海洋卡盾藻()、东海原甲藻()、链状亚历山大藻()等鞭毛藻多属于k-策略者,其较低,对营养盐限制环境具有较强的耐受能力;而这种生态策略的差异可能导致二者在赤潮发生过程中的种类演替. 该研究的海洋原甲藻属于k-策略者,该藻个体较大,其主要将磷酸盐用于非增殖性活动中,因而小且大. 而其他3 种藻因为个体小而将资源主要用于细胞分裂增殖,具有较高的,是典型的r-策略者. r-策略者在营养盐较为充足时会迅速吸收资源用于生长,使其胞内磷储量较低,因而三角褐指藻与球等鞭金藻高而小. 但多列拟菱形藻与之相反,其生长速率较小而胞内磷储量较大,可能与Droop 模型对该藻细胞形状的适用性较差有关.
藻种间与出现差异的原因可能与藻细胞最适生长条件及其对各理化指标的响应有关. 与相关研究比较可知,该研究试验条件中除磷含量外,其他元素含量均满足各藻种最适生长条件对应含量.但N/P 均小于最适生长条件,使试验藻种生长处于磷限制条件. 此外,与最适生长条件相比,三角褐指藻和球等鞭金藻的培养条件与其较为相近,海洋原甲藻与其相差较大.
此外,各藻种性质的差异也可能是、不同的原因. 已有研究显示:球等鞭金藻生长速率快,受环境影响较小;三角褐指藻和多列拟菱形藻生长速率均较快,且由于其外层的硅质外壳,在自然界中生命力较强;海洋原甲藻个体较大,生长较缓慢. 因此,不同藻种间与出现较大差异.
近年来,中国近岸海域不断爆发大规模有害藻华. 已有研究证明,长江口春夏季出现甲藻、硅藻藻华优势种演替的原因是二者不同的磷竞争能力. 不同藻种间和较大的差异可能是造成藻类具有不同磷竞争能力的原因,也可能是不同种类微藻伴生赤潮出现长时间持续的原因.
2.3 胞内磷的最小配额Qmin 与藻种性状差异的关系
在试验过程中镜检4 种海洋微藻的细胞形态发现,其与正常培养下的藻细胞均无明显差异. 由此可知,磷限制不会导致4 种微藻形态发生明显变化.
试验所用海洋微藻在性状方面差异较大,这些差异可能反映不同种的不同. 由表2 可知,在物理性状方面,微藻体积表现为海洋原甲藻>多列拟菱形藻>三角褐指藻>球等鞭金藻,表现为海洋原甲藻>多列拟菱形藻>球等鞭金藻>三角褐指藻.Edwards 等研究表明,不同种类海洋微藻的随藻体积的增加而增加,且的差异源于细胞体积的不同. 藻细胞体积越大,具有合成磷元素功能的细胞组件的可利用空间增加,因而其越大. 该研究(也包括Edwards 等的研究,即选取相同门类藻种的文献数据)分析表明,藻类细胞的与细胞体积呈显著正相关(<0.01,R=0.82)(见图4).
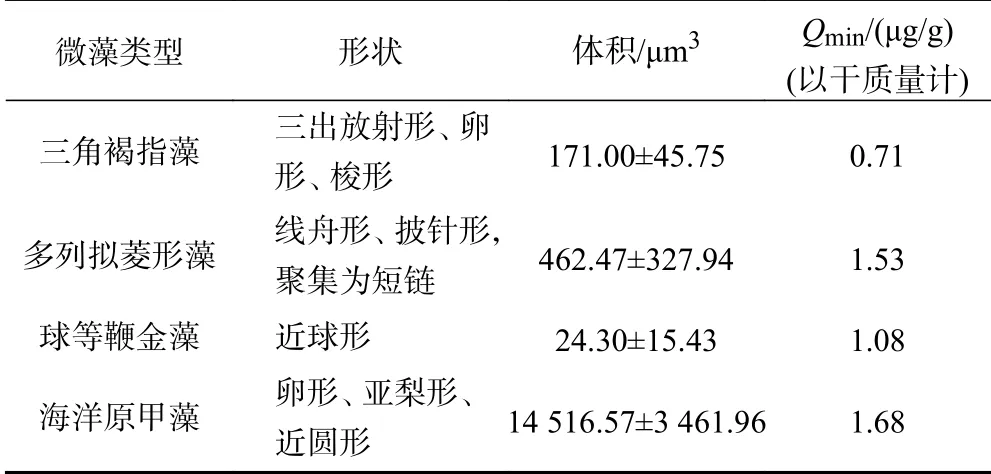
表 2 不同海洋微藻的物理性质指标Table 2 The physical properties of different marine microalgae
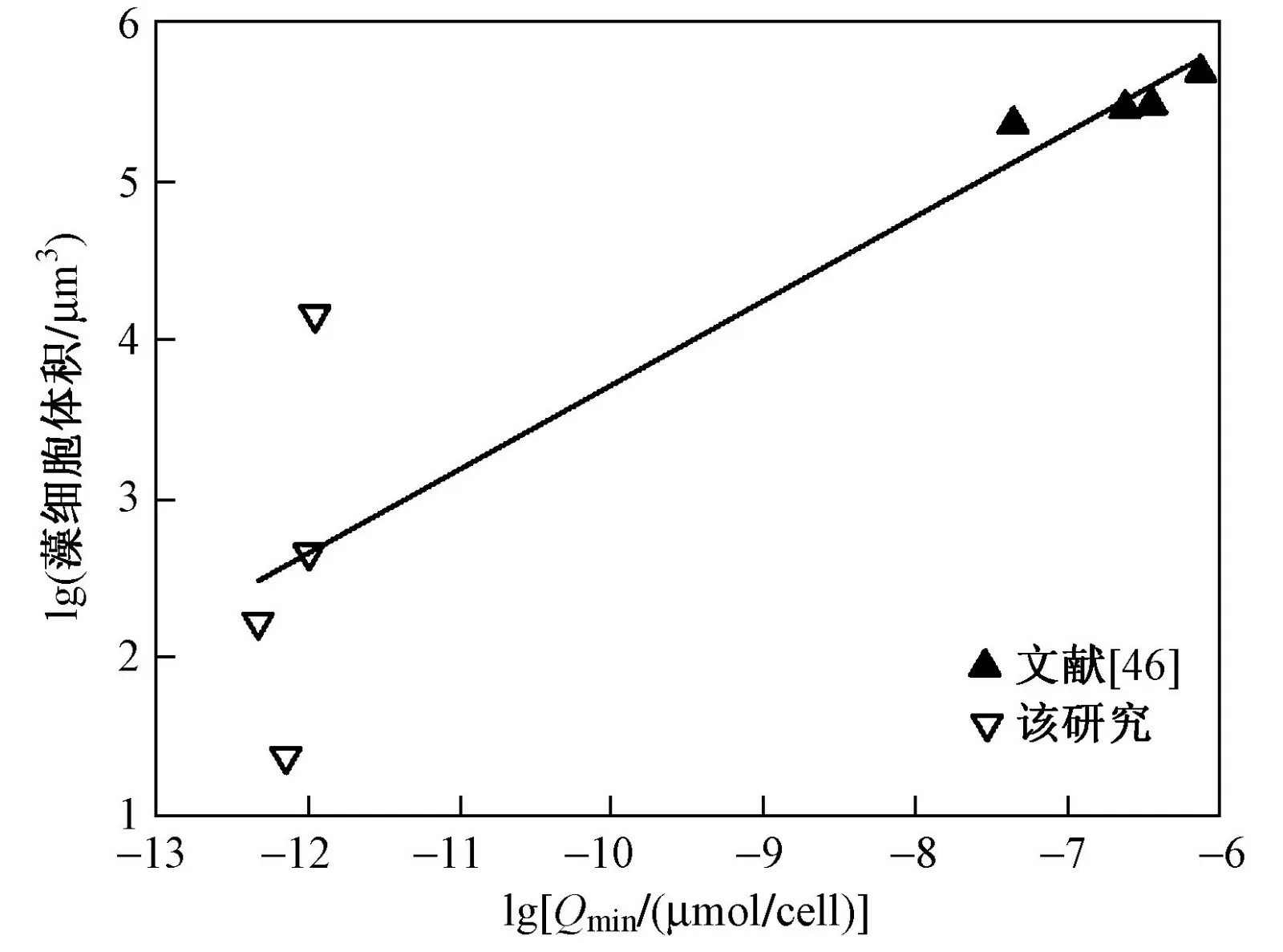
图 4 藻细胞体积与Qmin 的线性关系Fig.4 The linear regression results between Qmin and cell volume
在生长方面,由表1 可知,微藻表现为三角褐指藻>球等鞭金藻>多列拟菱形藻>海洋原甲藻;而表现为海洋原甲藻>多列拟菱形藻>球等鞭金藻>三角褐指藻. Edwards 等研究证明,海洋微藻的细胞体积与呈显著负相关,而该试验的藻细胞体积与呈显著正相关;因而,该试验微藻的和可能存在相关性,即较大的藻种其较小.这可能是微藻在磷限制条件下为了维持较高的生长速率,利用非磷膜脂(如硫脂)代替磷脂以降低细胞内磷含量. Yamaguchi 等研究发现,在营养盐浓度较低的环境中,卵圆卡盾藻()以较小的实现较高的细胞密度,可能是其成为日本濑户内海有害藻华优势种的原因.
藻细胞的体积和生长速率等性状影响其对营养盐的吸收能力,而藻对营养盐的吸收能力与有关. 该研究结果也证明,藻细胞的体积、生长速率等性状可能影响,门的差异可能对其影响较小.Edwards 等研究发现,微藻的不同主要源于藻体积的差异,藻门类的影响可忽略,与该研究的结果一致. 这说明是影响微藻种间竞争的因素和赤潮出现持续时间长短的原因之一.
3 结论
a) 磷限制条件下,三角褐指藻、多列拟菱形藻、球等鞭金藻和海洋原甲藻的值随时间分别增加了18.43%、117.62%、25.17%和319.06%,而后减小,且不同藻种间的变化响应时间存在差异,响应程度也不同.
b) 4 种微藻的与均呈显著正相关. 不同浮游植物具有不同的生长策略,其对环境变化的不同生理响应或各藻种性质的差异可能造成和不同门间及同门不同种间的差异.
c) 4 种微藻的与藻体积均呈显著正相关,其与可能存在一定的相关关系,即较大的藻种其较小.
d) 与藻体积、相比,门水平上的差异可能对影响较小;而的差异可能是造成海洋微藻具有不同磷竞争力的原因,因而在赤潮中出现不同微藻优势种演替的现象.
