右美托咪定对脑出血大鼠神经功能及JAK2/STAT3通路的影响
2022-06-21郭庆夺杨秋影马美娜于红王旭鹏吴春玲李睿何庆
郭庆夺 杨秋影 马美娜 于红 王旭鹏 吴春玲 李睿 何庆
沧州市中心医院1麻醉科,2供应室(河北沧州 061000)
脑出血是临床常见的急性脑血管病,病情危重、救治难度大、致残率及病死率高。脑部血管破裂、血液进入脑实质形成血肿是脑出血的病理生理特征,造成神经损害的因素包括血肿压迫脑实质、颅内压升高等直接损伤因素以及血肿周围炎症反应、细胞凋亡、氧化应激激活等继发损伤因素[1-2]。右美托咪定(Dexmeditomidine,Dex)是一类具有镇静镇痛作用的α2 肾上腺素能受体激动剂,在全身麻醉手术中使用Dex 具有脏器保护作用。叶枝秀[3]的临床研究证实血肿清除术的围手术期应用Dex,显著改善高血压脑出血患者的神经功能,并抑制多种炎症细胞因子的释放,提示Dex可能可以用于脑出血的治疗。另有基础研究证实Dex 通过抑制蛋白酪氨酸激酶2(Janus kinase 2,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路发挥生物学作用;脑出血的相关基础研究证实脑出血大鼠血肿周围脑组织中JAK2/STAT3 通路显著激活且使用JAK2 抑制剂显著减轻脑出血大鼠的神经损害[6-7]。本研究将通在胶原酶诱导脑出血大鼠模型中研究Dex 对神经功能及JAK2/STAT3 的影响,旨在为今后深入认识Dex 在脑出血中的治疗价值及机制提供依据。
1 材料与方法
1.1 实验动物 SPF 级雄性大鼠,体质量180 ~200 g,8 ~10 周龄(上海吉辉实验动物饲养有限公司,生产许可SCXK(沪)2017-0012)。本研究经我院动物伦理委员会批准,批准号:AE20211015。
1.2 药品与试剂 右美托咪定(江苏恩华药业有限公司),VII 型胶原酶(美国Sigma 公司),阴性对照(NC)及JAK2 的慢病毒注射液(滴度109TU/mL,上海汉恒生物科技公司),HE 染色试剂盒(武汉博士德公司),TUNEL 试剂盒(上海碧云天公司),核因子-κB(nuclear factor-κB,NF-κB)、Bcl-2 相关X蛋白(Bcl-2-associated X Protein,Bax)、裂解型caspase-3(Cleaved caspase-3)及β-actin 单克隆一抗(美 国Abcam 公司),JAK2、STAT3、p-JAK2、p-STAT3(美国CST 公司)。
1.3 仪器 全自动脑立体定位仪(71000 型,深圳瑞沃德生命科技公司),显微镜(TE2000S 型,日本Nikon 公司),凝胶电泳槽及电泳仪(Power Pac 型,美国Bio-rad 公司),凝胶成像系统(Tanon5200 型,上海天能公司)。
1.4 方法
1.4.1 动物分组及干预 第一部分动物实验研究Dex 对脑出血大鼠神经功能的调控作用,分组方法如下:分为假手术组、脑出血组、Dex 组,每组各8 例。脑出血组和Dex 组采用胶原酶诱导脑出血模型:用生理盐水配置浓度0.2 U/μL 的胶原酶溶液,腹腔注射戊巴比妥钠麻醉大鼠,俯卧位固定于脑立体定位仪,暴露前囟并设置为原点,前0.1 mm、右侧3.5 mm 钻孔,将微量注射器固定在立体定位仪上并通过钻孔缓慢进入6.0 mm、到达右侧纹状体区域,注入1 μL 预先配置好的胶原酶溶液,取出注射器、骨蜡封闭钻孔。假手术组按照相同的方法进行麻醉、钻孔、进针,但不注射胶原酶。造模当天开始进行给药,Dex 组给予20 μg/kg Dex 腹腔注射、1 次/d、连续7 d;假手术组和脑出血组给予等剂量生理盐水腹腔注射、1 次/d、连续7 d。
第二部分动物实验研究JAK2/STAT3 通路在Dex 改善脑出血大鼠神经功能中的作用,分组方法如下:分为NC 慢病毒+假手术组、NC 慢病毒+脑出血组、NC 慢病毒+Dex 组、JAK2 慢病毒+Dex 组,每组各8 例。首先进行慢病毒的侧脑室注射,方法如下:腹腔注射戊巴比妥钠麻醉大鼠,俯卧位固定于脑立体定位仪,暴露前囟并设置为原点,后1.5 mm、右侧1.0 mm 钻孔,将微量注射器固定在立体定位仪上并通过钻孔缓慢进入3.2 mm、到达右侧侧脑室,注入NC 或JAK2 慢病毒注射液10 μL,取出注射器、骨蜡封闭钻孔。14 d 后按照第一部分动物实验的方法进行脑出血造模及造模后Dex给药,连续7 d。
1.4.2 神经功能缺损评分(neurological severity scores,NSS)的评价 造模后6、24、48、72 h 及7 d时,参照GARCIA[8]制定的NSS 评分标准从运动、感觉、平衡、反射、运动、行走进行评价,18 分为正常,得分越低、神经功能缺损越严重。
1.4.3 血肿周围脑组织病理改变的检测 完成NSS 评价后采用颈椎脱臼法处死大鼠,解剖得到血肿周围脑组织,取适量组织用4%多聚甲醛固定后制作病理切片,按照试剂盒说明书进行HE 染色,苏木素复染后封片,在显微镜下观察病理改变。
1.4.4 血肿周围脑组织中细胞因子含量的检测 取血肿周围脑组织约15 ~20 mg,加入组织裂解液后匀浆,4 ℃、12 000 g离心10 min,分离上清采用BCA法检测蛋白浓度,采用ELISA 法检测细胞因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)浓度,以细胞因子浓度与蛋白浓度的比值反映每毫克蛋白中细胞因子的含量。
1.4.5 血肿周围脑组织中细胞凋亡率的检测 取血肿周围脑组织的病理切片,按照试剂盒说明书进行TUNEL 染色,DAPI 复染后封片,在显微镜下观察阳性染色情况,TUNEL 阳性为凋亡细胞、DAPI 为总细胞,对细胞进行计数并计算细胞凋亡率。
1.4.6 血肿周围脑组织中蛋白表达的检测 取血肿周围脑组织裂解后的匀浆液,4 ℃、12 000 g 离心10 min,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度后将含有30 μg 蛋白的裂解液与上样缓冲液混合,煮沸变性后在聚丙烯酰胺凝胶中进行电泳、分离不同分子量的蛋白后进行电转膜,将聚丙烯酰胺凝胶中的蛋白电转至硝酸纤维素膜,依次进行5%脱脂牛奶封闭、特异性一抗孵育、HRP 二抗孵育,最后在凝胶成像系统中用ECL 法显影,得到NF-κB、Bax、Cleaved caspase-3、JAK2、STAT3、p-JAK2、p-STAT3 及β-actin 的条带及对应的灰度值,计 算NF-κB/β-actin、Bax/β-actin、Cleaved caspase-3/β-actin、p-JAK2/JAK2、p-STAT3/STAT3 灰度值的比值。
1.4.7 统计学方法 采用SPSS 21.0 软件录入数据,实验数据均为计量资料、以均数±标准差表示,3 组及4 组间比较采用单因素方差分析,两两比较采用独立样本t检验,相关性分析采用Pearson检验,P<0.05 为差异有统计学意义。
2 结果
2.1 Dex对脑出血大鼠造模后不同时间点NSS评分的影响 造模后6、24、48、72 h 及7 d 时,假手术组大鼠的NSS评分无明显变化(F=0.004,P=0.999),脑出血组和Dex 组大鼠的NSS 评分均呈现先下降、后升高的趋势且造模后48 h 时的NSS 评分最低。三组间造模后各个时间点的NSS 评分比较差异均有统计学意义(F=92.137,P<0.001)且脑出血组大鼠的NSS评分均低于假手术组、Dex组大鼠的NSS评分均高于脑出血组(F= 176.549,P<0.001,F=50.293,P<0.001)。
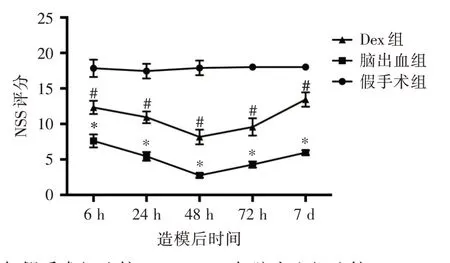
图1 三组大鼠造模后不同时间点NSS 评分的比较Fig.1 Comparison of NSS scores among three groups at different time points after modeling
2.2 Dex 对脑出血大鼠造模后7 d 时血肿周围脑组织病理改变的影响 假手术组脑组织中细胞排列整齐、结构清晰;脑出血组血肿周围脑组织中细胞肿胀变形、排列混乱、出现多个出血坏死灶;Dex组血肿周围脑组织的病理改变较脑出血组减轻。
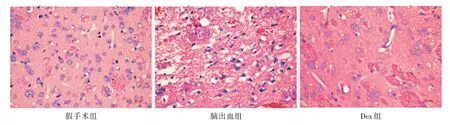
图2 三组大鼠血肿周围脑组织病理改变的比较Fig.2 Comparison of pathological changes of brain tissue around hematoma among three groups of rats
2.3 Dex 对脑出血大鼠造模后7 d 时血肿周围脑组织炎症反应的影响 脑出血组大鼠血肿周围脑组织中NF-κB 的表达水平及TNF-α、IL-6 的含量均高于假手术组(t= 29.585,P<0.001;t= 8.870,P<0.001;t= 15.771,P<0.001);Dex 组大鼠血肿周围脑组织中NF-κB 的表达水平及TNF-α、IL-6 的含量均低于脑出血组(t= 19.212,P<0.001;t= 3.579,P=0.009;t=9.680,P<0.001)。
2.4 Dex 对脑出血大鼠造模后7 d 时血肿周围脑组织细胞凋亡的影响 脑出血组大鼠血肿周围脑组织中细胞凋亡率及Bax、Cleaved caspase-3 的表达水平均高于假手术组(t= 17.146,P<0.001;t=11.855,P<0.001;t=7.112,P<0.001);Dex组大鼠血肿周围脑组织中细胞凋亡率及Bax、Cleaved caspase-3 的表达水平均低于脑出血组(t= 11.573,P<0.001;t=5.699,P=0.001;t=8.338,P<0.001)。
2.5 Dex 对脑出血大鼠造模后7 d 时血肿周围脑组织JAK2/STAT3 通路的影响 脑出血组大鼠血肿周围脑组织中p-JAK2、p-STAT3 的表达水平均高于假手术组(t= 17.852,P<0.001;t= 10.575,P<0.001);Dex 组大鼠血肿周围脑组织中p-JAK2、p-STAT3 的表达水平均低于脑出血组(t= 14.632,P<0.001;t=10.580,P<0.001)。
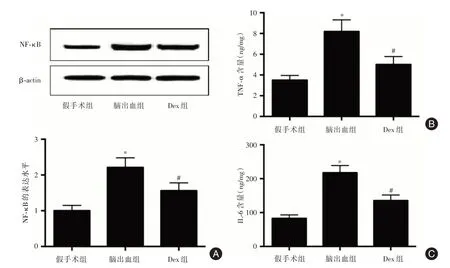
图3 三组大鼠血肿周围脑组织中炎症反应程度的比较Fig.3 Comparison of inflammatory degree in brain tissue around hematoma among three groups of rats

图4 三组大鼠血肿周围脑组织中细胞凋亡的比较Fig.4 Comparison of apoptosis in brain tissue around hematoma among three groups of rats
2.6 局部注射JAK2 慢病毒对血肿周围脑组织JAK2/STAT3 通路的影响 NC 慢病毒+脑出血组大鼠血肿周围脑组织中p-JAK2、p-STAT3 的表达水平均高于NC 慢病毒+假手术组(t= 14.650,P<0.001;t= 12.769,P<0.001);NC 慢病毒+Dex 组大鼠血肿周围脑组织中p-JAK2、p-STAT3 的表达水平均低于NC 慢病毒+脑出血组(t= 16.552,P<0.001;t= 13.622,P<0.001);JAK2 慢病毒+Dex 组大鼠血肿周围脑组织中p-JAK2、p-STAT3 的表达水平均高于NC 慢病毒+Dex 组(t= 18.067,P<0.001;t=18.137,P<0.001)。
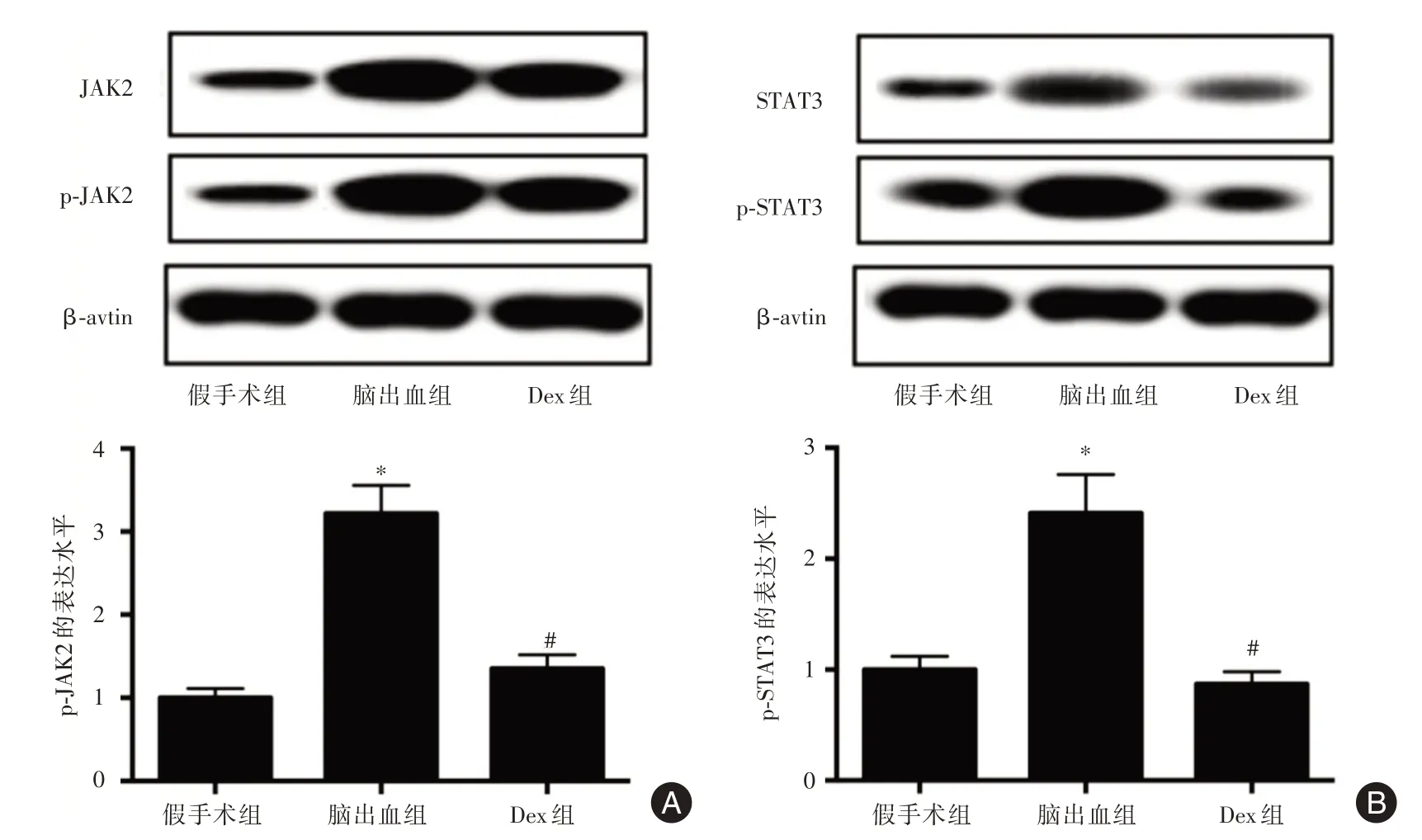
图5 三组大鼠血肿周围脑组织中JAK2/STAT3 通路的比较Fig.5 Comparison of JAK2/STAT3 pathway in brain tissue around hematoma among three groups of rats
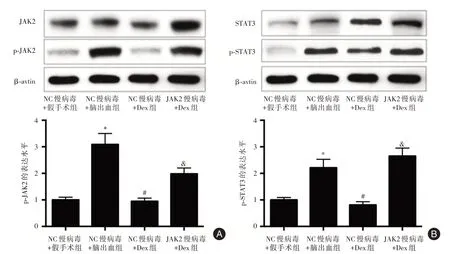
图6 四组大鼠血肿周围脑组织中JAK2/STAT3 通路的比较Fig.6 Comparison of JAK2/STAT3 pathway in brain tissue around hematoma in four groups
2.7 过表达JAK2 对Dex 改善脑出血大鼠NSS 评分的影响 造模后6、24、48、72 h 及7 d 时,NC 慢病毒+假手术组大鼠的NSS 评分无明显变化(F=0.201,P= 0.936),其余三组大鼠的NSS 评分均呈现先下降、后升高的趋势且造模后48 h 时的NSS评分最低。四组间造模后各个时间点的NSS 评分比较差异均有统计学意义(F= 0.201,P<0.001)且NC 慢病毒+脑出血组大鼠的NSS 评分均低于NC 慢病毒+假手术组、NC 慢病毒+Dex 组大鼠的NSS 评分均高于NC 慢病毒+脑出血组、JAK2 慢病毒+Dex 组大鼠的NSS 评分均低于NC 慢病毒+Dex组(F= 138.250,P<0.001;F= 30.388,P<0.001;F=10.241,P<0.001)。
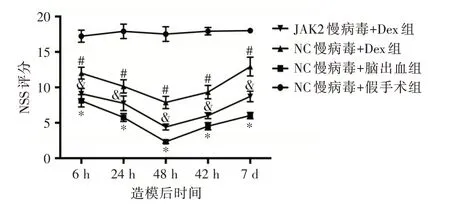
图7 四组大鼠造模后不同时间点NSS 评分的比较Fig.7 Comparison of NSS scores among four groups at different time points after modeling
2.8 过表达JAK2 对Dex 改善脑出血大鼠血肿周围脑组织病理改变的影响 NC 慢病毒+假手术组脑组织中细胞排列整齐、结构清晰;NC 慢病毒+脑出血组血肿周围脑组织中细胞肿胀变形、排列混乱、出现多个出血坏死灶;NC 慢病毒+Dex 组血肿周围脑组织的病理改变较NC 慢病毒+脑出血组减轻;JAK2 慢病毒+Dex 组大鼠血肿周围脑组织的病理改变较NC 慢病毒+Dex 组加重。
2.9 过表达JAK2对Dex改善脑出血大鼠血肿周围脑组织炎症反应的影响 NC 慢病毒+脑出血组大鼠血肿周围脑组织中NF-κB 的表达水平及TNF-α、IL-6的含量均高于NC慢病毒+假手术组(t=8.868,P<0.001;t=16.795,P<0.001;t=13.967,P<0.001);NC 慢病毒+Dex 组大鼠血肿周围脑组织中NF-κB的表达水平及TNF-α、IL-6 的含量均低于NC 慢病毒+脑出血组(t= 4.993,P<0.001;t= 7.670,P<0.001;t=7.256,P<0.001);JAK2 慢病毒+Dex 组大鼠血肿周围脑组织中NF-κB 的表达水平及TNFα、IL-6 的含量均高于NC 慢病毒+Dex 组(t=5.571,P<0.001;t=7.448,P=0.001;t=4.584,P=0.003)。
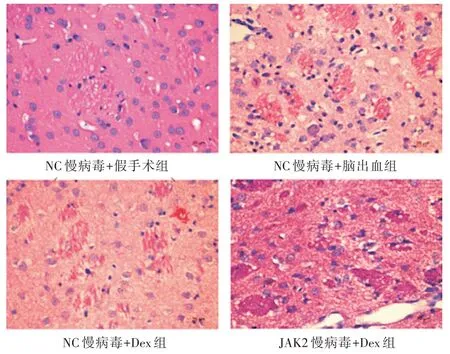
图8 四组大鼠血肿周围脑组织的病理改变Fig.8 Pathological changes of brain tissue around hematoma in four groups of rats
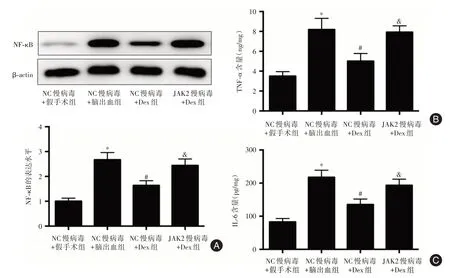
图9 四组大鼠血肿周围脑组织中炎症反应程度的比较Fig.9 Comparison of inflammatory degree in brain tissue around hematoma among four groups of rats
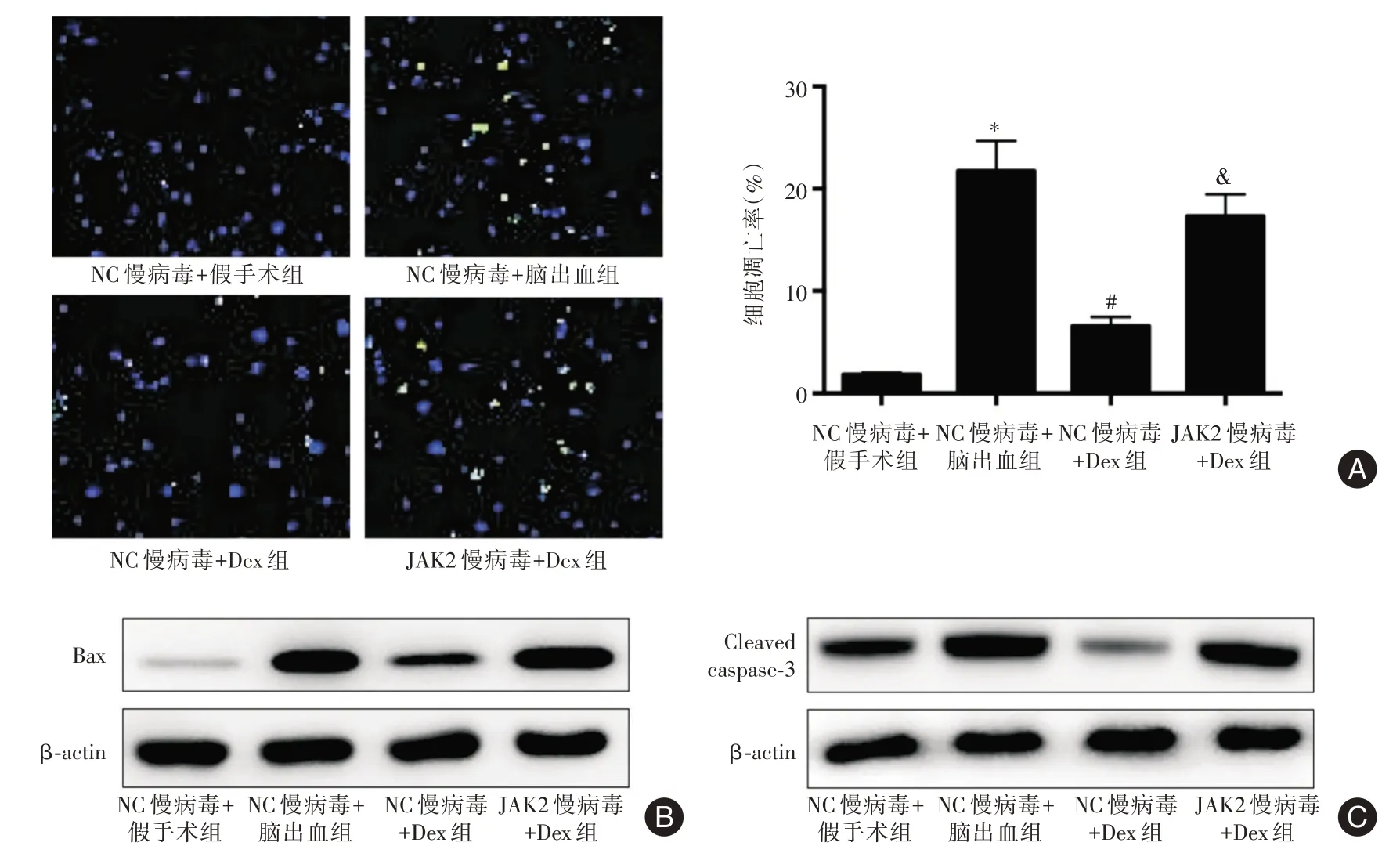
图10 四组大鼠血肿周围脑组织中细胞凋亡的比较Fig.10 Comparison of apoptosis in brain tissue around hematoma among four groups of rats
2.10 过表达JAK2 对Dex 改善脑出血大鼠血肿周围脑组织细胞凋亡的影响 NC 慢病毒+脑出血组大鼠血肿周围脑组织中细胞凋亡率及Bax、Cleaved caspase-3 的表达水平均高于NC 慢病毒+假手术组(t=21.224,P<0.001;t=10.160,P<0.001;t=8.455,P<0.001;);NC 慢病毒+Dex 组大鼠血肿周围脑组织中细胞凋亡率及Bax、Cleaved caspase-3的表达水平均低于NC慢病毒+脑出血组(t=15.281,P<0.001;t=3.469,P<0.010;t=8.498,P<0.001);JAK2 慢病毒+Dex 组大鼠血肿周围脑组织中细胞凋亡率及Bax、Cleaved caspase-3 的表达水平均高于NC 慢病毒+Dex 组(t= 15.102,P<0.001;t= 7.696,P<0.001;t=7.978,P<0.001)。
3 讨论
脑出血发病后血肿周围脑组织中炎症反应、细胞凋亡、氧化应激等生物学环节的异常激活是造成神经功能损害的继发损伤因素[9-10],针对继发损伤因素进行干预和治疗对改善脑出血预后、降低死亡率具有重要意义。Dex 是一种具有抗炎、抗凋亡作用的镇静镇痛药物,临床上主要用于全麻手术的诱导及术中维持,在体外循环手术、颅脑手术中使用Dex 能够起到神经保护作用[8,11-13]。近些年多项基础研究[14-16]在脑、心肌、脊髓等缺血再灌注损伤模型中证实Dex 显著减轻脏器损伤。目前Dex 在脑出血中的应用尚缺乏直接证据,仅国内叶枝秀[3]的临床研究将Dex 用于高血压脑出血的血肿清除术,通过围手术期使用Dex 显著改善患者的神经功能。
本研究将Dex 用于脑出血的治疗,通过胶原酶诱导脑出血大鼠模型后观察到DSS 评分降低且血肿周围脑组织出现细胞肿胀变形、排列混乱及出血坏死灶,符合脑出血的病理改变。在脑出血造模后连续7 d 给予Dex 腹腔注射干预,结果发现经Dex 干预的大鼠DSS 评分明显增加、血肿周围脑组织中病理改变明显改善,表明Dex 显著改善DSS大鼠的神经功能及血肿周围脑组织病理改变,与临床研究中Dex 改善高血压脑出血患者血肿清除术后神经功能的结果吻合,提示Dex 可能在脑出血的治疗中起到积极价值。
多项关于Dex 的研究证实该药物具有抗炎及抗凋亡效应[4-5,14-16]。本研究也从抗炎和抗凋亡的角度深入探究Dex 改善脑出血后神经功能的相关机制。NF-κB 介导的炎症反应和Bax 介导的细胞凋亡与脑出血后神经功能发生继发损伤密切相关,NF-κB 能够促进TNF-α、IL-6 的释放并引起炎症反应级联放大,Bax 能够促进细胞色素C 释放、增加Cleaved caspase-3 表达并激活细胞凋亡[17-19]。本研究在脑出血模型大鼠的血肿周围脑组织中检测到细胞凋亡率、NF-κB、Bax、Cleaved caspase-3 表达及TNF-α、IL-6 含量均增加,符合脑出血后炎症反应和细胞凋亡激活的病理特征。经Dex 干预后,脑出血大鼠血肿周围脑组织中炎症反应和细胞凋亡均受到抑制,表明Dex 改善脑出血后神经功能的作用与其抑制炎症反应和细胞凋亡有关。
脑出血后继发损伤因素的发生涉及复杂的分子机制及信号通路,其中JAK2/STAT3 通路已经被多项研究证实在脑出血后血肿周围脑组织中表达增加,并且使用该通路的抑制剂显著改善脑出血大鼠的神经功能[6-7]。本研究也在脑出血模型大鼠的血肿周围脑组织中检测到p-JAK2、p-STAT3表达增加,给予Dex 干预后p-JAK2、p-STAT3 的表达明显降低。JAK2/STAT3 通路激活的主要效应包括通过NF-κB 通路促进炎症反应、通过Bax 促进细胞凋亡,本研究证实Dex 抑制血肿周围脑组织中JAK2/STAT3 通路的激活,推测这可能是Dex 改善脑出血大鼠神经功能的分子机制。为了验证这一推测,本研究设计了过表达JAK2 的慢病毒,在脑出血造模前进行JAK2 腺病毒的侧脑室注射、造模后继续给予Dex 干预,结果发现经腺病毒过表达p-JAK2、p-STAT3 后,Dex 用于脑出血大鼠改善神经功能、抑制炎症反应及细胞凋亡的作用均明显削弱,表明JAK2/STAT3 通路在血肿周围脑组织中参与炎症反应及细胞凋亡的调控,Dex 改善脑出血大鼠神经功能的作用与抑制JAK2/STAT3 通路介导的炎症反应及细胞凋亡有关。
综上所述,本研究的动物实验结果表明Dex用于脑出血大鼠的治疗能够改善神经功能及血肿周围脑组织病理改变、抑制血肿周围脑组织的炎症反应及细胞凋亡,上述治疗作用与抑制JAK2/STAT3 通路的激活有关。上述结果为深入认识Dex 在脑出血中的治疗价值及机制提供了实验依据,也为今后研究脑出血后炎症反应、细胞凋亡等继发损伤因素的相关分子机制提供了思路。
