离子霉素辅助卵子激活对卵胞浆内单精子注射后受精失败患者的影响
2022-06-21罗阳彭芳李磊刘文博刘寒艳
罗阳 彭芳 李磊 刘文博 刘寒艳
1广东省产科重大疾病重点实验室,广东省生殖医学重点实验室,广州医科大学附属第三医院妇产科,生殖医学中心(广州 510150);2广州医科大学附属第三医院重症医学科(广州 510150)
卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)通过将单个精子直接注射到成熟的卵母细胞中进行授精,是目前治疗男性因素不孕症和既往常规体外受精(in vitrofertilization,IVF)发生失败患者最有效的辅助生殖技术[1]。目前ICSI 平均受精率高达80%,但仍有1% ~5%的ICSI 周期发生完全受精失败,其主要原因是卵子激活失败或不足[2-3]。临床上对该部分ICSI 受精失败的治疗策略是进行辅助卵子激活(assisted oocyte activation,AOA),即通过机械激活,电激活和化学试剂激活等方法人工引发卵胞浆内钙离子震荡,辅助完成卵子激活过程[4-6];其中采用钙离子载体A23187 和离子霉素的化学试剂激活目前已应用于较多生殖中心[7]。ICSI 联合AOA(ICSIAOA)在ICSI 受精失败患者中已获得临床妊娠,并分娩健康婴儿[8],但总体而言,ICSI-AOA 在改善既往ICSI 受精失败患者方面的样本量仍然不足,安全性仍不确定,尤其对于目前最新的离子霉素方案的有效性和安全性有待进一步确定[9-10]。本研究回顾性分析了在我院生殖医学中心实施离子霉素方案的ICSI-AOA 治疗患者的临床资料,以探讨对ICSI 受精失败患者实施AOA 的有效性和安全性。
1 资料与方法
1.1 研究对象 收集2018年6月至2019年10月期间在本中心接受ICSI-AOA 方案治疗周期患者的临床资料。纳入标准:(1)上次ICSI 受精失败;(2)成熟卵子≥6 个。本研究中的ICSI 受精失败分为完全受精失败(受精率=0%)和受精率低(受精率<30%)。共纳入56 例接受ICSI-AOA 治疗周期的患者,其56 个ICSI-AOA 治疗周期被纳入ICSIAOA 组;患者之前未进行AOA 治疗的56 个ICSI受精失败周期作为对照组。此外,由于对照组分娩数据样本量偏小,因此,在进行新生儿结局比较时,本研究选择本中心同期进行的常规ICSI 来源的997 例患者分娩数据作为对照组。本研究已经通过医学伦理委员会批准(生伦审[2018]第004号),纳入的所有患者均同意并签署书面知情同意书。
1.2 主要实验试剂与仪器 对患者进行控制性促排卵的药物有重组人促卵泡激素-果纳芬(Gonal-F)和促性腺激素释放激素拮抗剂(Cetrotide)由瑞士Serono 公司提供;促性腺激素释放激素激动剂(Diphereline)由法国Ipsen Pharma Biotech 公司提供;辅助卵子激活试剂离子霉素(Ionomycin)由德国Merck KgAA 公司提供。胚胎培养使用的培养基由瑞典Vitrolife 公司提供,且提前配置好并于37 ℃,6%CO2培养箱中进行过夜平衡待用。胚胎观察操作使用的倒置显微镜(ECLIPSE Ti-S),体视显微镜(SM2645)均由日本Nikon 公司提供;胚胎培养所使用的培养箱均由澳大利亚Cook 公司提供。
1.3 实验方法
1.3.1 卵子收集和ICSI 监测到卵泡发育有至少1 个主导卵泡直径≥18 mm,或3 个卵泡的平均直径≥16 mm时进行扳机,34 ~36 h后超声引导下进行经阴道取卵。收集卵冠丘复合物,立即置于G-IVF Plus 培养基中(Vitrolife),并在培养箱中保持6%CO2和5%的O2在37 ℃下培养2 ~3 h。通过透明质酸酶溶液和机械吹吸处理对卵冠丘复合物进行脱颗粒,去除颗粒细胞后的裸露卵子进行成熟度评估,仅对成熟的MII 期卵子(Metaphase II,MII)进行ICSI 操作。
1.3.2 辅助卵子激活 AOA程序参照Nasr-Esfahani等人先前的方法进行[11]。在ICSI注射后,立即将卵子转移到以G-IVF Plus 培养基配置的激活液中,即10 μmol/L 离子霉素培养处理10 min。激活后,以G-IVF Plus 漂洗至少3 次,随后置于G1-plus 培养基(Vitrolife)中继续培养直至受精观察。
1.3.3 体外受精和胚胎培养 授精16~18 h 后显微镜下观察评估受精情况,只有可见2 个原核的(two pronucleus,2PN)为正常受精卵,显示单个或两个以上PN 的胚胎被认为是异常受精并被丢弃。将正常受精卵转移至新配置的培养基中进行后续培养,以该天为胚胎发育第1 天,第3 天时再次进行卵裂期胚胎发育情况的评估,评估的标准为:卵裂球数目7~9 个,大小均匀,且胚胎中碎片程度≤20% 评为优质胚胎,卵裂球数目≥5 个,且胚胎中碎片≤20%,则评为可利用胚胎[12]。在第3天胚胎移植和玻璃化冷冻处理后,其余的胚胎转移至囊胚培养基中继续培养至第5 或第6 天,囊胚评分参考Gardner 评判标准,即扩张的B4-B6 囊胚且至少一个B 的内细胞团(ICM)和(或)滋养外胚层(TE)或更好等级的囊胚可以用于移植[13]。
临床妊娠被定义为妊娠第5 周经阴道超声观察到有胎心的孕囊,流产被定义为在妊娠20 周之前失去临床妊娠,活产定义为至少分娩一名活产婴儿。具有胎心搏动的孕囊数目同移植胚胎数目比例为胚胎种植率;临床妊娠患者数目同进行胚胎移植患者数目的比例为临床妊娠率。
1.4 统计学方法 所有统计分析均使用SPSS 19.0软件进行。数据用均数±标准差或例(%)表示;组间比较采用t检验或卡方检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料 纳入研究患者的平均年龄为31.46岁,其平均体质指数为21.57,平均基础FSH、LH、抗苗勒氏管激素(AMH)水平分别为5.62、3.71 U/L和5.75 ng/mL。平均不孕年限为5.75年,接受辅助生殖治疗周期平均2.67 次。对患者的不孕症类型分析发现原发性不孕不育占据主导,为80.36%,继发性不孕症比例为19.64%;男性因素占病例的71.43%,女性因素为5.36%,23.21%的病例同时具有男性和女性因素。在取精方式上,76.79%的病例为射出精,23.21% 的病例采用手术取精。这些数据表明本研究中接受ICSI-AOA 治疗的患者主要来自于原发性不孕或男性因素,见表1。
表1 患者的一般资料Tab.1 Characteristics of included patients ±s
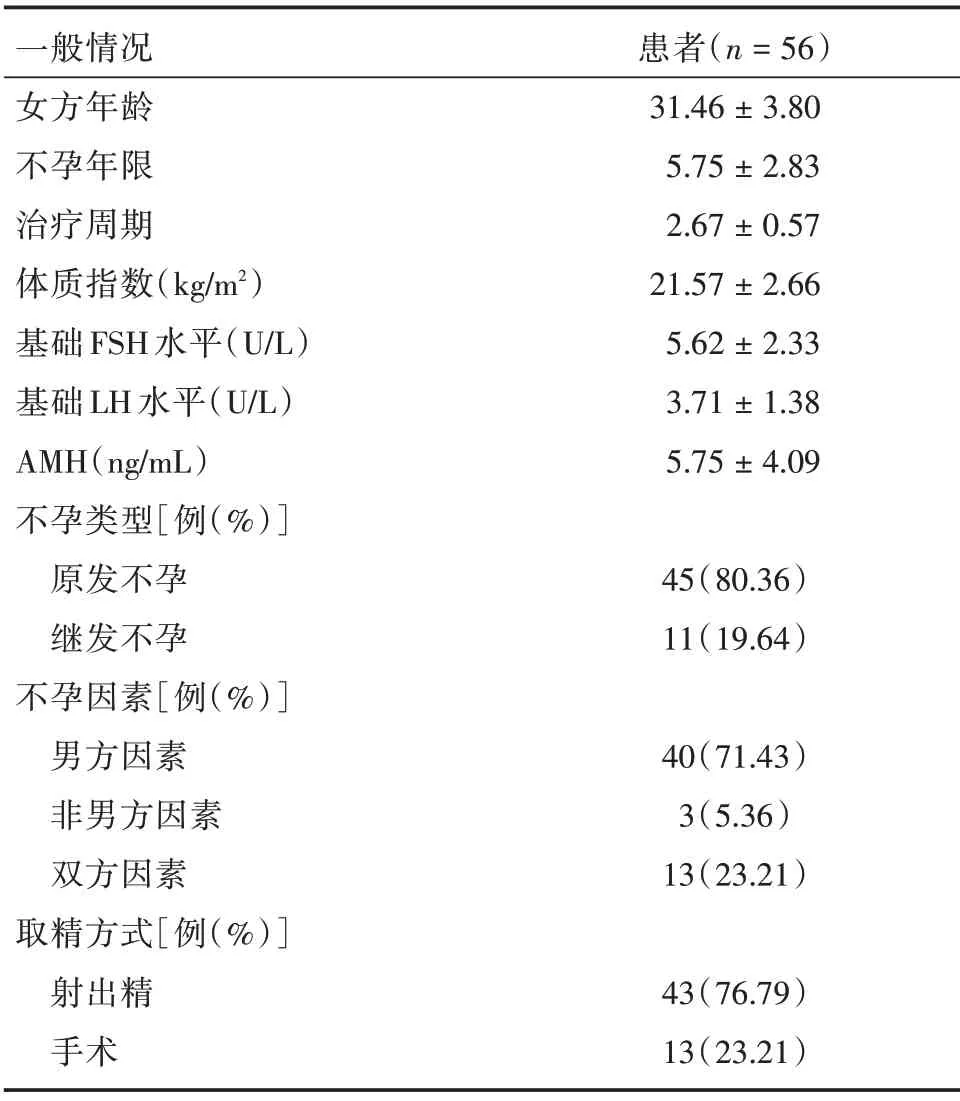
表1 患者的一般资料Tab.1 Characteristics of included patients ±s
一般情况女方年龄不孕年限治疗周期体质指数(kg/m2)基础FSH 水平(U/L)基础LH 水平(U/L)AMH(ng/mL)不孕类型[例(%)]原发不孕继发不孕不孕因素[例(%)]男方因素非男方因素双方因素取精方式[例(%)]射出精手术患者(n=56)31.46±3.80 5.75±2.83 2.67±0.57 21.57±2.66 5.62±2.33 3.71±1.38 5.75±4.09 45(80.36)11(19.64)40(71.43)3(5.36)13(23.21)43(76.79)13(23.21)
2.2 ICSI-AOA组和对照组的临床特征比较 患者两次治疗前后的启动时促性腺激素(gonadotropin,Gn)剂量,总Gn 剂量,促排时间,以及扳机日血清孕酮和雌二醇水平,子宫内膜厚度均差异无统计学意义(P>0.05),见表2。这表明两组之间的周期特征是相似的。
表2 ICSI-AOA 组和对照组的临床特征比较Tab.2 Comparison of clinical characteristics between ICSI-AOA and control groups ±s

表2 ICSI-AOA 组和对照组的临床特征比较Tab.2 Comparison of clinical characteristics between ICSI-AOA and control groups ±s
一般情况启动Gn 剂量(IU)总Gn 剂量(IU)促排时间(d)扳机日血清孕酮(nmol/L)扳机日血清雌二醇(pg/mL)子宫内膜厚度(mm)ICSI-AOA 组(n=56)181.69±59.60 2 093.02±819.55 10.86±1.93 2.56±1.79 12 649.81±5 786.688 10.45±2.14对照组(n=56)178.69±63.94 2 228.98±846.34 11.23±2.06 2.58±1.55 12 569.93±5 146.717 10.65±2.20 P 值0.822 0.449 0.394 0.935 0.944 0.656
2.3 ICSI-AOA组和对照组的实验室结果比较 如表3 所示,两组的获卵数目和注射MII 卵子数目分别为14.25 个、10.58 个以及13.44 个、10.02 个,两组之间的差异无统计学意义(P>0.05);ICSI-AOA 组的总受精率和正常受精率为75.38%和65.94%,显著高于对照组的17.87%和15.88%(P<0.001)。同时,ICSI-AOA 组的完全受精失败率和低受精率(1.79%、7.14%)都低于对照组(60.71%、39.29%),差异有统计学意义(P<0.001)。AOA 组的卵裂率为97.99%,其数值高于对照组的94.95%,但差异无统计学意义(P>0.05)。
ICSI-AOA组的D3可利用胚胎率以及优质胚胎率均显著高于对照组(42.24%vs.27.66%;14.88%vs.4.76%,P<0.05),相应地,无可利用胚胎周期率上,ICSI-AOA 组则显著低于对照组(25.0%vs.64.29%,P<0.05)。ICSI-AOA 组最终的囊胚形成率为14.89%,数值上高于对照组的8.00%,但差异无统计学意义(P>0.05)。AOA组中可利用胚胎来源的囊胚形成率为62.5%,由于对照中的可利用的胚胎数目有限,且被用于移植或玻璃化冻存,没有进行可利用胚胎的囊胚培养,因此没有此项数据,见表3。

表3 ICSI-AOA 组和对照组的实验室结果比较Tab.3 Comparison of laboratory outcomes between ICSI-AOA and control groups 例(%)
2.4 ICSI-AOA 组和对照组的临床结果比较 临床结局方面结果见表4,从取卵周期和移植周期分别计算临床妊娠率,ICSI-AOA组的分别为53.57%和55.56%,显著高于对照组的7.14%和21.05%(P<0.001)。种植率上,ICSI-AOA 组显著高于对照组(43.48%vs. 15.38%,P<0.001);在流产率上,ICSIAOA 组的数值低于对照组(7.41%vs. 10.53%),但差异无统计学意义(P>0.05)。从取卵周期和移植周期分别计算活产率,ICSI-AOA 组的分别为42.86%和44.44%,显著高于对照组的1.79%和5.26%(P<0.001)。
2.5 ICSI-AOA 组和对照组的新生儿结果比较 ICSI-AOA 组共有7 例双胎和17 例单胎妊娠,分娩31 例健康婴儿,原对照组分娩1 例健康婴儿。鉴于对照组分娩数据太少,选择本中心同期进行的常规ICSI 来源的997 例患者分娩数据作为对照组。如表5 所示,两组在产妇特征包括患者年龄、不孕类型,不孕因素、体质指数、不孕年限、移植胚胎个数、移植胚胎期、移植胚胎类型、分娩方式差异均无统计学意义(P>0.05);新生儿情况包括双胞胎比例、孕周、出生体质量、性别比(男性)、早产儿(<37 周)、大于胎龄儿(>40 周)以及低出生体质量(<2 500 g)和先天性缺陷方面均差异无统计学意义(P>0.05)。
表5 ICSI-AOA 组和常规ICSI 组新生儿情况比较Tab.5 Comparison ofneonatal outcomes between ICSI-AOA and conventional ICSI groups ±s
组别患者年龄不孕类型(率)原发不孕继发不孕不孕因素(率)男方因素女方因素双方因素体质指数(kg/m2)不孕年限(年)移植胚胎个数(率)1 2移植胚胎期(率)卵裂胚非卵裂胚移植胚胎类型(率)新鲜胚冷冻胚分娩方式(率)剖腹产阴道产新生儿情况(率)双胎率孕周出生体质量(kg)性别比(率,男)早产儿(率,<37周)大于胎龄儿(率,>40周)低出生体质量(率,<2 500 g)先天性缺陷ICSI-AOA组(n=24)30.67±4.22 21/24(87.50)3/24(12.50)17/24(70.83)3/24(12.50)4/24(16.67)21.56±2.61 5.67±3.00 5/24(20.83)19/24(79.17)15/24(62.50)9/24(37.50)8/24(33.33)16/24(66.67)18/24(75.00)6/24(25.00)7/24(29.17)37.88±1.94 2.92±0.40 18/31(58.06)7/31(22.58)2/31(6.45)7/31(22.58)0常规ICSI组(n=997)31.29±4.17 739/997(74.12)258/997(25.88)650/997(65.20)90(9.03)257(25.78)21.48±2.91 4.80±3.19 280/997(28.08)717/997(71.92)548/997(54.96)449/997(45.04)316/997(31.70)681/997(68.30)626/997(62.79)371/997(37.21)221/997(22.17)37.96±2.15 2.91±0.60 611/1 218(50.16)288/1 218(23.65)44/12 181(3.6)269/1 218(22.09)10/1 218(0.82)P值0.478 0.138 0.553 0.888 0.175 0.434 0.463 0.865 0.221 0.416 0.846 0.846 0.385 0.890 0.318 0.948 1.000
3 讨论
目前AOA 主要采用化学试剂钙离子载体(A23187 和离子霉素)的方法进行,其机制为将卵母细胞暴露于钙离子载体溶液中,使卵子胞质中的胞内钙离子水平立即显著升高,激活下游蛋白级联反应,从而完成卵子激活。已有研究中采用A23187 的治疗数据较多[14],但目前有研究认为采用离子霉素行AOA 的效果更好[15]。本研究中,笔者评估了采用离子霉素进行AOA 对前次ICSI 周期受精失败患者的治疗结果,这部分患者在接受ICSI-AOA 治疗之前,患有不孕症的平均年限为5.75年,并已经历平均2.67 个辅助生殖治疗周期。我们发现离子霉素显著提高了总受精率和正常受精率,降低了完全受精失败率和低受精率的概率。离子霉素处理提高了受精率,从而在第3 天提供了更多的可移植胚胎,显着降低了不可移植胚胎周期率(P<0.001)。意外的是,发现与对照组相比,AOA 组的优质胚胎率显著增加(14.88%vs.4.76%,P<0.05),提示离子霉素可能会改善胚胎的发育能力,这与既往的同类型研究明显不同[16]。此外,EBNER 等[17]在一项前瞻性研究中,通过排除重度男性因素不孕和ICSI 后受精率<30%的患者,因为这是进行辅助卵子激活的常规指征;然后他们通过Ca2+离子载体对胚胎发育完全停滞或迟缓,以及囊胚形成率低患者的研究,发现AOA 可以明显改善这些有胚胎发育问题患者的治疗结局。考虑到上述证据,认为离子霉素治疗在改善有胚胎发育障碍或ICSI 受精失败患者的胚胎质量方面具有巨大潜力。同时,还发现AOA 不仅提高了植入率,而且还显著增加了临床妊娠和活产率,这在以前同类型研究中未见报道[16]。本研究数据表明,离子霉素处理后提高了受精率,提供了更多的可利用胚胎,并会提高胚胎的发育能力,且提高了临床妊娠/活产率,改善了患者的治疗结局。
由于AOA应用于临床,其安全性一直是重要的关注点[18],DEEMEH等[19]采用离子霉素方案的AOA探讨其安全性,发现ICSI-AOA与常规ICSI在宫内死胎、早产、出生体质量、生长速度、新生儿重症监护室住院情况、年龄相关异常行为、新生儿身心健康等指标上差异均无统计学意义。MILLER等[20]研究发现,ICSI-AOA 和常规ICSI 出生新生儿的出生体质量、孕周和胎儿性别比上是相似的。本研究中,考虑到对照组样本量相对较小,采用同期常规ICSI患者新生儿数据作为对照组,发现AOA组同对照组在双胎比例、孕周、出生体质量、性别比等方面差异无统计学意义(P>0.05)。两组的早产(<37周)、大于胎龄儿(>40周)以及低出生体质量(<2 500 g)和先天性缺陷方面发生率相似(P>0.05)。
综上所述,本研究数据表明,离子霉素行AOA增加了受精率和可利用胚胎率;并提高了优质胚胎率,改善了胚胎的发育潜能。离子霉素处理还提高了着床率,增加了临床妊娠/活产率,以及累积妊娠/活产率。此外,离子霉素行AOA 没有增加与产科和新生儿结果相关的异常风险。需要指出的是,尽管本研究的样本量大于其他类似研究的样本量,但仍然存在样本量偏小,且为回顾性研究的局限性。因此,本研究认为离子霉素能够改善既往ICSI 后受精失败患者的治疗结局,但更大样本量的研究,尤其是安全性评估方面仍然是必要的。
