基于PI3K/Akt/Caspase-9信号通路研究严氏强心饮对心力衰竭大鼠心肌细胞凋亡的影响
2022-06-20朱思行严世芸陈丽云贾美君
朱思行,严世芸,徐 燕,秦 嫣,陈丽云*,贾美君*
1上海中医药大学科技人文研究院,上海 201203;2上海中医药大学附属曙光医院,上海 200021;3上海中医药大学附属市中医医院,上海 200071
心力衰竭(heart failure,HF)是心室舒张或收缩功能受损,以动脉缺血和/或静脉淤血为主要特征的一组临床综合征,常常是由于心脏结构或功能异常导致的,是大多数心血管疾病的最终归宿[1],常见于各种心脏疾病的危重期或晚期阶段。近年来,HF的患病率、病死率和再住院率居高不下[2],严重危害人们的身心健康。细胞凋亡是各种生物体内较常见的细胞死亡方式,心肌细胞数量减少是导致心肌功能障碍的决定性因素[3]。PI3K/Akt信号通路对细胞生长、合成、维持、凋亡等方面都起着重要的作用,研究表明,通过对PI3K/Akt信号通路的调节,减缓心肌细胞的凋亡进程是控制HF的有效途径[4-5]。
HF属于中医“心水”“心痹”“心悸”等范畴,其病机关键为阳虚不化、水饮内停、痰浊瘀阻等,温阳利水是HF的主要治法之一[6]。中医药在心脏治疗和康复方面疗效显著[7],有其独特优势。严氏强心饮是国医大师严世芸教授创制的治疗HF的经验方和基础方,具有补益心肾、温阳利水的作用。前期临床研究证明,严氏强心饮能够改善HF患者的临床症状,提高其生活质量[8-9]。但其具体作用机制尚不完全清楚。基于此,本研究拟构建阿霉素诱导的HF大鼠模型,观察严氏强心饮对HF大鼠的干预效果,并探讨其作用机制是否与PI3K/Akt信号通路的调控有关,为严氏强心饮的后续临床应用提供新的科学依据。
1 材料与方法
1.1 实验动物
选择SPF级Wistar雄性大鼠60只,体质量约200 g,购自北京维通利华实验动物技术有限公司(实验动物生产许可证号:SCXK2019-0001)。适应性喂养2周后,按体质量由高到低进行编号,采用随机数字表法分为正常组、模型组、严氏强心饮低剂量组、严氏强心饮中剂量组、严氏强心饮高剂量组和培哚普利组,每组10只。
1.2 实验药物
实验药物为严氏强心饮水煎液。严氏强心饮(制附子12 g,茯苓15 g,猪苓15 g,白术12 g,白芍12 g,淫羊藿20 g,补骨脂12 g,鹿角9 g)采用传统方法水煎并水浴浓缩,分别配制成含生药0.432 5、0.865、1.73 g/mL的提取液。所用中药均购自上海中医药大学附属曙光医院中药房。
1.3 主要试剂与设备
1.3.1 主要试剂 阿霉素(阿拉丁控股集团有限公司,A183027);培哚普利(MedChemExpress公司,HY-B0130);异氟烷(上海玉研科技有限公司,S10010533);BNP ELISA试剂盒(CUSABIO公司,CSB-E07972r);TUNEL试剂盒(Roche公司,116848 17910);DAPI试剂盒(Sigma公司,D9542);PI3K抗体(Abcam公司,ab191606);Akt抗体(4060T)、Caspase-9抗体(9507s)、Caspase-3抗体(9664T)均购自CST公司;Bax抗体(ab32503)、Bcl-2抗体(ab59348)均购自Abcam公司。
1.3.2 实验设备 超高分辨率小动物超声影像系统(VisualSonics公司,型号:Vevo2100);激光共聚焦显微镜(Leica公司,型号:TCSSPE);电泳仪(BIORAD公司,型号:165-8000)。
1.4 模型制备及干预方法
在避光条件下,用0.9%NaCl溶液将阿霉素粉针配成浓度1 mg/mL的溶液(避光),培哚普利配成浓度0.4 mg/mL的溶液。参照相关文献方法[10],除正常组外,其余各组大鼠每周按2 mg/(kg·d)的剂量给予尾静脉注射阿霉素溶液进行造模,共注射6周;正常组尾静脉注射等容积0.9%NaCl溶液。同时,严氏强心饮低、中、高剂量组分别给予低、中、高剂量严氏强心饮灌胃[11],各组含生药分别为4.325、8.65、17.3 g/(kg·d);培哚普利组予培哚普利溶液灌胃,剂量为4 mg/(kg·d)。灌胃剂量以10 mL/(kg·d)计算,正常组和模型组给予同体积蒸馏水灌胃。
1.5 观察指标
1.5.1 大鼠心脏超声检测 末次给药1 d后,将大鼠麻醉及心脏部位脱毛处理后,采用超高分辨率小动物超声影像系统(图像深度调为2 cm,频率为21 MHz)对大鼠进行M型超声心动图检测。主要测量指标包括左室射血分数(left ventricular ejection fraction,LVEF)、左室短轴缩短率(left ventricular fractional shortening,LVFS)、左室舒张末期内径(left ventricular internal dimension diastole,LVIDd)及左室收缩末期内径(left ventricular internal dimension systole,LVIDs)。
1.5.2 大鼠血清B型钠尿肽含量检测 心脏超声检查完毕后,对大鼠进行腹主动脉采血。血液静置2 h后离心(4℃,3 000 r/min,10 min)。利用ELISA试剂盒检测各组大鼠血清B型钠尿肽(B-typenatriuretic peptide,BNP)含量。操作步骤均严格按试剂盒说明书进行,分别设标准孔、空白孔、待测样品孔,每孔加入相应的试剂100μL,封板后置37℃温育2 h后,每孔先后加入100μL生物素抗体、100μL HRPavidin、90μL TMB,并置37℃孵育,避光显色后加入终止液终止反应,测量各孔的光密度值(optical density,OD)。
1.5.3 心肌组织病理学检测 用异氟烷麻醉大鼠后,在其膈肌处剪一横行切口,充分暴露胸腔,分离心包后迅速摘取大鼠心脏,用4℃克氏液冲洗干净后置于4℃克氏液中,于显微镜下快速分离主动脉和上、下腔静脉以及肺动脉、肺静脉,并用滤纸吸干表面水分。切取一部分左室心肌组织置入脱水盒内,用自动组织脱水机常规梯度脱水、透明、浸蜡后进行人工石蜡包埋,用石蜡切片机切片。将处理好的切片用4%多聚甲醛处理(室温)30 min后,置于二甲苯中脱蜡2次,5 min/次;再置于无水乙醇中浸泡5 min,95%乙醇中浸泡5 min,70%乙醇中浸泡5 min;然后用0.5%Txiton X-100处理(室温)5 min后,加入配置好的TUNEL标记液,37℃避光孵育60 min,加入DAPI染色液,孵育5 min;最后用抗荧光淬灭封片液封片,待干后用激光共聚焦显微镜,调至×200倍镜下观察心肌细胞凋亡情况并拍照,采用Image J软件计算心肌细胞凋亡指数。
心肌细胞凋亡指数=凋亡心肌细胞数/心肌总细胞数×100%
1.5.4 PI3K/Akt/Caspase-9信号通路蛋白表达水平及凋亡因子检测 将待测的大鼠左室心肌组织放置于培养皿中,加入1×RIPA 100μL的裂解液,待充分溶解后提取蛋白,并用BCA法检测蛋白浓度。取15μg总蛋白进行凝胶电泳(电压分别为80、120 V),再通过半干转将蛋白质转移至PVDF膜,转膜时间为90 min;用含5%脱脂奶粉的PBST封闭2 h后,孵于1∶1 000稀释好的一抗,4℃过夜。洗膜后加入以1∶2 000稀释的二抗,室温孵育2 h后,将膜放入发光成像仪中,滴加发光试剂曝光。以β-actin为内参,检测PI3K、Akt、Caspase-9、Caspase-3、Bcl-2和Bax的蛋白表达。
1.6 统计学方法
采用SPSS 26.0软件进行统计学分析。计量资料符合正态分布,数据采用(±s)表示,组间比较采用单因素方差分析,两两比较方差齐采用LSD-t检验,方差不齐用校正t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 6组大鼠存活情况
在造模及给药过程中,共有7只接受阿霉素注射的大鼠死亡,其中模型组、严氏强心饮低剂量组、严氏强心饮中剂量组、严氏强心饮高剂量组和培哚普利组分别死亡2、1、1、1、2只。最终纳入实验研究大鼠正常组、模型组、严氏强心饮低剂量组、严氏强心饮中剂量组、严氏强心饮高剂量组和培哚普利组分别为10、8、9、9、9、8只。
2.2 6组心脏超声检测结果比较
M模式下大鼠心脏超声结果显示,与正常组比较,模型组左室前壁运动波形不明显,接近直线运动,且LVEF、LVFS明显下降(P<0.05),LVIDd、LVIDs明显升高(P<0.05),左室明显扩大,收缩能力减弱,提示HF模型复制成功。给予不同剂量严氏强心饮干预后,严氏强心饮低、中、高剂量组左室前壁运动波形的幅度较模型组均有不同程度的增长,且随着给药浓度升高,LVEF、LVFS逐渐升高(P<0.05),LVIDd仅在严氏强心饮中剂量组降低(P<0.05)。与模型组比较,LVIDs在严氏强心饮中、高剂量组均明显降低(P<0.05),严氏强心饮中剂量组降低最明显(P<0.05)。与严氏强心饮中剂量组比较,严氏强心饮高剂量组LVIDd、LVIDs差异均无统计学意义(P>0.05)。见图1、表1。
2.3 6组血清BNP含量比较
与正常组比较,模型组BNP含量明显升高(P<0.05)。与模型组比较,严氏强心饮低、中、高剂量组BNP含量均明显降低,且随着给药浓度的升高,BNP含量呈下降趋势(P<0.05)。见表2。

图1 6组大鼠心脏超声检测图Figure 1 Cardiac ultrasound patterns in six groups
表1 6组心脏超声检测指标比较(±s)Table 1 Comparison of cardiac ultrasound in six groups(±s)
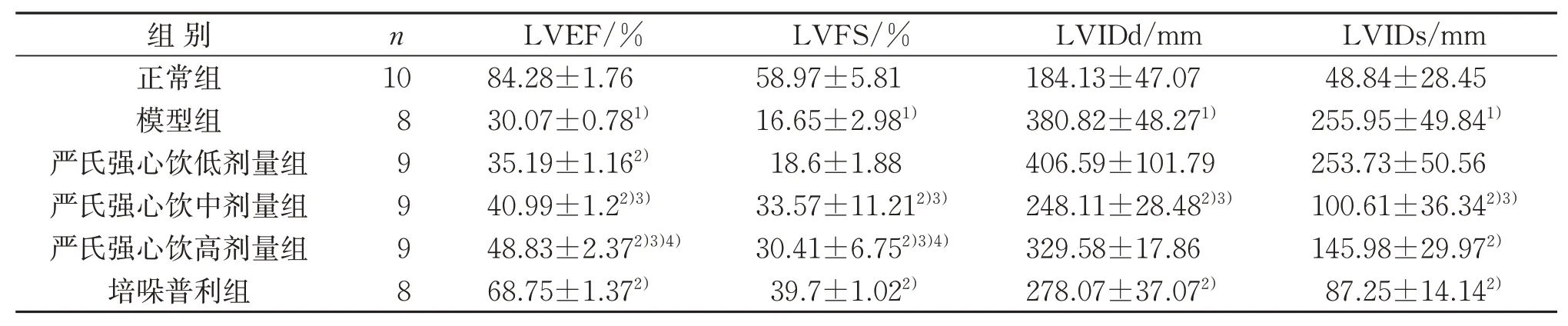
表1 6组心脏超声检测指标比较(±s)Table 1 Comparison of cardiac ultrasound in six groups(±s)
注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05;与严氏强心饮低剂量组比较,3)P<0.05;与严氏强心饮中剂量组比较,4)P<0.05。Note:Compared with the normal group,1)P<0.05;compared with the model group,2)P<0.05;compared with the low dose Yanshiqiangxin decoction group,3)P<0.05;compared with the mediumdose Yanshiqiangxin decoction group,4)P<0.05.
组别正常组模型组严氏强心饮低剂量组严氏强心饮中剂量组严氏强心饮高剂量组培哚普利组n 10 8 9 9 9 8 LVEF/%84.28±1.76 30.07±0.781)35.19±1.162)40.99±1.22)3)48.83±2.372)3)4)68.75±1.372)LVFS/%58.97±5.81 16.65±2.981)18.6±1.88 33.57±11.212)3)30.41±6.752)3)4)39.7±1.022)LVIDd/mm 184.13±47.07 380.82±48.271)406.59±101.79 248.11±28.482)3)329.58±17.86 278.07±37.072)LVIDs/mm 48.84±28.45 255.95±49.841)253.73±50.56 100.61±36.342)3)145.98±29.972)87.25±14.142)
表2 6组大鼠血清BNP含量比较(±s) pg/mLTable 2 Comparison of serum BNP content in six groups(±s) pg/mL
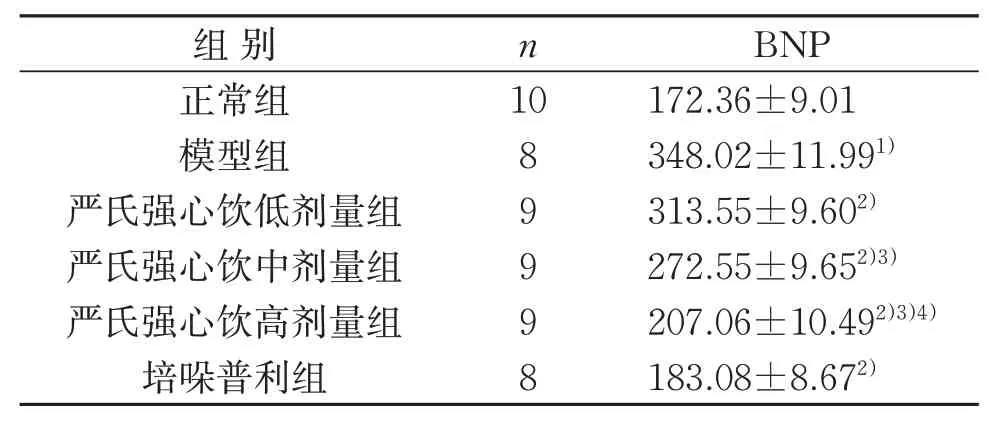
表2 6组大鼠血清BNP含量比较(±s) pg/mLTable 2 Comparison of serum BNP content in six groups(±s) pg/mL
注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05;与严氏强心饮低剂量组比较,3)P<0.05;与严氏强心饮中剂量组比较,4)P<0.05。Note:Compared with the normal group,1)P<0.05;compared with the model group,2)P<0.05;compared with the low dose Yanshiqiangxin decoction group,3)P<0.05;compared with the medium dose Yanshiqiangxin decoction group,4)P<0.05.
组别正常组模型组严氏强心饮低剂量组严氏强心饮中剂量组严氏强心饮高剂量组培哚普利组n 10 8 9 9 9 8 BNP 172.36±9.01 348.02±11.991)313.55±9.602)272.55±9.652)3)207.06±10.492)3)4)183.08±8.672)
2.4 6组心肌组织病理学检测结果比较
心肌组织细胞由DAPI+TUNEL双染色后,两者图像经软件融合后得到merge图片,其中阳性凋亡细胞核呈绿色荧光。图像中的心肌细胞凋亡免疫荧光结果显示:正常组细胞基本没有凋亡,几乎检测不到阳性信号;经阿霉素造模后,模型组大鼠心肌细胞凋亡较正常组明显增加(P<0.05);与模型组比较,培哚普利组细胞凋亡数最少(P<0.05),随着严氏强心饮浓度的升高,其细胞凋亡数量呈下降趋势(P<0.05)。见表3、图2。
表3 6组心肌细胞凋亡情况比较(±s) %Table 3 Comparison of cardiomyocyte apoptosis in six groups(±s) %

表3 6组心肌细胞凋亡情况比较(±s) %Table 3 Comparison of cardiomyocyte apoptosis in six groups(±s) %
注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05;与严氏强心饮低剂量组比较,3)P<0.05;与严氏强心饮中剂量组比较,4)P<0.05。Note:Compared with the normal group,1)P<0.05;compared with the model group,2)P<0.05;compared with the low dose Yanshiqiangxin decoction group,3)P<0.05;compared with the medium dose Yanshiqiangxin decoction group,4)P<0.05.
组别正常组模型组严氏强心饮低剂量组严氏强心饮中剂量组严氏强心饮高剂量组培哚普利组n 10 8 9 9 9 8心肌细胞凋亡指数0.01±0.01 58.93±3.461)52.13±1.36 35.87±2.482)3)15.40±2.162)3)4)9.53±0.702)

图2 6组心肌组织病理学检测图(×200)Figure 2 Myocardial histopathology figure in six groups(×200)
2.5 6组PI3K/Akt/Caspase-9信号通路蛋白表达水平比较
与正常组相比,模型组PI3K、Akt蛋白表达降低,Caspase-9、Caspase-3蛋白表达升高。与模型组比较,严氏强心饮低、中、高剂量组PI3K、Akt蛋白表达均明显升高(P<0.05),且随着给药浓度升高而逐渐升高(P<0.05),严氏强心饮低、中、高剂量组Caspase-9、Caspase-3蛋白表达均明显降低(P<0.05),且随着给药浓度升高而逐渐降低(P<0.05)。见图3、表4。
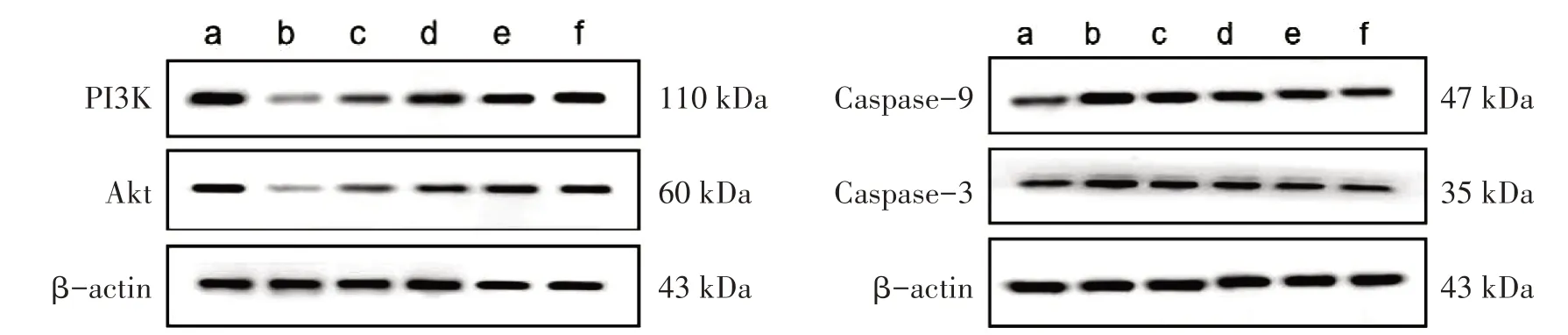
图3 6组PI3K/Akt/Caspase-9信号通路蛋白表达Figure 3 Expression of PI3K,Akt,Caspase-9 signaling pathway protein in six groups
表4 6组PI3K、Akt、Caspase-9信号通路蛋白表达比较(±s)Table 4 Comparison of expression of PI3K/Akt/Caspase-9 signaling pathway protein in six groups(±s)

表4 6组PI3K、Akt、Caspase-9信号通路蛋白表达比较(±s)Table 4 Comparison of expression of PI3K/Akt/Caspase-9 signaling pathway protein in six groups(±s)
注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05;与严氏强心饮低剂量组比较,3)P<0.05;与严氏强心饮中剂量组比较,4)P<0.05。Note:Compared with the normal group,1)P<0.05;compared with the model group,2)P<0.05;compared with the low dose Yanshiqiangxin decoction group,3)P<0.05;compared with the mediumdose Yanshiqiangxin decoction group,4)P<0.05.
组别正常组模型组严氏强心饮低剂量组严氏强心饮中剂量组严氏强心饮高剂量组培哚普利组n 10 8 9 9 9 8 PI3K 1.50±0.25 0.39±0.031)0.74±0.112)1.03±0.192)3)1.15±0.082)3)4)1.26±0.222)Akt 1.49±0.41 0.74±0.41)0.95±0.382)1.09±0.362)3)1.27±0.372)3)4)1.34±0.392)Caspase-9 0.42±0.05 1.00±0.091)0.89±0.142)0.77±0.112)3)0.65±0.072)3)4)0.51±0.082)Caspase-3 0.41±0.05 1.01±0.231)0.87±0.242)0.73±0.162)3)0.56±0.122)3)4)0.46±0.072)
2.6 6组心肌组织凋亡因子比较
与正常组比较,模型组Bcl-2含量、Bcl-2/Bax比值均明显降低,而Bax含量明显升高(P<0.05)。与模型组比较,严氏强心饮低、中、高剂量组Bcl-2含量明显升高(P<0.05),随着严氏强心饮浓度的升高而逐渐增多(P<0.05);严氏强心饮中、高剂量组Bax含量随着严氏强心饮浓度的增加而逐渐下降(P<0.05),而Bcl-2/Bax比值随着给药浓度升高而逐渐提高(P<0.05)。见图4、表5。
3 讨 论
3.1 严氏强心饮可改善HF大鼠心脏功能,减少心肌细胞凋亡

图4 6组心肌组织凋亡因子检测结果Figure 4 Myocardial tissue apoptosisfactor assay results in six groups
经胸超声心动图是评估心脏结构和功能的首选方法,LVEF可反映左心室收缩功能[11-12]。本研究结果显示,严氏强心饮低、中、高剂量组LVEF、LVFS逐渐升高,且严氏强心饮高剂量组改善效果更明显;严氏强心饮中剂量组LVIDd降低,与模型组比较,严氏强心饮中、高剂量组LVIDs均明显降低,这提示严氏强心饮可改善HF大鼠心脏功能。BNP主要由心室肌合成,当心脏负荷增大或心室扩大时,心肌细胞受牵拉而合成并释放BNP入血增加,血浆BNP含量升高,并与心功能损伤的严重程度呈显著正相关,故血清BNP的检测被推荐用于HF筛查、诊断和鉴别诊断、病情严重程度及预后评估[13-14]。本研究结果显示,HF大鼠血清BNP含量、心肌细胞凋亡数量随着严氏强心饮浓度的升高而逐渐降低,这提示严氏强心饮能够有效抑制HF大鼠心肌细胞的凋亡,且呈一定剂量依赖性,提高HF大鼠的心脏功能。
表5 6组心肌组织凋亡因子比较(±s)Table 5 Comparison of myocardial tissue apoptosis factor in six groups(±s)

表5 6组心肌组织凋亡因子比较(±s)Table 5 Comparison of myocardial tissue apoptosis factor in six groups(±s)
注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05;与严氏强心饮低剂量组比较,3)P<0.05;与严氏强心饮中剂量组比较,4)P<0.05。Note:Compared with the normal group,1)P<0.05;compared with the model group,2)P<0.05;compared with the low dose Yanshiqiangxin decoction group,3)P<0.05;compared with the mediumdose Yanshiqiangxin decoction group,4)P<0.05.
组别正常组模型组严氏强心饮低剂量组严氏强心饮中剂量组严氏强心饮高剂量组培哚普利组n 10 8 9 9 9 8 Bcl-2 1.02±0.13 0.27±0.061)0.45±0.112)0.66±0.112)3)0.86±0.102)3)4)0.89±0.132)Bax 0.77±0.11 1.58±0.041)1.50±0.10 1.31±0.042)3)1.10±0.042)3)4)1.02±0.042)Bcl-2/Bax 0.23±0.02 0.03±0.011)0.05±0.02 0.09±0.022)3)0.16±0.052)3)4)0.15±0.032)
3.2 严氏强心饮改善HF大鼠心脏功能可能与PI3K/Akt/Caspase-9信号通路调节有关
本研究结果显示,与模型组比较,随着严氏强心饮给药浓度升高PI3K、Akt、Bcl-2蛋白表达以及Bcl-2/Bax比值均逐渐升高,而Caspase-9、Caspase-3、Bax蛋白表达均逐渐降低。这提示严氏强心饮改善HF大鼠心脏功能可能与调节PI3K/Akt/Caspase-9信号通路有关。PI3K/Akt信号通路的激活,可以通过直接或间接的形式抑制细胞凋亡,从而减缓心力衰竭的发展进程[15]。Caspase家族分为包括Caspase-9在内的凋亡启动因子和包括Caspase-3在内的凋亡执行因子两类[16],两者都是Akt下游的靶蛋白,是各类细胞凋亡的最好途径,其能够破坏细胞骨架,裂解DNA,导致细胞凋亡[17]。因此,对Caspase-9和Caspase-3蛋白表达的调节,是有效抑制心肌细胞凋亡的关键。严氏强心饮可以激活PI3K/Akt信号通路,使Akt活化后,降低Caspase-9表达,抑制Caspase级联反应,使下游的Caspase-3不被激活,实现调控细胞凋亡的启动和执行程序,抑制细胞凋亡,从而减缓心力衰竭的发展进程。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax之间的平衡是调控细胞凋亡的关键[18],严氏强心饮可以激活PI3K,促使其下游的Akt发生磷酸化而被激活参与信号传导,从而促进Bcl-2的释放并抑制Bax的表达,增加HF大鼠心肌细胞抗凋亡能力,减少心肌细胞的凋亡数量。
4 小 结
严氏强心饮能够有效降低HF大鼠血清BNP水平,减少心肌细胞凋亡数量,改善HF大鼠心脏功能,并能上调PI3K、Akt、Bcl-2蛋白表达,下调Caspase-9、Caspase-3、Bax蛋白表达,提示其保护心肌细胞凋亡的作用机制可能与调节PI3K/Akt/Caspase-9信号通路有关。
