有氧跑台运动调控葡萄糖转运蛋白9对高尿酸血症大鼠肾脏功能的影响
2022-06-20梁家榕寸勇丹王丽欢李仪杰
梁家榕,杨 焕,寸勇丹,王丽欢,李仪杰,叶 斌
云南中医药大学第二临床医学院,云南 昆明 650500
高尿酸血症(hyperuricemia,HUA)是导致慢性肾脏损伤[1]、代谢综合征[2]、痛风[3]、高血压[4]等疾病的重要危险因素,而嘌呤代谢异常[5]和尿酸排泄[6]不足所导致的血尿酸升高是其发病基础。近年来,随着富含嘌呤食物摄入量的逐渐增加,我国HUA的发病率逐年增高[7]。研究指出,截至2017年底中国HUA确诊病例已达到1.7亿例,其中女性发病率为7.9%,男性发病率为19.4%[8]。目前临床治疗HUA主要采用别嘌醇、非布司他、苯溴马龙等药物控制,虽有一定效果,但存在诱发痛风急性症状、损伤肝肾组织和停药易复发等副作用[9]。因此,寻找一种副作用小且疗效显著的治疗方法一直是临床关注的重点。近年来,“运动是良医”的观念已深入人心[10],科学合理的运动可以有效预防疾病、提高生活质量。实验研究显示运动疗法可以治疗代谢性疾病[11-12]。临床研究显示,有氧运动可以起到增加脂肪代谢、降低血尿酸等作用[13-14]。目前关于有氧运动可以改善HUA患者血尿酸水平的机制研究主要集中于调控尿酸转运体三磷酸腺苷结合盒转运蛋白G2[ATP-binding cassette superfamily G(White)member 2,ABCG2][15],但ABCG2是通过调节肾脏排泄尿酸,还是促进肾脏尿酸重吸收尚不明确。葡萄糖转运蛋白9(glucose transporter 9,GLUT-9)作为肾脏组织中广泛表达的葡萄糖转运蛋白家族的成员之一,在尿酸(uric acid,UA)的重吸收过程中具有不可或缺的作用[16]。本研究尝试通过实验研究验证有氧运动是否通过调节肾脏尿酸重吸收以达到降低HUA患者血尿酸的作用。
1 材料与方法
1.1 实验动物
选择SPF级雄性SD大鼠24只,6~8周龄,初始体质量200~220 g,由湖南斯莱克景达实验动物有限公司提供,实验动物质量合格证编号:SYXK(滇)K2017-0005,实验动物生产许可证编号:SCXK(湘)2019-0004。每笼4只,自由饮食、饮水,饲养环境温度20~25℃,湿度50%~60%,人工光照12 h∶12 h明暗交替(8∶00—20∶00),更换垫料1次/2 d。本次动物实验严格遵循动物伦理原则,经云南中医药大学实验动物伦理委员会批准(审批号:R-062021006)。
1.2 主要实验试剂与设备
氧嗪酸钾(上海源叶生物科技有限公司,S17112);尿酸(uric acid,UA)试剂盒、肌酐(creatinine,Cre)试剂盒、尿素氮(blood urea nitrogen,BUN)试剂盒(南京建成科技有限公司,货号:C012-2-1、C011-2-1、C013-2-1);大鼠白细胞介素1β(interleukin-1β,IL-1β)ELISA试剂盒(江苏酶免实业有限公司,MM-0047R1);Caspase-1、IL-1β、GLUT-9抗体(武汉三鹰生物技术有限公司,货号:22915-1-AP、16806-1-AP、26486-1-AP);4%多聚甲醛溶液(武汉赛维尔生物科技有限公司,G1101);台式高速低温离心机(德国Hettich科学仪器有限公司,Mikro185型);-80℃超低温冰箱(中国海尔集团公司,DW-86L828J型);气体麻醉机(北京众实迪创科技发展有限责任公司,ZS-MV-IDV型);全波长酶标仪(瑞士Tccan有限公司,SPARK10M型);荧光及化学发光成像系统(上海勤翔科学仪器有限公司,ChemiScope 6000 pro型);冰冻切片机(北京莱比信仪器有限公司,MEV型);倒置荧光显微镜成像系统(上海尼康仪器有限公司,Ti-S型);动物实验跑台(上海继德教学实验器材厂,JD-PT型);实验室纯水机(重庆华创水处理工程有限公司,GYJ1-10L-S型)。
1.3 实验方法
1.3.1 实验动物分组及模型制备 将24只雄性SD大鼠编号,采用Excel生成随机数字表(1~8),任意选择随机数字表中的一个数字作为起始点并对应大鼠编号1,从左到右、自上而下分别对应1~24号大鼠。用随机数字除以3所得到的余数以确定每只大鼠的分组,余数0、1、2分别对应对照组、模型组和有氧跑台运动组(运动组),每组8只。
每天9∶00,对照组按照剂量2 g/(kg·d)蒸馏水灌胃;模型组、运动组采用氧嗪酸钾(oxonic aid potassium salt,OAPS)灌胃造模,剂量2 g/(kg·d),连续灌胃造模10 d,第10天灌胃结束后1 h,大鼠眼眶后静脉丛取血检测血UA含量,若模型组、运动组血UA浓度比对照组血UA浓度明显升高(P<0.05),则表示HUA大鼠模型造模成功[17]。
1.3.2 干预方法
1.3.2.1 对照组 第11天起,对照组改为隔天9∶00蒸馏水灌胃。不限制饮食及饮水,鼠笼中自由运动,不进行其他干预,共持续3周。
1.3.2.2 模型组 第11天起,模型组改为隔天9∶00 OAPS灌胃以维持干预期间持续高尿酸状态,剂量为2 g/(kg·d),不限制饮食及饮水,鼠笼中自由运动,不进行其他干预,共持续3周。
1.3.2.3 运动组 第11天起,运动组改为隔天9∶00 OAPS灌胃以维持干预期间持续高尿酸状态,剂量为2 g/(kg·d)。每天10∶00将其放入实验动物跑台中进行有氧跑台运动训练,速度12 m/min,20 min/次,1次/d,每周训练6 d,休息1 d,持续3周。
1.4 观察指标
1.4.1 肾脏病理学改变 处理后的大鼠,仰卧位放置于解剖台上,打开腹腔摘取肾脏组织,剥去肾脏组织被膜,左肾放入冻存管中,于-80℃冰箱冷冻保存;右肾经4%多聚甲醛固定,样本固定状态良好后,分别将样本放入80%、90%、95%、100%不同浓度乙醇中脱水2 h,脱水后的组织浸入蜡块包埋,将含有组织的蜡块放入切片机中,调整切片厚度15μm。蜡带平铺在载玻片上后放入恒温烘箱内脱去并熔化组织间隙的石蜡。制备好的石蜡切片经过二甲苯脱蜡后,采用苏木精-伊红染色法(hematoxylineosin staining,HE)进行染色。首先,将脱蜡后的切片放入100%、90%、80%、70%不同浓度乙醇浸泡5 min,苏木精染色5 min后,5%乙酸分化1 min,伊红染色1 min,再进行70%、80%、90%、100%乙醇清洗10 s,二甲苯浸泡1min后通风处风干5 min,封片,显微镜(×400)下拍照,观察肾脏组织肾小管及肾小球结构变化。
1.4.2 肾脏功能检测 3组末次干预结束后1 h,采用腹腔注射戊巴比妥钠麻醉过量处死所有大鼠,待大鼠死亡后,仰卧位放置于解剖台上,打开胸腔暴露心脏,采用10 mL一次性注射器从大鼠心尖部快速抽取约5 mL心尖血,室温下静置1 h,于离心机上离心(3 500 r/min,20 min,-4℃),取上层血清,用于检测UA、肌酐(creatinine,Cre)、尿素氮(blood urea nitrogen,BUN)等肾脏功能指标。将UA、Cre和BUN试剂盒从冰箱中取出在室温环境下放置20 min;将所有血清样本及标准品加入离心管中;按照说明书步骤操作,在酶标仪690 nm波长下测定各孔的吸光度。
1.4.3 血清、肾脏炎性因子含量 将5 mL大鼠心尖血液放入低温高速离心机中,3 500 r/min,4℃,离心20 min,将离心出的血清转移至新的离心管-80℃冷冻保存。准确称取肾脏组织质量,按照1∶9比例加入9倍肾脏组织体积的磷酸盐缓冲溶液(phosphate buffer saline,PBS),放入高速低温自动研磨仪中研磨2 min,制备成10%匀浆液,3 500 r/min,离心10 min,取上清液测定。将ELISA试剂盒从冰箱中取出放置于室温下20 min;加样后将酶标板放置于37℃培养箱中孵育30 min;洗板5次后每孔加入酶标试剂50μL;再次37℃培养箱中孵育30 min;每孔加入显色液A、B各50μL;避光37℃培养箱中孵育10 min;每孔加入终止液50μL在酶标仪450 nm波长下测定各孔吸光度,根据各浓度标准品所制作的标准曲线得出公式并将各孔吸光度值代入公式计算出每个样本中白介素-1β(interleukin-1β,IL-1β)的含量。
1.4.4 肾脏组织蛋白表达 采用Western blot法检测肾脏组织中半胱氨酸天冬氨酸蛋白酶1(cysteinyl aspartate specific proteinase 1,Caspase-1)、IL-1β和GLUT-9的表达。每个样本(约0.03 g)中加入700μL细胞裂解液,冰上操作研磨5 min,离心后取上清,并进行蛋白定量;加入Marker及蛋白样本;80 V电压电泳30 min后转为120 V电泳1 h,剪裁大小适合聚偏氟乙烯(Poly vinylidene fluoride,PVDF)膜进行转膜,300 mA电流转膜1 h。弃去胶块,裁剪出相应蛋白分子量所在的条带,用5%脱脂奶粉室温下封闭2 h。TBST缓冲液洗膜3次,5 min/次,配置抗Caspase-1、IL-1β和GLUT-9抗体(1∶500)进行孵育,过夜。次日,一抗回收,TBST缓冲液洗膜,二抗(1∶2 000)室温下孵育1 h,TBST缓冲液洗膜3次,配置ECL底物发光液。采用ChemiScope 6000 pro成像分析系统曝光扫描,将检测得出的目标条带及内参条带灰度值进行比较得出比值。
1.5 统计学方法
采用SPSS25.0软件进行数据分析,采用Graphpad Prism 7.04软件绘制统计图。数据符合正态分布,采用(±s)表示,组间比较采用单因素方差分析,两两比较方差齐采用LSD-t检验,方差不齐则采用Dunnett's T3检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 3组肾脏组织病理变化
HE染色病理分析结果显示,对照组肾脏组织未见明显病理改变;模型组肾脏组织被膜不完整,肾小球变形萎缩,肾小管排列紊乱,上皮细胞胞质出现空泡化,肾小管间质内大量炎性细胞浸润,局部间质内细胞点状坏死,可见核固缩、崩解和碎裂,血管周围纤维组织增生,见细胞核呈长梭形或长椭圆形的成纤维细胞增多;运动组肾脏组织炎性细胞浸润数量明显减少,肾小管结构较为完整,肾小管上皮细胞胞质空泡化等病理改变明显减轻。见图1。

图1 3组肾脏组织病理变化图(×400)Figure 1 Pathological changesof kidney tissues in three groups(×400)
2.2 3组血清UA、Cre、BUN含量比较
与对照组比较,模型组、运动组血清UA、BUN和Cre水平明显升高(P<0.05);与模型组比较,运动组血清UA、BUN和Cre水平明显降低(P<0.05)。见表1。
表1 3组血清UA、BUN、Cre含量比较(±s) μmol/LTable1 Comparison of serum UA,BUN,and Cre contents in three groups(±s) μmol/L

表1 3组血清UA、BUN、Cre含量比较(±s) μmol/LTable1 Comparison of serum UA,BUN,and Cre contents in three groups(±s) μmol/L
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。Note:Compared with the Contorl group,1)P<0.05;compared with the Model group,2)P<0.05.
组别对照组模型组运动组n8 8 8血清UA浓度108.17±14.79 355.44±52.901)267.52±64.441)2)血清BUN浓度20.97±1.78 40.87±2.321)32.19±2.041)2)血清Cre浓度38.97±6.81 68.85±8.191)57.35±8.271)2)
2.3 3组血清及肾脏IL-1β含量比较
与对照组比较,模型组、运动组大鼠血清和肾脏中IL-1β的表达水平明显升高(P<0.05),与模型组比较,运动组大鼠血清和肾脏组织中IL-1β明显降低(P<0.05)。见表2。
表2 3组血清及肾脏IL-1β含量比较(±s)Table2 Comparison of IL-1βcontent of serum and renal in three groups(±s)
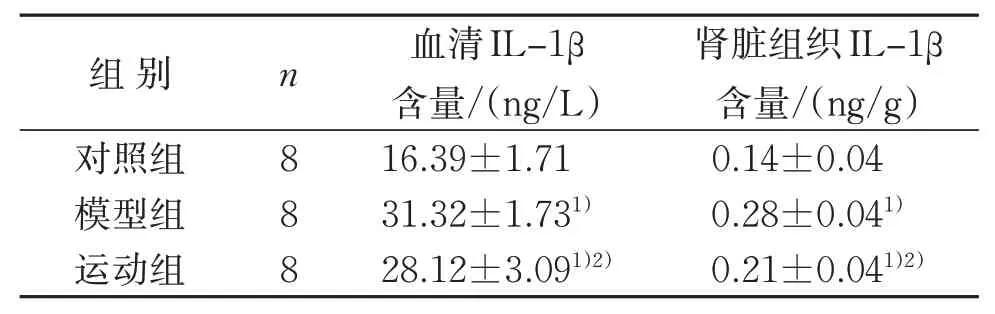
表2 3组血清及肾脏IL-1β含量比较(±s)Table2 Comparison of IL-1βcontent of serum and renal in three groups(±s)
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。Note:Compared with the Contorl group,1)P<0.05;compared with the Model group,2)P<0.05.
组别对照组模型组运动组n 8 8 8血清IL-1β含量/(ng/L)16.39±1.71 31.32±1.731)28.12±3.091)2)肾脏组织IL-1β含量/(ng/g)0.14±0.04 0.28±0.041)0.21±0.041)2)
2.4 3组Caspase-1、IL-1β、GLUT-9蛋白表达水平比较
与对照组比较,模型组、运动组肾脏组织中Caspase-1、IL-1β和GLUT-9的蛋白表达明显升高(P<0.05);与模型组比较,运动组大鼠肾脏组织中Caspase-1、IL-1β和GLUT-9蛋白表达明显降低(P<0.05)。见表3、图2。
表3 3组Caspase-1、IL-1β和GLUT-9蛋白表达比较(±s)Table 3 Comparison of caspase-1,IL-1βand GLUT-9 protein expression in three groups(±s)

表3 3组Caspase-1、IL-1β和GLUT-9蛋白表达比较(±s)Table 3 Comparison of caspase-1,IL-1βand GLUT-9 protein expression in three groups(±s)
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。Note:Compared with the Contorl group,1)P<0.05;compared with the Model group,2)P<0.05.
组别对照组模型组运动组n 8 8 8 Caspase-1蛋白1.00±0.00 1.77±0.251)1.40±0.071)2)IL-1β蛋白1.00±0.00 1.53±0.141)1.25±0.161)2)GLUT-9蛋白1.00±0.00 1.70±0.211)1.29±0.231)2)
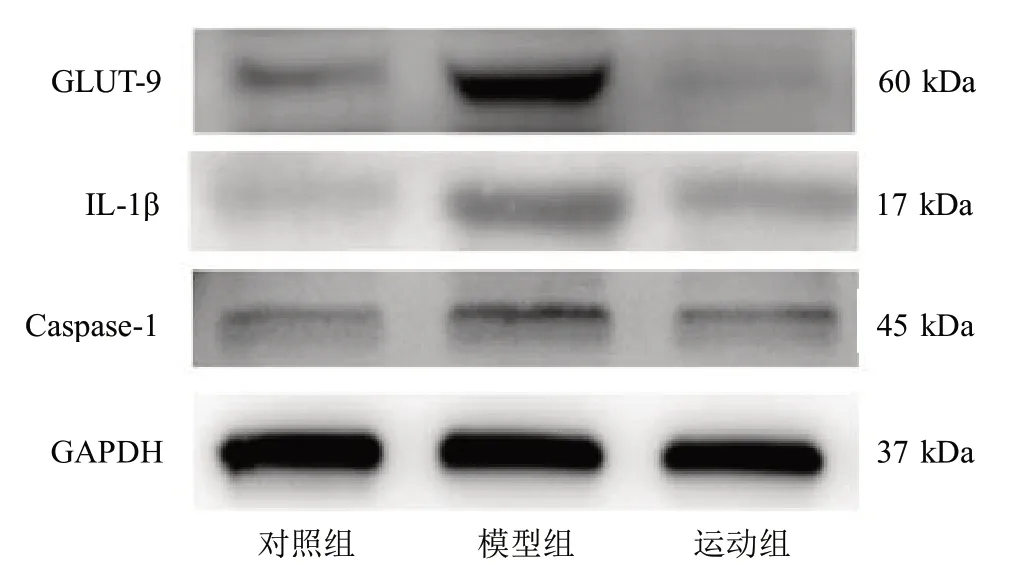
图2 3组Caspase-1、IL-1β和GLUT-9蛋白电泳图Figure 2 Protein electrophoresisof Caspase-1,IL-1βand GLUT-9 in three groups
3 讨 论
本研究结果显示,与模型组比较,运动组血清UA、Cre、BUN、IL-1β含量均出现明显降低。这提示,有氧跑台运动训练可以降低OAPS诱导的高尿酸血症模型大鼠尿酸和炎症水平,改善肾脏损伤。此外,结果显示,与模型组比较,运动组Caspase-1、IL-1β、GLUT-9蛋白表达明显降低,这提示有氧跑台运动训练可以下调Caspase-1、IL-1β和GLUT-9蛋白表达,促进尿酸的重吸收并减轻HUA大鼠肾脏的炎症反应以实现肾脏保护作用。这可能与以下因素有关:①HUA患者体内血UA浓度长期处于较高的水平,而UA主要由肾脏排泄,UA排泄不足会导致肾脏损伤,而有氧运动可以加速血液循环,促进机体新陈代谢,加速HUA患者体内UA排泄,改善肾脏功能[17-18]。这与SUN等[14,19-20]研究发现12周的有氧训练可有效降低慢性病患者血尿酸、血糖等生化指标的结果一致。②炎症反应是HUA肾脏损伤的关键病理过程,HUA患者体内可析出UA晶体,而该晶体可激活含NLR家族PYRIN域蛋白3(recombinant NLR family,pyrin domain containing protein 3,NLRP3)-IL-1β信号通路以及Toll样受体4(Tolllike receptor 4,TLR4)-核因子κB(nuclear factorkappa B,NF-κB)-Caspase-1信号通路,参与炎症反应,使患者体内炎性因子累积,加重肾脏损伤[21-23],甚至可能导致肾脏衰竭。有氧跑台训练可以降低HUA患者体内UA水平,抑制Caspase-1、IL-1β蛋白的表达,减轻肾脏炎症反应[23-25]。③GLUT-9转运蛋白主要存在于近曲小管的顶端和基底外侧膜上,是维持体内尿酸稳态主要的调节因子[15,26-27],人体内UA清除与GLUT-9特定转运蛋白密切相关。有氧跑台运动训练可以降低GLUT-9转运蛋白表达,促进患者体内尿酸重吸收,降低患者肾脏炎症水平,从而改善肾脏功能。这提示,有氧跑台运动训练改善HUA模型大鼠肾脏功能的具体机制可能与抑制GLUT-9蛋白表达有关。这与LIU等[28-29]研究结果相似。
4 小 结
有氧跑台运动可以降低OAPS诱导的高尿酸血症模型大鼠UA水平,减轻肾脏炎性反应,改善肾脏功能。但本研究仍存在一些不足之处,如未就有氧跑台运动训练抑制GLUT-9表达的具体机制进行探讨;未就GLUT-9与其他可能影响尿酸排泄因素(如有机阴离子转运蛋白等)的协同作用进行深入探讨。
