运动预处理对心肌缺血再灌注损伤老龄大鼠心肌细胞自噬和凋亡的影响
2022-06-20李宏玉王艳霞李宇婷朱路文
李宏玉,尹 侠,王艳霞,李宇婷,朱路文,唐 强
1黑龙江中医药大学,黑龙江 哈尔滨 150040;2黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;3黑龙江中医药大学附属第四医院,黑龙江 哈尔滨 150070
缺血性心脏病具有高发病率、高致死率的特点。发病人群主要以中老年人为主,但近年来患病人群呈逐渐年轻化趋势。临床治疗大多以药物治疗或介入手术治疗以开通狭窄或被堵塞的心血管,保证血液供应的通畅。但对缺血心肌组织进行复灌治疗后,会出现心肌损伤程度进一步加重,这种现象被称为心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)[1-2]。自噬是心肌缺血和再灌注的显著特征,参与了MIRI的病理过程,研究发现再灌注过程中过度自噬会造成心肌细胞自噬性凋亡,从而加重心肌组织损伤[3-4]。此外,随着心肌衰老,心肌细胞处于缺氧状态,会产生大量氧自由基,心肌会受到不同程度的损伤,从而导致细胞凋亡[5-6]。自噬对MIRI有“双刃剑”作用,一方面自噬可以降解应激状态下氧化自由基,同时防止异常蛋白质的聚集;另一方面,自噬的过度活跃会造成自噬应激,损伤细胞器,对细胞有损害。因此,如何调控自噬程度是发挥“双刃剑”作用的核心。
缺血预适应(ischemic preconditioning,IPC)是迄今为止最有效的内源性心肌缺血保护方法[7]。运动预适应(exercise preconditioning,EP)是缺血预适应的一种,通过短时间内反复间歇性大强度的有氧运动训练,激发机体免疫系统应激机制,诱导机体产生内源性保护物质,提高心肌对缺氧、缺血损伤的耐受能力,从而对机体心肌起保护作用,在临床疾病预防中应用可行性较强。研究显示,通过运动预处理诱导细胞自噬和凋亡,进而启动下游事件发挥老龄心肌IPC保护作用[8-9]。但其具体作用机制尚不完全清楚。本研究将在离体心脏灌流模型上,通过抑制自噬,观察运动预处理对老龄大鼠IPC心肌细胞自噬、凋亡的影响,探讨其可能的作用机制,这也许可以为老龄心肌MIRI的防治提供一种新思路、新靶点和新的干预方法。
1 实验材料
1.1 实验动物
选择SPF级雄性Sprague-Dawley老龄大鼠80只,鼠龄15~18个月,体质量(450±20)g,购买于黑龙江中医药大学药物安全性评价中心[动物使用许可证号:SYXK(黑)2019002]。饲养环境:通风良好,自由饮水,人工光照12 h/12 h明暗交替、温度(21±2)℃,湿度(60±5)%的标准屏障环境。
1.2 主要仪器与试剂
ZH-PT型动物实验跑台(徐州利华电子公司);Langendorff离体心脏灌流实验系统(江苏赛昂斯生物技术有限公司);-80℃超低温冰箱(日本Panasonic公司);DAB显色液(中杉金桥生物技术有限公司);RIPA裂解液(碧云天生物技术有限公司);Tween 20(北京博奥拓达科技有限公司);内参GAPDH(美国Affinity公司);山羊抗兔IgG-HRP(北京中杉金桥生物技术有限公司);肝素钠注射液(天津生物化学制药有限公司,规格1万U/mL);自噬抑制剂组3-甲基腺嘌呤(美国Abmole公司);KH液配置试剂(氯化钠、氯化钾、磷酸二氢钾、碳酸氢钠、葡萄糖、氯化钙、硫酸镁)均购于天津市风船化学试剂有限公司。
2 实验方法
2.1 动物筛选及分组
采用电动动物跑台进行训练,1次/d,共训练3 d。跑台参数如下:①时间30 min/d;②速度15 m/min;③坡度0°;④电击强度1.0 mA。淘汰标准:1次训练中电击次数>5和/或1次电击时间>1 s的大鼠。淘汰不配合或体质虚弱不符合实验标准的大鼠8只,纳入60只入组大鼠进行体质量测定,其余12只作为补充组备用。按照随机数字表法分为对照组(Con组)、缺血再灌注模型组(IR组)、运动预处理+缺血预适应组(EP+IPC组)、运动预处理+缺血预适应+生理盐水组(EP+IPC+saline组)、运动预处理+缺血预适应+自噬抑制剂组(EP+IPC+3-MA组),每组12只。
2.2 干预方法
Con组、IR组不做特殊运动干预;EP+IPC组、EP+IPC+saline组和EP+IPC+3-MA组接受运动预处理干预,具体如下:采用电动动物实验跑台进行梯度运动训练,1次/d,5 d/周,共训练6周。跑台参数如下:①起始时间15 min/d,每3 d增加5 min,直至时间增至60 min/d后不再变化;②速度20 m/min;③坡度0°;④电击强度1.0 mA。
2.3 模型制备
术前麻醉选取1%戊巴比妥钠溶液经大鼠腹腔注射(40~50 mg/kg),为防止血管凝血,按1000 U/kg剂量腹腔注射10%肝素钠生理盐水。固定、开胸、迅速取出心脏,用1号线将离体心脏固定在Langendorff离体灌流装置上,使心脏接受95%O2和5%CO2KH液(37℃)恒温恒压灌流。在模型制备过程中EP+IPC+3-MA组和IR组分别有4只和2只大鼠在再灌注后心脏复跳失败,选取补充组大鼠进行了补充。补充大鼠的干预方法分别同EP+IPC+3-MA组和IR组。
2.3.1 Con组 当心脏离体之后,快速进行主动脉插管进行离体灌流,持续平衡灌注180 min,不参与缺血处置[9-10]。
2.3.2 IR组 预灌注平衡20 min,然后保持心脏温度恒定在37℃,通过控制灌流设备的三通阀,使全心缺血40 min后,再复灌120 min。
2.3.3 EP+IPC组 EP+IPC组大鼠心脏离体后平衡灌注20 min后,给予3次缺血预处理(短暂缺血5 min,再灌注10 min),之后缺血40 min,再复灌120 min。
2.3.4 EP+IPC+saline组 复制EP+IPC组操作,在缺血预适应处理的过程中给予生理盐水,剂量为3.0 mg/200 g。
2.3.5 EP+IPC+3-MA组 复制EP+IPC操作,在缺血预适应处理的过程中给予3-MA,剂量为3.0 mg/200 g[11]。
2.4 观察指标
2.4.1 透射电镜观察心肌细胞自噬体 灌流结束后迅速取下离体心脏,在心尖处切除1 cm×1 cm×1 cm大小心肌组织进行切块、研磨、离心,取上清液加入2.5%戊二醛固定液2~4 h后用PBS溶液反复清洗,加入1%锇酸固定1~2 h后用PBS溶液反复清洗,用酒精进行梯度脱水后,进行20 min纯丙酮处理,后加入包埋剂丙酮混合液(3∶1)处理3 h,最后加入纯包埋剂丙酮混合液过夜。组织切片(50~70 nm),用醋酸双氧铀50%乙醇饱和溶液对切片进行反复冲洗。用柠檬酸铅对切片染色15 min,利用透射电镜观察心肌细胞超微结构情况,拍摄照片进行记录与分析结果。
2.4.2 TUNEL染色法检测心肌细胞凋亡情况 将离体心脏灌流结束后,取心肌组织固定于4%多聚甲醛中2 h后用15%蔗糖脱水,次日依次进行水洗、脱水、透明、浸蜡、包埋、切片(5μm)、贴片。按照TUNEL试剂盒说明进行操作,在荧光显微镜下随机选取标本中5个非重叠400倍镜视野,Image-Pro Plus 6.0软件计数凋亡细胞。TUNEL染色阳性的凋亡细胞显棕色。
心肌细胞凋亡指数=凋亡心肌细胞数/心肌细胞总数×100%
2.4.3 Western blot检测Beclin-1、LC3-Ⅱ、Bax、Caspase-9、Bcl-2、Bcl-XL蛋白表达水平 在灌注结束后,取下离体心脏放入液氮内速冻后置于-80℃冰箱保存,各组取一定量的心肌组织裂解后,提取上清蛋白液进行蛋白定量。制备上样液、根据各蛋白的分子量配置相应浓度的分离胶,上样、电泳、转膜、封闭、孵育一抗过夜、次日孵育二抗、显色、凝胶系统拍照成像、计算各蛋白与内参的灰度值。
2.5 统计学方法
采用SPSS25.0软件进行统计学处理,计量资料符合正态分布,数据以(±s)表示,组间比较采用单因素方差分析,两两比较方差齐者用LSD-t检验,不齐者则用Tamhane's T2检验。P<0.05表示差异具有统计学意义。
3 结 果
3.1 5组大鼠心肌细胞自噬体透射电镜观察结果
Con组观察到少量自噬溶酶体;IR组观察到较多自噬溶酶体及自噬小泡;EP+IPC组观察到少量自噬溶酶体;EP+IPC+saline组观察到少量自噬小泡;EP+IPC+3-MA组未观察到典型的自噬小泡及自噬溶酶体。见图1。
3.2 TUNEL染色法检测心肌细胞凋亡情况
Con组见极少数TUNEL阳性细胞。与Con组比较,IR组TUNEL阳性细胞比值明显升高(P<0.05);与IR组比较,EP+IPC、EP+IPC+saline组TUNEL阳性细胞比值明显降低(P<0.05);与EP+IPC、EP+IPC+saline组比较,EP+IPC+3-MA组TUNEL阳性细胞比值明显升高(P<0.05)。见表1、图2。

图1 5组心肌细胞自噬体透射电镜观察结果(×10 000)Figure 1 Transmission electron microscopy results of autophagosomes of cardiomyocytes in five groups(×10 000)
表1 5组大鼠TUNEL心肌细胞凋亡指数(±s) %Table 1 Ratios of TUNEL cardiomyocyte apoptosis index in five groups(±s) %
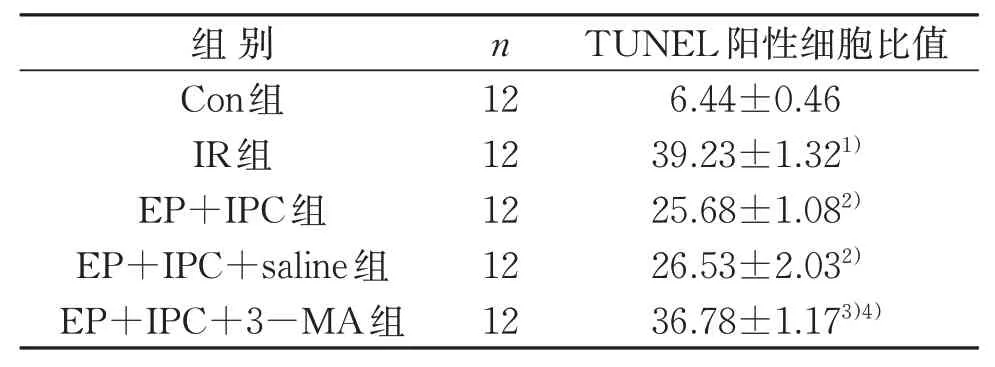
表1 5组大鼠TUNEL心肌细胞凋亡指数(±s) %Table 1 Ratios of TUNEL cardiomyocyte apoptosis index in five groups(±s) %
注:与Con组比较,1)P<0.05;与IR组比较,2)P<0.05;与EP+IPC组比较,3)P<0.05;与EP+IPC+saline组比较,4)P<0.05。Note:Compared with the Con group,1)P<0.05;compared with the IR group,2)P<0.05;compared with the EP+IPC group,3)P<0.05;compared with the EP+IPC+saline group,4)P<0.05.
组别Con组IR组EP+IPC组EP+IPC+saline组EP+IPC+3-MA组n 12 12 12 12 12 TUNEL阳性细胞比值6.44±0.46 39.23±1.321)25.68±1.082)26.53±2.032)36.78±1.173)4)
3.3 5组大鼠心肌蛋白表达结果
与Con组比较,IR组Beclin-1、LC3-Ⅱ、Bax、Caspase-9蛋白表达均明显升高,Bcl-2、Bcl-XL蛋白表达明显降低(P<0.05)。与IR组比较,EP+IPC、EP+IPC+saline组Beclin-1、LC3-Ⅱ、Bax、Caspase-9蛋白表达均明显降低,Bcl-2、Bcl-XL蛋白表达均明显升高(P<0.05);EP+IPC+3-MA组Beclin-1、LC3-Ⅱ蛋白表达均明显降低,差异具有统计学意义(P<0.05)。与EP+IPC、EP+IPC+saline组比较,EP+IPC+3-MA组Beclin-1、LC3-Ⅱ、Bcl-2、Bcl-XL蛋白表达均明显降低,Bax、Caspase-9蛋白表达均明显升高(P<0.05)。见表2、图3。

图2 5组大鼠心肌TUNEL凋亡染色图(×400)Figure 2 TUNEL staining images of myocardial TUNEL apoptosis in five groups(×400)
表2 5组大鼠心肌蛋白表达比较(±s)Table 2 Comparison of expression of proteins in the myocardium in five groups(±s)
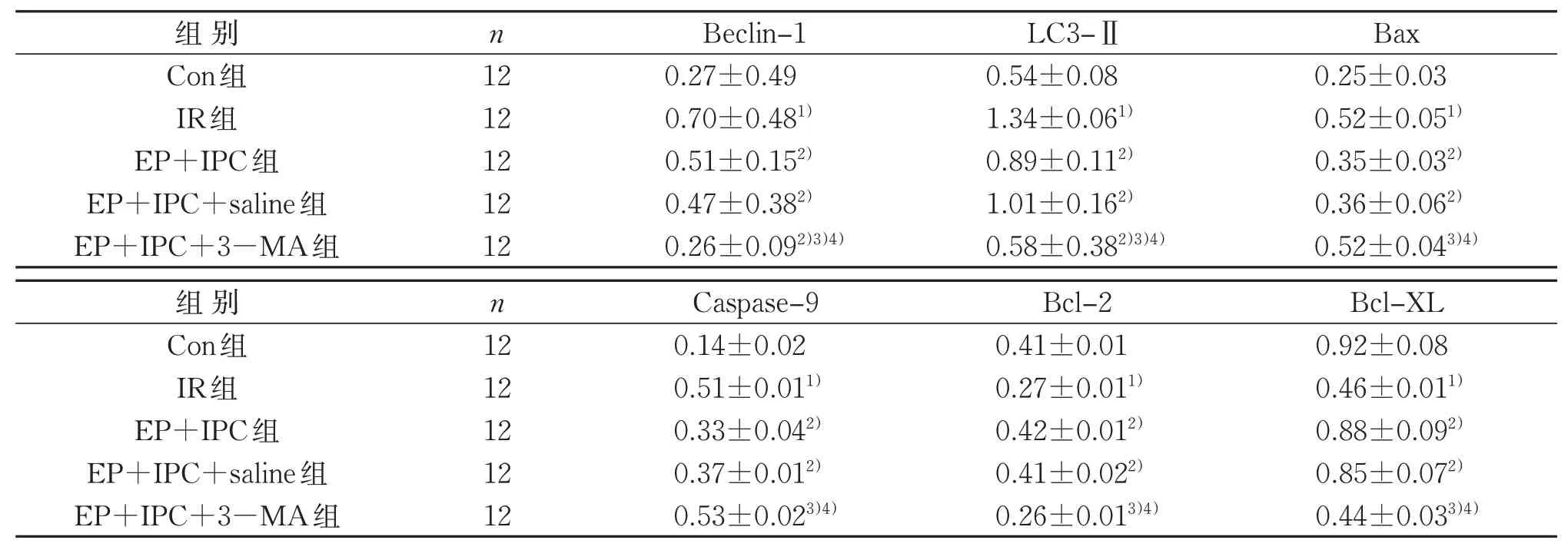
表2 5组大鼠心肌蛋白表达比较(±s)Table 2 Comparison of expression of proteins in the myocardium in five groups(±s)
注:与Con组比较,1)P<0.05;与IR组比较,2)P<0.05;与EP+IPC组比较,3)P<0.05;与EP+IPC+saline组比较,4)P<0.05。Note:Compared with the Con group,1)P<0.05;compared with the IR group,2)P<0.05;compared with the EP+IPCgroup,3)P<0.05;compared with the EP+IPC+saline group,4)P<0.05.
组别Con组IR组EP+IPC组EP+IPC+saline组EP+IPC+3-MA组n 12 12 12 12 12 Beclin-1 0.27±0.49 0.70±0.481)0.51±0.152)0.47±0.382)0.26±0.092)3)4)LC3-Ⅱ0.54±0.08 1.34±0.061)0.89±0.112)1.01±0.162)0.58±0.382)3)4)Bax 0.25±0.03 0.52±0.051)0.35±0.032)0.36±0.062)0.52±0.043)4)组别Con组IR组EP+IPC组EP+IPC+saline组EP+IPC+3-MA组n 12 12 12 12 12 Caspase-9 0.14±0.02 0.51±0.011)0.33±0.042)0.37±0.012)0.53±0.023)4)Bcl-2 0.41±0.01 0.27±0.011)0.42±0.012)0.41±0.022)0.26±0.013)4)Bcl-XL 0.92±0.08 0.46±0.011)0.88±0.092)0.85±0.072)0.44±0.033)4)

图3 5组心肌蛋白表达图Figure 3 Protein expression of myocardial in five groups
4 讨 论
4.1 运动预处理可调控MIRI老龄大鼠心肌细胞自噬的适度表达
本研究通过制备离体MIRI模型,通过透射电镜观察发现,IR组心肌细胞存在较多自噬溶酶体及自噬小泡,这提示缺血再灌注的过程会导致心肌细胞缺血、缺氧,加重心肌细胞损伤。缺血再灌注前给予一定量的运动训练,同时给予缺血预适应,心肌细胞中发现少量自噬溶酶体及自噬小泡。此外,引入自噬抑制剂3-MA作为对照,电镜检查结果显示,与EP+IPC组比较,EP+IPC+3-MA组未观察到典型的自噬小泡及自噬溶酶体,这提示3-MA抑制了运动训练诱导的IPC的心肌保护效应。本研究结果显示,缺血再灌注启动了心肌细胞的自噬。缺血前给予一定量的运动训练,心肌细胞中Beclin-1、LC3-Ⅱ蛋白表达降低,这提示运动训练抑制了心肌细胞自噬的启动以及发生、发展,而给予3-MA干预后,运动训练后IPC明显减轻老龄心肌细胞自噬程度。因此本研究推测运动预处理干预对MIRI产生保护效应可能与自噬和凋亡相关。
自噬是细胞中普遍存在的生理过程。在诱导自噬的途径中,Beclin-1是自噬起始的关键调节因子,是判断自噬发生发展的金指标[12-13],一旦Beclin-1表达上升则促进自噬,而过度自噬则会诱发细胞凋亡。LC3也是反映自噬激活的重要标志之一,LC3-Ⅱ在自噬激活后形成,位于自噬体膜的内外表面,是特异表达于自噬小体膜的分子标志。正常情况下,心肌细胞自噬一般维持在较低的水平,当发生缺血、低氧,细胞老化等,自噬水平则会显著上调[14-16]。运动作为一种生理压力、多次反复的外界刺激,可引起心肌细胞的应激反应从而诱导自噬发生。适宜强度的运动锻炼可通过增强自噬活性促进心肌细胞降解代谢废物,以维持其自身稳定状态[17]。这与研究显示运动预处理可以调节细胞自噬,通过自噬途径促进细胞存活及改善组织的病理形态,发挥保护效应的结果一致[18-19]。
4.2 运动预处理可减轻MIRI老龄大鼠的细胞凋亡情况
本研究结果显示,心肌缺血再灌注后,细胞凋亡程序启动,促凋亡的Bax、Caspase-9蛋白表达升高,抑制凋亡的Bcl-2、Bcl-XL蛋白表达降低。而给予一定强度的运动训练后,心肌组织中Bax、Caspase-9蛋白表达降低,Bcl-2、Bcl-XL表达升高,这提示在心肌缺血再灌注前进行适度运动训练能够增加老龄大鼠心肌的耐受性,减轻缺血心肌细胞凋亡。与EP+IPC组比较,EP+IPC+3-MA组心肌细胞中抑凋亡因子Bcl-2、Bcl-XL表达明显降低,促凋亡因子Bax、Caspase-9蛋白表达明显升高。这提示EP产生心肌保护效应的重要机制之一可能与其调节心肌细胞凋亡相关基因的表达有关。研究发现,在缺血及缺血再灌注过程中心肌细胞可能出现凋亡和坏死[20-21]。在凋亡过程中,Bcl-2家族起重要作用,Bcl-2为抗凋亡基因,Bax为促凋亡基因,两者平衡影响凋亡的发生。再灌注过程会抑制Bcl-2蛋白表达,同时升高Bax蛋白表达。Caspases家族成员中的Caspase-9被认为是启动死亡蛋白酶,可以直接使细胞发生凋亡。EP能够通过上调与细胞保护相关的内源性物质,减轻细胞凋亡情况从而减轻心肌缺血再灌注损伤[22-23]。这与胡阳等[24-25]研究结果基本一致。
5 小 结
运动预处理可诱导老龄大鼠心肌IPC保护作用,能够减轻心肌缺血/再灌注损伤时心肌细胞凋亡,改善心肌细胞形态结构。其机制可能与运动调节老龄大鼠心肌细胞中自噬相关蛋白Beclin-1、LC3-Ⅱ表达,诱导自噬适度发生有关,同时还与促进Bcl-2、Bcl-XL蛋白表达,抑制Bax、Caspase-9蛋白表达有关。但本研究存在一些不足,如对参与调控自噬机制的相关信号通路及各通路间的相互作用尚不明确,还有待于下一步继续研究。
