固相萃取/高效液相色谱-串联质谱法测定水产品中氨苯砜及其代谢物残留量
2022-06-18黄冬梅娄晓祎汤云瑜
伍 姿,黄冬梅,娄晓祎,郑 蓉,汤云瑜,张 璇,张 俊
(1.中国水产科学研究院 东海水产研究所 农业农村部水产品质量监督检验测试中心(上海) 农业农村部水产品质量安全控制重点实验室(上海),上海 200090;2.上海海洋大学 食品学院,上海 201306;3.钛和检测认证集团股份有限公司,上海 200060)
目前国内外有关动物源性食品中氨苯砜及其代谢物残留的研究主要集中在对蜂蜜、牛奶、鸡肉、猪牛肉、鱼肉等样品的检测[9-13]。除鱼肉以外的其他水产品如虾、蟹、贝类等样品中氨苯砜及其代谢物残留的准确测定方法未见报道,相应的用于水产品残留检测的标准方法更是空白。目前对于氨苯砜及其代谢物残留量测定的方法主要有超高效液相色谱法(HPLC)[15-19]、液相色谱-串联质谱法(HPLCMS/MS)[9-11,13,20-25]、酶联免疫吸附法(ELISA)[26-27]、胶体金免疫层析法(GCIC)[28]、化学发光分析法(CLA)[29]等。HPLC 法多用于对氨苯砜药物含量的测定,且灵敏度低,存在基质干扰样品的定性;ELISA 和GCIC法操作简便、检测成本低,但稳定性较差,定量不够准确;CLA法的研究尚不成熟,检测器和发光材料的制备较为复杂;HPLC-MS/MS法的灵敏度高、特异性强,可通过质谱提供更多的结构信息,进一步提高检测的准确性[14]。
本研究通过对提取试剂、净化条件等前处理方法以及液相色谱、质谱条件的优化,采用同位素内标和空白基质标准曲线定量,建立了同时检测水产品中氨苯砜及其代谢产物残留量的高效液相色谱-三重四极杆质谱联用检测法。该方法的净化效果好,分析灵敏度高,检出限达0.1 μg/kg,准确度和精密度均能满足水产品中禁用兽药残留的检测要求,为进一步研究水产品中氨苯砜残留检测标准的修订提供了技术参考。
1 实验部分
1.1 仪器与试剂
液相色谱-三重四极杆质谱仪(ABSCIEX 5500,美国ABSCIEX 公司);高通量组织研磨仪(上海万柏生物有限公司);MTS 240C 涡旋振荡器(德国IKA 公司);KQ-300E 型超声波清洗机(昆山市超声仪器有限公司);CF16RⅫ高速冷冻离心机(日本日立公司);Visiprep 24 管防交叉污染型(DL)固相萃取装置(美国Supelco 公司);N-EVAP-112 氮吹仪(美国Organomation 公司);Milli-Q 超纯水仪(美国Millipore 公司)。
乙腈、甲醇、正己烷(色谱纯,美国Tedia 公司);氨水、盐酸(分析纯,国药集团化学试剂有限公司);氨苯砜、N-乙酰氨苯砜、D8-氨苯砜标准品(纯度大于98%,加拿大TRC 公司)。实验用水为电阻率>18.2 MΩ·cm的超纯水。
1.2 标准溶液的配制
准确称取标准品适量并用甲醇溶解配制成质量浓度为1.0 mg/mL 的氨苯砜、N-乙酰氨苯砜和D8-氨苯砜单标储备液,于-18 ℃冰箱冷冻避光保存。将氨苯砜和N-乙酰氨苯砜单标储备液用甲醇稀释成质量浓度为0.1 μg/mL 的混合标准中间液,同样将D8-氨苯砜储备液用甲醇稀释成质量浓度为0.1 μg/mL的内标工作液,于-18 ℃冰箱冷冻避光保存。用空白基质提取液配成系列梯度浓度的基质混合标准工作液,于4 ℃保存,现配现用。
1.3 样品采集及前处理
1.3.1 样品制备检测样品:鱼,去鳞,沿脊背取肌肉;虾,去壳去头,去肠腺(大型虾)后取肌肉部分;蟹,洗净去壳,取肌肉及生殖腺等可食部分;贝,洗净去壳,取可食部位。分别绞碎,均质混匀后装入密封袋中并贴好标签,于-18 ℃以下冷冻保存备用。
1.3.2 提取准确称量样品2.0 g(精确至0.01 g)于50 mL 具塞离心管中,准确加入内标工作液10 μL,静置后,再加入10 mL 1%氨化乙腈溶液振荡萃取30 s,以2 500 r/min 旋涡混合2 min,超声5 min,以8 000 r/min高速冷冻离心10 min,取上清液于另一干净的离心管,待净化。
1.3.3 净化加入5 mL 正己烷,涡旋混合2 min,冷冻高速离心5 min,弃去正己烷层,剩余液体于45 ℃氮吹浓缩至1 mL以下,用乙腈定容至1 mL并加入9 mL 0.1 mol/L的盐酸溶液,混匀后过MCX固相萃取柱。MCX柱依次用6 mL甲醇,6 mL 0.1 mol/L的盐酸溶液活化,备用液过柱后,保持1秒1滴的流速,然后依次用6 mL 0.1 mol/L的盐酸溶液和6 mL甲醇淋洗,抽干,用6 mL 6%氨化乙腈洗脱,洗脱液于45 ℃氮吹浓缩至约0.2 mL,用10%甲醇溶液定容至1 mL,混匀后经0.22 μm 水相滤膜过滤,供HPLC-MS/MS进样分析。
1.4 液相色谱条件
色谱柱:CAPCELL PAK C18柱(2.0 mm×100 mm,3 μm);柱温:40 ℃;流速:0.3 mL/min;流动相A:水;流动相B:甲醇。梯度洗脱程序:0 ~1.5 min,15%~45%B;1.5 ~3 min,45%B;3 ~4 min,45%~90%B;4 ~5 min,90%B;5 ~5.2 min,90%~15%B;5.2 ~6 min,15%B;进样量:5 μL。
变极发电虽然不需要增加其他设备,但由于电机的极数增加,使得电机体积明显加大,不但制造成本大大增加,而且电机的效率也会降低。据测算,抽水运行时,双速电机比单速电机的效率低2%左右。在低水头情况下,变极发电比同转速效率高得多,而在1969年江都三站建站时,变频技术还很不成熟,只有采用变极方式。在现有技术条件下,因泵站的抽水时间远大于发电时间,以降低抽水效率达到发电的目的是不经济的,故一般不采用变极发电方式。
1.5 质谱条件
离子源:电喷雾电离(ESI)源;扫描方式:正离子扫描;检测方式:多反应监测(MRM)模式;气帘气(CUR)压力:207 kPa;离子喷雾电压(IS):5 500 V;离子源温度(TEM):550 ℃;雾化气压力:345 kPa;辅助气压力:345 kPa;碰撞气:Medium(N2);氨苯砜、N-乙酰氨苯砜、D8-氨苯砜的保留时间、监测离子对、去簇电压(DP)和碰撞能量(CE)见表1。
2 结果与讨论
2.1 质谱条件的优化
用50%甲醇水溶液将氨苯砜、N-乙酰氨苯砜和D8-氨苯砜标准储备溶液稀释至质量浓度为100 ng/mL的标准溶液,通过蠕动泵以针泵注射、恒流进样方式分别注入质谱仪,流速为10 μL/min。首先在正离子模式下进行一级质谱扫描(Q1 scan),确定目标化合物的母离子质量数及其分子离子峰。确定母离子后,通过碎片离子扫描(Product ion scan)获得用于定性和定量的离子碎片。选择干扰小、响应值强的离子对,以响应值最强的碎片离子作为定量离子,次强碎片离子作为定性离子。建立合适的多反应监测(MRM)离子对通道后,通过优化获得子离子的去簇电压和碰撞能量等最佳质谱参数,以得到最终的质谱方法。优化的质谱参数见表1。
2.2 色谱条件的确定
氨苯砜及其代谢产物N-乙酰氨苯砜的分子结构中含有苯环和氨基,而氨基在水中易发生解离。通常,以硅胶作为基质的常规色谱柱,其表面残留的硅醇基团和金属杂质会影响对碱性化合物的分析,导致出现不同程度的色谱峰拖尾和吸附等现象[23,30]。本实验采用高纯度硅胶且通过致密聚合物包被处理的CAPCELL PAK C18柱进行分离试验,可得到对称性良好、峰形尖锐的色谱峰。此外,氨苯砜为弱碱性化合物,极性较小,低浓度情况下酸和盐均对其离子化产生强烈的抑制作用[23]。实验选用甲醇和水作为流动相,可实现其充分离子化,再通过调整甲醇比例和梯度洗脱条件,可使目标化合物获得良好分离。阴性草鱼基质加标的总离子流图见图1。
2.3 提取溶剂的选择
本研究中氨苯砜和N-乙酰氨苯砜均为极性范围较窄的化合物,几乎不溶于水,可选择有机试剂对其进行提取。分别考察了甲醇、乙腈、1%氨化乙腈、1%酸化乙腈和80%乙腈溶液作为提取溶剂时的提取效果,结果见图2。研究表明,甲醇提取时由于其极性较强,样品容易结块,提取的杂质较多;80%乙腈溶液含水较多,导致氮吹浓缩中水分不易蒸发除去,耗时且回收率低;采用1%氨化乙腈提取可抑制碱性待测化合物的离子化程度,提取效果均优于纯乙腈和1%酸化乙腈。因此本研究选择1%氨化乙腈作为提取溶剂,既保证了氨苯砜和N-乙酰氨苯砜在提取过程的稳定性,又提高了分析物的实际回收率,降低了蛋白质等基质的干扰。
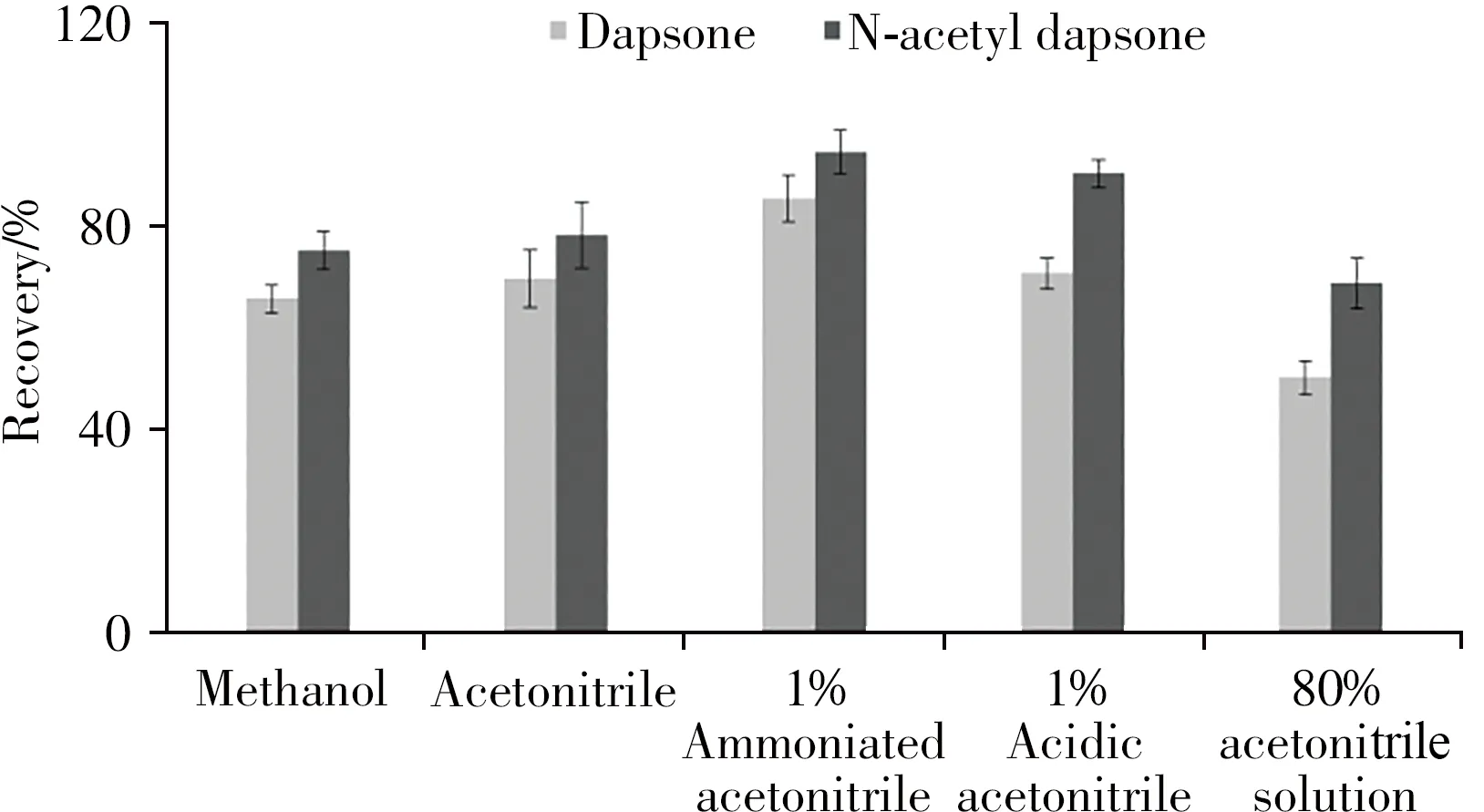
图2 不同提取溶剂对待测物的提取效果比较(n=3)Fig.2 Comparison of extraction effects with different extraction solvents(n=3)
2.4 净化条件的优化
为降低基质效应的影响,样品经提取后选用正己烷进行液液分配除脂,并对比了MCX、HLB、PRiME HLB、C184 种不同固相萃取柱的净化效果。PRiME HLB 作为一种通过型反向固相萃取柱,提取液可直接过柱,但经该柱萃取后样品溶液较浑浊,且回收率不高;MCX、C18和HLB 3 种固相萃取柱使用前均需活化和平衡,MCX 固相萃取柱属于混合型阳离子交换柱,速度快、净化后溶液澄清,待测物回收率可达90%以上,富集净化效果均优于C18和HLB 柱。
实验进一步对洗脱液种类(纯乙腈、氨化乙腈)及氨化乙腈比例(4%、6%、8%、10%)和体积(4、6、10 mL)进行优化。结果显示,氨化乙腈对目标化合物的洗脱能力更好,而4%的氨化乙腈不足以将目标化合物全部洗脱,尤其对N-乙酰氨苯砜的洗脱效果较差,回收率不到60%;6%及以上比例的氨化乙腈能将氨苯砜和N-乙酰氨苯砜洗脱下来且回收率均高于90%,但高比例氨化乙腈易引入样品和柱填料间的其他杂质(见图3)。不同体积洗脱试剂的考察结果显示,6 mL 的氨化乙腈足以将吸附在MCX 固相萃取柱上的目标化合物全部洗脱(见图3)。综合考虑氮吹时长和溶剂的使用量,实验选用6 mL 6%的氨化乙腈对目标化合物进行洗脱。

图3 不同比例与体积组合的氨化乙腈洗脱效果比较(n=3)Fig.3 Comparison of elution effects of different proportions and volume combinations of ammoniated acetonitrile(n=3)
2.5 基质效应
由于不同种类水产品基质含有的脂肪、蛋白质等干扰物质的量不完全相同,因此在不同种类水产品样品前处理过程和液相色谱-串联质谱测定过程中目标化合物会有不同响应,即基质效应(Matrix effect,ME)不同。通过基质标准平均响应值(A)与溶剂标准平均响应值(B)的比值计算化合物的基质效应即(ME =A/B),若0.85 <ME <1.15,表示基质效应不明显;ME <0.85,表示存在基质抑制作用;ME >1.15,表示存在基质增强作用[31]。测试结果如表2所示,氨苯砜和N-乙酰氨苯砜的基质效应均小于0.85,表明存在明显的基质抑制作用。目前常用的消除液相色谱-串联质谱测定过程中基质效应影响的方法有同位素内标法、基质标准溶液法等。采用氘代氨苯砜作为同位素内标,可解决氨苯砜的基质效应问题,但无法完全补偿其代谢产物N-乙酰氨苯砜的基质效应。为达到准确定量氨苯砜和N-乙酰氨苯砜的目的,本方法同时采用同位素内标法和基质匹配标准溶液法消除基质效应的影响,使两种化合物均获得更高的回收率与相对标准偏差。
2.6 线性范围、检出限(LOD)与定量下限(LOQ)
准确移取适量混合标准中间溶液,用空白基质溶液配制系列混合标准工作液,其中内标物的浓度为1 ng/mL。采用本方法进行分析,分别以标准溶液中氨苯砜、N-乙酰氨苯砜峰面积与氘代氨苯砜峰面积的比值(y)为纵坐标,以氨苯砜、N-乙酰氨苯砜的含量(x,μg/kg)为横坐标绘制标准工作曲线,对样品进行定量分析。选取不同空白样品基质进行加标实验,按照本方法提取净化浓缩后进行检测,得到特征离子色谱峰的信噪比(S/N)≥3 且满足方法准确度要求时对应的最低浓度为方法的检出限(LOD),以S/N≥10对应的最低浓度为方法的定量下限(LOQ)。结果显示,氨苯砜和N-乙酰氨苯砜的基质标准溶液均在0.1 ~5.0 μg/kg范围内呈良好线性关系(r2 >0.99),LOD均为0.1 μg/kg,LOQ均为0.2 μg/kg(见表2)。
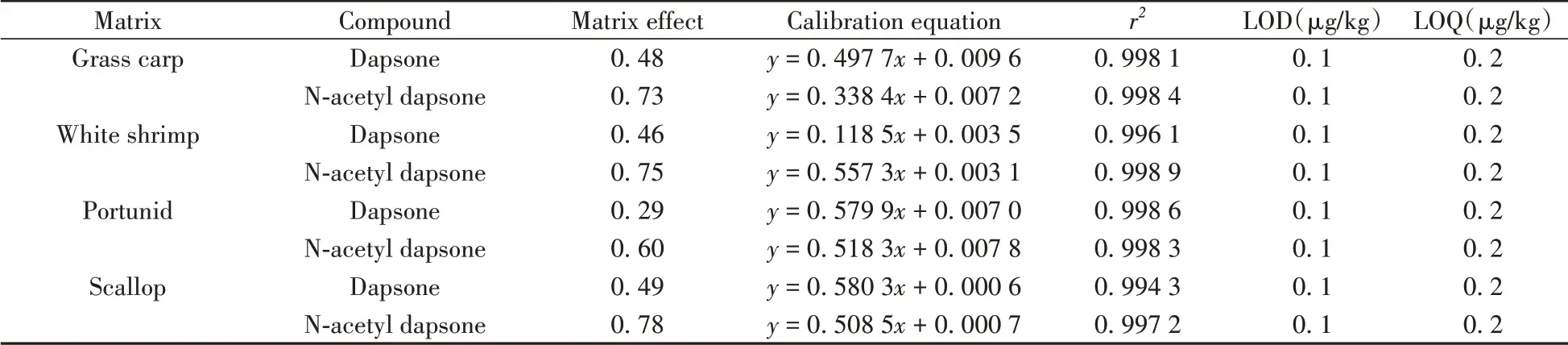
表2 不同样品基质中氨苯砜和N-乙酰氨苯砜的基质效应、线性方程、相关系数(r2)、检出限及定量下限Table 2 Matrix effects,linear equations,correlation coefficients(r2),limits of detection(LODs)and limits of quantitation(LOQs)of dapsone and N-acetyl dapsone in different matrices
2.7 回收率与相对标准偏差
为研究不同水产品基质对回收率的影响,在0.2、1.0、2.0 μg/kg加标水平下,分别对草鱼、南美白对虾、梭子蟹、扇贝进行氨苯砜及其代谢物的加标回收率和精密度实验(n=6)。4 种不同类型水产品中待测物的平均加标回收率为94.0%~109%,相对标准偏差(RSD)为2.7%~11%。结果表明,本方法的准确度和精密度良好。
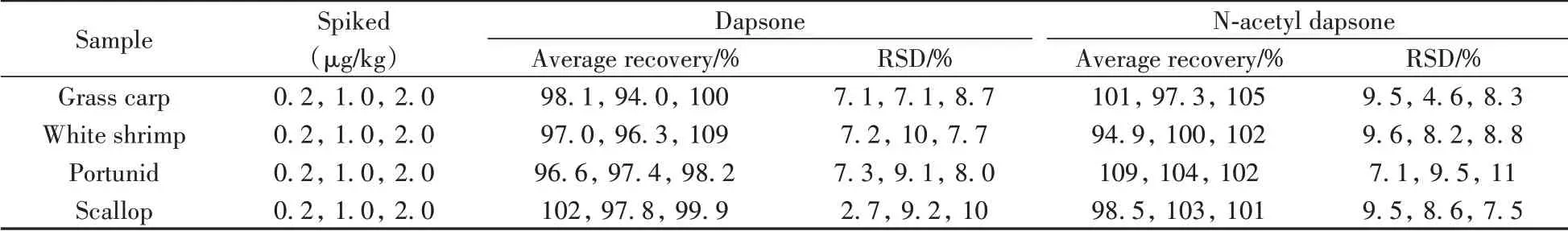
表3 不同水产品基质中氨苯砜和N-乙酰氨苯砜的平均加标回收率和相对标准偏差(n=6)Table 3 Average recoveries and relative standard deviations(RSDs)of dapsone and N-acetyl dapsone in different aquatic product substrates(n=6)
2.8 实际样品检测
采用本方法对本实验室留存的不同批次样品中随机抽取的鱼、虾、蟹、贝等24个样品及农贸市场购买的鲫鱼和草鱼各2个样品进行检测,均未检出目标化合物。对体重为(200±25)g的健康鲫鱼进行1次性口灌给药,灌喂浓度为100 μg/kg,分别于给药后2、12、24 h进行采样,采用本方法对其肌肉进行检测。通过对化合物保留时间和离子对信息进行分析比对,鉴定出氨苯砜的代谢产物为N-乙酰氨苯砜。结果表明,在暴露第2、12、24 h 氨苯砜药物的鲫鱼肌肉中检出氨苯砜含量分别为7.5、17.8、13.3 μg/kg,其代谢产物N-乙酰氨苯砜的含量分别为19.7、53.5、42.9 μg/kg。图4为鲫鱼阳性样品中氨苯砜和N-乙酰氨苯砜的选择离子流图。
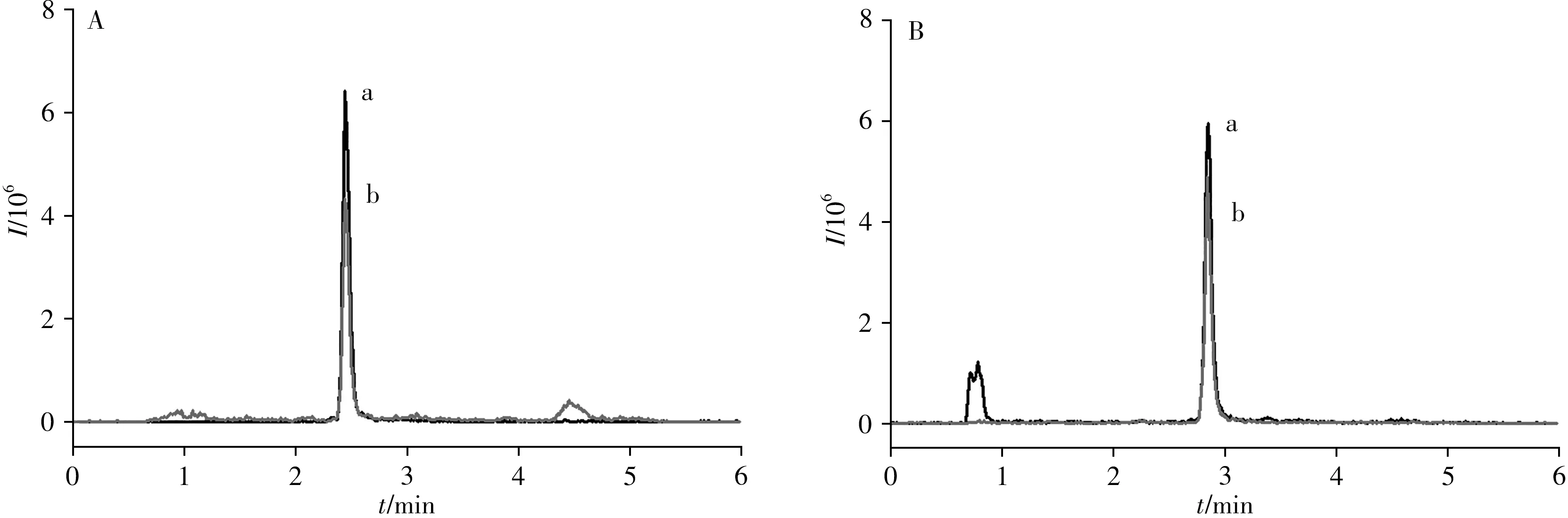
图4 鲫鱼阳性样品中氨苯砜(A)和N-乙酰氨苯砜(B)的选择离子流图Fig.4 Selective ion flow diagrams of dapsone(A)and N-acetyl dapsone(B)in crucian carp positive samples a.quantitative ion;b.qualitative ion
3 结 论
本研究通过对水产品样品前处理条件和仪器检测条件进行优化,建立了固相萃取/高效液相色谱-串联质谱法对水产品中氨苯砜及其代谢产物N-乙酰氨苯砜的同时定性、定量检测。该法有效减小了基质效应的影响,灵敏度高、精密度好,适用于鱼、虾、蟹、贝等各类水产品中氨苯砜残留的定量及确证分析,可为水产品中氨苯砜残留检测标准的修订提供技术参考,同时为检验机构日常检测及政府质量监管提供技术保障。
