改进的QuEChERS法结合液相色谱-高分辨质谱筛查热带水果中33种新烟碱类杀虫剂及杀菌剂
2022-06-18吴兴强仝凯旋谢瑜杰李建勋王永丽范春林
门 雪,吴兴强,仝凯旋,谢瑜杰,李 备,李建勋,魏 静,王永丽,范春林,陈 辉*
(1.中国检验检疫科学研究院 国家市场监管重点实验室(食品质量与安全),北京 100176;2.山东农业大学 食品科学与工程学院,山东 泰安 271018;3.海南省食品检验检测中心 国家市场监管重点实验室(热带果蔬质量与安全),海南 海口 570314;4.中国农业科学院农产品加工研究所,北京 100193)
热带水果具有营养丰富、品质优良、风味独特等特点而深受消费者的喜爱,目前已发展成为我国重要的经济作物,种植面积和产量逐年增加[1]。其中,芒果和香蕉等大宗热带水果逐渐发展成为人们日常生活中必不可少的食品,莲雾、释迦等小众热带水果也备受追捧。然而,热带水果种植地温湿度高,为了保障热带水果的产量与品质,在生产种植过程中通常使用农药来避免病虫害的侵袭[2]。同时,为了延长热带水果的贮藏期,需要在贮藏和运输过程中进行保鲜处理。化学保鲜剂(杀菌剂)具有成本低、见效快等优点,在农业生产和贮运中得到了广泛应用[3]。
新烟碱类农药在热带水果种植生产过程中表现出的优良生物特性使其成为广谱杀虫剂,但越来越多的研究表明新烟碱类化合物会对人体健康产生不利影响[4]。杀菌剂虽然有防腐保鲜的作用,但大多有不同程度的毒性及残留,对人体健康同样产生一定的危害,甚至出现致癌、致畸、致突变等问题[5]。为此,许多国家和组织对热带水果基质中的农药残留进行了严格规定,并发布了相关农药的最大残留限量(MRLs)。例如我国规定新烟碱类农药在上述4 种热带水果中的最大残留限量为0.02~3 mg/kg[6],而欧盟为0.01~0.4 mg/kg[7]。面对如此低浓度的农药最大残留限量标准,亟需开发一种灵敏的检测方法进而实现热带水果中新烟碱类杀虫剂及杀菌剂残留的准确测定,以确保我国热带水果的食用安全。
目前果蔬基质前处理方法主要有分散液液微萃取(DLLME)[8]、加速溶剂萃取(ASE)[9]、固相萃取(SPE)[10]和QuEChERS[11-12]。其中,QuEChERS 方法因试剂材料消耗量少,前处理时间短,容易操作,且符合绿色化学的需求,因此被越来越多实验人员所接受。为了监测热带水果中新烟碱类杀虫剂及杀菌剂残留,采用灵敏、准确的分析检测技术是必要的。当前检测新烟碱类杀虫剂及杀菌剂的分析方法主要有GC-MS[13]、GC-MS/MS[14]、LC-DAD[15]、LC-MS[16]、LC-MS/MS[17]等。这些色谱-质谱联用技术已成为残留分析领域强有力的检测手段,其中三重四极杆质谱凭借其灵敏度和定量准确度,逐渐发展为分析检测行业的“金标准”;但可能存在假阳性干扰、分辨率低等不足,影响数据结果的可靠性,并且无法进行溯源分析[18]。高分辨质谱(HRMS),如飞行时间质谱(TOF)由于具有精确的质量精度、优异的分辨率、杰出的定性准确度,以及全谱信息,可在不进行额外进样的情况下进行回顾性分析,凭借上述优势,HRMS已在食品分析领域得到了广泛应用[19-21]。
本文的目的是建立改进的QuEChERS多残留分析方法,并结合LC-Q-TOF MS技术实现芒果、香蕉、莲雾和释迦等热带水果中33种新烟碱类杀虫剂及杀菌剂的快速检测。通过优化萃取溶剂体积、萃取盐包种类和净化填料,最大限度地降低基质效应的影响,使农药回收率达到最优,并对该方法开展了方法学验证,最终成功应用于市售热带水果样品的分析,为热带水果基质中农药残留的风险监测提供了数据支撑。
1 实验部分
1.1 仪器与试剂
Agilent 6550 LC-Q-TOF MS 配有双喷雾离子源(Agilent 1290,Agilent technologies,Santa Clara,CA);Milli-Q 超纯水机(美国Millipore 公司);KDC-40 低速离心机(中国中佳科学仪器有限公司);N-EVAP112 氮吹浓缩仪(美国Organomation Associates 公司);AH-30 全自动均质仪(中国睿科仪器有限公司);MS204S电子分析天平(瑞士梅特勒-托利多公司)。
芒果、香蕉、释迦和莲雾均采自海南省;农药标准品(纯度≥98%,天津阿尔塔科技有限公司);乙酸、硫酸镁、氯化钠、柠檬酸钠、柠檬酸氢二钠(分析纯,天津福晨化学试剂有限公司);甲醇、乙腈(色谱纯,上海安谱实验科技有限公司);甲酸、乙酸铵(质谱级,美国Honeywell 公司);C18、PSA、GCB(天津博纳艾杰尔科技有限公司);实验用水为Milli-Q超纯水机制备的Ⅰ级水。
1.2 标准溶液配制
称取10 mg(精确至0.1 mg)标准品,分别用甲醇、乙腈或水等溶剂溶解并定容至10 mL,配制成1 000 mg/L 的标准储备液,于-18 ℃避光保存;根据需要,移取适量标准品储备液用相应溶剂稀释,配制成所需浓度的标准工作液,于4 ℃避光保存。
1.3 样品前处理
提取:称取已匀浆样品10 g(精确至0.01 g)置于50 mL塑料离心管中,加入1%乙酸乙腈溶液20 mL及1 颗陶瓷均质子,涡旋振荡1 min 后,加入EN 盐包(4 g 硫酸镁、1 g 氯化钠、1 g 柠檬酸钠、0.5 g 柠檬酸氢二钠),旋紧盖子,机械振荡1 min后,低速离心5 min(转速为4 200 r/min)。
净化:移取6 mL上清液加入到内含900 mg MgSO4、150 mg PSA、50 mg C18及15 mg GCB的15 mL塑料离心管中,涡旋1 min 后,4 200 r/min 再次离心5 min,取出样品管并准确移取2 mL 上清液于10 mL玻璃试管中,40 ℃水浴中氮气吹至近干,加入1 mL 含内标(100 μg/L 莠去津D5)的乙腈-水(3∶2,体积比)溶液超声复溶,涡旋30 s后过0.22 μm滤膜,供LC-Q-TOF/MS上机检测。
1.4 LC-Q-TOF MS分析
色谱条件:ZORBAX SB-C18柱(2.1 mm×100 mm,3.5 μm);柱温为40 ℃。流动相:A 相为0.1%甲酸水(含5 mmol/L 乙酸铵)溶液,B 相为乙腈。梯度洗脱程序:0 ~3 min,1% ~30% B;3 ~6 min,30% ~40% B;6 ~9 min,40% B;9 ~15 min,40% ~60% B;15 ~19 min,60% ~90% B;19 ~23 min,90%B;23 ~23.01 min,90%~1%B,平衡时间为4 min。流速:0.4 mL/min,进样体积:5 μL。
Q-TOF MS 条件:离子源:双通路喷射流电喷雾电离(Dual AJS ESI)源,正离子扫描;扫描范围:m/z50~1 000;采集模式:All Ions MS/MS;毛细管电压:4 kV;雾化气体及压力:氮气,0.14 MPa;鞘气温度及流速:375 ℃,11.0 L/min;干燥气温度及流速:225 ℃,12.0 L/min;碎裂电压:145 V。All Ions MS/MS 采集模式设置为:0~0.5 min,碰撞能为0 eV;0.5 min 后,碰撞能依次设置为0、15、35 eV。33种目标化合物的色谱-质谱参数及定性、定量离子信息见表1。

表1 33种目标化合物的保留时间(tR)、定性及定量离子信息Table 1 Retention time(tR),qualitative and quantitative ion information of 33 target compounds
2 结果与讨论
2.1 萃取溶剂体积的优化
萃取溶剂的选择由目标化合物以及所测样品的性质决定。本研究所涉及的新烟碱类杀虫剂和杀菌剂logKow(正辛醇/水分配系数)值的范围为-0.19~6.62,对于该类化合物的提取乙腈展现了较强的回收效果,但在提取净化过程中,不同水果基质的pH值有很大差异,同时本研究中部分杀菌剂对碱性环境敏感,易出现回收率下降的情况,因此考虑在萃取溶液中加入乙酸,以提高碱性敏感农药的回收率。由于乙酸乙腈溶液可提取各种极性不同的化合物,是多残留法中最有效的有机溶剂[21-22],因此本文选用1%乙酸乙腈作为萃取溶剂,并分别考察了不同体积(10、20、25 mL)1%乙酸乙腈对33 种目标化合物(加标水平为100 μg/kg)的萃取效率,结果显示,检测出的农药数量分别为24、27 和27。当提取溶液为10 mL 时,样品溶液中含有较高的基质背景干扰,在相同的净化条件下会影响化合物的测定。当提取液体积为25 mL 时,化合物响应强度降低,导致检测灵敏度下降,同时也造成原料浪费和环境污染。因此,实验最终选择20 mL 1%乙酸乙腈作为萃取溶剂。
2.2 萃取盐种类的优化
在相关研究中,常常通过改变萃取盐的种类以考察pH值对目标化合物提取效率的影响。本研究主要比较了3种萃取盐包对目标农药回收率的影响,以确定最优的萃取盐种类。萃取盐种类分别为:初始QuEChERS 方法萃取盐包(4 g 无水硫酸镁、1 g 氯化钠),EN 15662 萃取盐包(4 g 无水硫酸镁、1 g 氯化钠、0.5 g 柠檬酸氢二钠和1 g 柠檬酸钠),AOAC 2007.01 萃取盐包(6 g 无水硫酸镁、1.5 g 乙酸钠)[23]。结果显示,采用上述3种萃取盐包对目标农药回收率在70%~120%之间的农药数量分别为25、30、27,表明采用EN盐包的效果略优于其他两种方法。这是因为通过添加柠檬酸缓冲盐能调节基质溶液pH值,使其在5.0~5.5 之间,该pH 范围是定量萃取和保护酸、碱敏感化合物的折中方案[11]。实验结果也证实了一些pH 敏感型农药,如霜霉威和乙霉威(氨基甲酸酯类农药)通过EN 缓冲盐具有良好的性能和稳定效果。因此,本研究选择EN 15662萃取盐包进行后续实验优化。
2.3 净化剂的优化
在农药残留分析的净化方法中有几种常用的吸附剂,如PSA、C18和GCB 等。PSA 是一种弱阴离子交换吸附剂,能有效去除基质中的有机酸和糖等极性杂质。而C18是一种反相吸附材料,可去除脂类、胆固醇和亲脂化合物。GCB 是具有片层结构的弱极性吸附材料,对叶绿素、类胡萝卜素等色素和平面型结构化合物具有很强的吸附作用[23]。芒果含有丰富的有机酸、色素和糖类,是一种复杂的样品基质。尽管样品溶液通过盐析和离心沉淀作用可去除大部分干扰物质,但剩余的基质组分仍可能干扰测定并污染LC-Q-TOF MS系统,因此有必要对样品溶液进行进一步净化。
本文使用900 mg 无水硫酸镁去除残留水分,并考察了3 种不同吸附材料(PSA、C18和GCB)在不同添加量下的净化效果。根据表2中的L9(33)正交实验表,3因素分别为PSA、C18和GCB 的添加量。通过表2 中的R值发现,这3 个因素对可回收农药数量的重要性顺序为PSA >C18>GCB。对于因素C18和GCB,添加水平1(0 mg和0 mg)和水平3(100 mg和30 mg)的K值小于水平2(50 mg和15 mg)的K值,而表3中显示因素C18和因素GCB的3个水平对结果无显著性影响(p>0.05)。而对于因素PSA,表2显示,水平2的K值大于其他两个水平的K值,这可能是由于随着PSA用量的增加其基质效应降低,但继续增加其用量反而造成目标农药吸附。同时,表3 中统计学数据分析显示因素PSA 的p值小于其他两个因素,这表明,相比于C18和GCB,PSA 对可回收农药数量的影响较大。因此,样品提取液中净化目标农药的最佳净化剂添加量为:PSA 为150 mg,C18为50 mg,GCB为15 mg。

表2 正交表L9(33)优化样品净化方法结果Table 2 Orthogonal array L9(33)results of sample clean up method

表3 正交表L(933)的实验结果ANOVA 分析Table 3 ANOVA analysis for experimental results from L9(33)
2.4 基质效应评价
基质效应(ME)是用于研究共提取化合物对分析物信号的影响,可通过比较基质和溶剂的响应值峰面积进行计算,其公式为:ME=(基质峰面积/溶剂峰面积)×100%[24]。在开发分析方法时,采用基质匹配标准溶液是最常用的降低基质效应的手段。本实验通过优化样品前处理方法,成功测定了33种农药在基质匹配溶液中的响应值及其在纯溶剂中的响应值,得到基质效应。当|ME-1|>50%时表明该基质对农药具有强基质效应,20%<|ME-1|≤50%为中等基质效应,|ME-1|≤20%为弱基质效应。4种热带水果中33种农药的基质效应分布见图1。
从图1可以看出,芒果基质中只有12.1%的农药表现为强基质效应,中等基质效应和弱基质效应农药总计87.9%,表明本方法对芒果有较强的抗基质干扰能力。香蕉和莲雾基质中,中等基质效应和弱基质效应的农药之和占比均为78.8%,表明本方法同样适用于以上两种基质。而释迦基质有45.5%的农药表现为强基质效应,表明本方法对释迦有一定的基质干扰,可以通过基质匹配校准方法最大限度地降低基质效应对目标化合物的干扰。

图1 4种热带水果中33种农药的基质效应分布Fig.1 Matrix effect distributions of 33 pesticides in four tropical fruits
2.5 方法学验证
2.5.1 筛查限、定量下限与标准曲线根据SANTE/12682/2019 指南对筛查限和定量下限进行验证[25],具体定义为在一系列浓度水平上,每个浓度做20 组加标回收实验,检出率达到95%以上的最低浓度即为筛查限(SDL);定量下限(LOQ)为能可靠并精确测定分析物的最低加标浓度(回收率在70%~120%范围内,相对标准偏差(RSD)≤20%)。在最优条件下,方法学验证结果见表4,芒果的SDL 为0.5~10 μg/kg,LOQ 为0.5~20 μg/kg,其中LOQ 小于10 μg/kg 的农药有31种,占比93.9%,表明该方法对芒果基质中农药残留的检测灵敏度高,可满足日常筛查需求。33种目标农药在香蕉、释迦和莲雾基质中的SDL和LOQ分布情况为:SDL ≤20 μg/kg,LOQ ≤50 μg/kg(释迦中氟啶虫胺腈和噻虫胺为50 μg/kg)。
向验证基质中添加10 个浓度水平(0.5~200 μg/kg)的目标分析物,通过校准曲线计算线性相关系数(r2)考察回归线的可靠性和准确性。结果显示,在所研究的线性范围内所有化合物的相关系数(r2)为0.995 1 ~0.999 8,表明各分析物的线性关系良好。
2.5.2 准确度与精密度方法的准确度与精密度通过考察向芒果样品中添加1、2、10倍LOQ 浓度水平的加标回收率实验,同一水平进行5 次重复实验,以确定平均回收率和RSD,实验结果如表4 所示。3个浓度水平下,33种农药的回收率均在70%~120%范围内且RSD ≤20%,数据结果表明该方法的准确度与精密度令人满意。
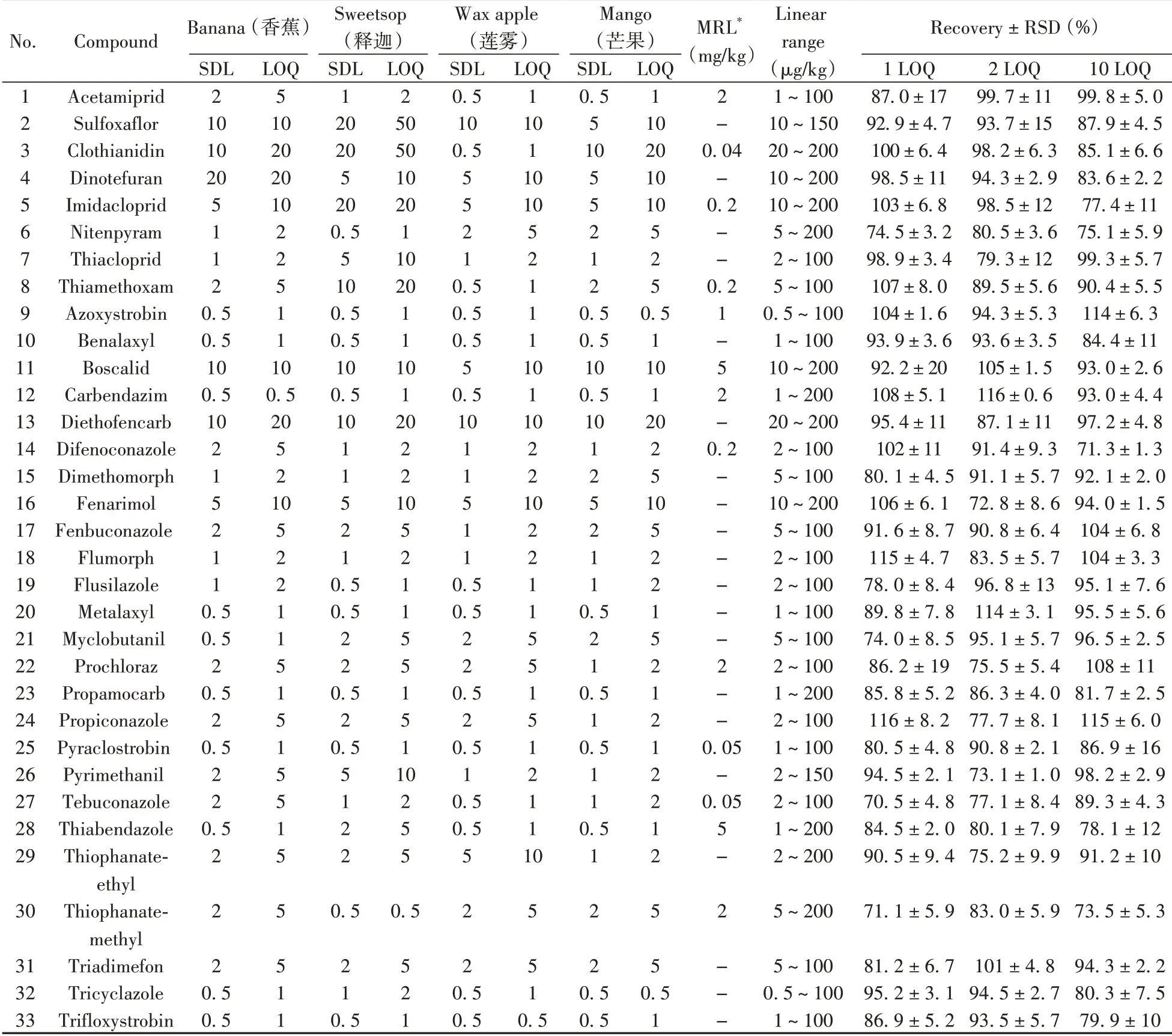
表4 33种农药的筛查限、定量下限、线性范围、回收率及相对标准偏差Table 4 SDLs,LOQs,linear ranges,recoveries and RSDs of 33 pesticides w/(μg·kg-1)
2.6 实际样品的检测
应用本方法对102批次热带水果样品(包括芒果47批次、香蕉43批次、释迦6批次、莲雾6批次)进行筛查和定量检测。芒果样品筛查出的农药主要为苯醚甲环唑(检出率为59.6%)、吡唑醚菌酯(检出率为38.3%)、噻虫胺和吡虫啉(检出率分别为23.4%和10.6%)。香蕉样品中检出频次最高的农药为吡唑醚菌酯(检出率67.4%),其次为杀虫剂吡虫啉(检出率34.9%)和杀菌剂咪鲜胺(检出率30.2%),其中检出的2批次超标样品均为新烟碱类农药(吡虫啉和噻虫胺),超标样品用国标方法进行复测[26],验证了结果的准确性。此次检测的12批次释迦和莲雾样品中目标农药残留含量均低于国家规定的最大残留限量值,相对较为安全。研究结果表明,本方法适用于热带水果中常用新烟碱类杀虫剂和杀菌剂的筛查与检测。
3 结 论
本研究采用改进的QuEChERS 法结合LC-Q-TOF MS 建立了一种检测4 种热带水果(芒果、香蕉、释迦和莲雾)中33 种农药残留的分析方法,并应用于实际样品的快速筛查与检测。本文在传统的QuEChERS 基础上,对萃取溶剂体积、萃取盐包种类及净化填料种类与用量展开了考察,并对方法进行了验证。结果表明,本方法简单快速、准确可靠,能有效地降低基质效应对目标化合物的干扰,适用于热带水果中常用新烟碱类杀虫剂和杀菌剂的快速筛查和准确定量,对维护热带水果在种植、储藏和运输过程中的用药安全具有重要意义。
