脑创伤后AQP4在大鼠海马的表达与MRI研究
2022-06-18林治华
艾 莉,鲁 宏,林治华
(1.重庆市第七人民医院, 重庆 400054; 2.重庆理工大学 药学与生物工程学院, 重庆 400054)
0 引言
创伤性脑损伤(traumatic brain injury,TBI)具有高死亡率及高致残率的特点,幸存者极易伴不同程度认知功能障碍[1],这为患者及其家属带来严重的物质与精神负担。造成这些后果的主要原因是TBI后继发的脑水肿[2-3],它主要由血脑屏障(brain blood barrier,BBB)受损导致的血管源性脑水肿和组织缺血、缺氧引发的细胞毒性脑水肿组成,脑水肿的发生、发展严重影响神经细胞功能恢复与预后[4-7]。通过临床观察发现,脑创伤患者大部分会出现认知功能减退及记忆力下降。这种功能的异常改变与脑创伤后脑水肿的发生部位是否有关联,其产生的病理分子机制亟待深入研究。海马位于内侧颞叶,是大脑负责认知与记忆功能的重要结构[8],在多种中枢神经系统疾病的预后中发挥着重要作用。TBI后患者出现不同程度的认知功能障碍是否与海马组织水肿相关,其病理分子机制尚不明确。因此,对TBI后认知功能障碍是否与海马部位的水肿相关和其产生的病理分子机制进行研究,有助于为脑创伤的机制研究与基因药物开发奠定理论基础。
AQP4是脑内分布最多的水通道蛋白,主要分布于星形胶质细胞、室管膜上皮细胞、脉络丛上皮细胞、血管内皮细胞等支持细胞中,在脑水肿形成发展中起着关键作用[9-14]。研究显示,AQP4的表达上调与细胞内水肿关系密切[15],通过基因沉默AQP4可显著减轻细胞内水肿的严重程度[10,16-17]。脑创伤后,AQP4是否参与海马组织水肿的病理过程,目前尚无实验依据。
本研究通过建立大鼠脑创伤模型,应用MRI技术对大鼠海马水肿进行定性及定量分析,HE染色观察了大鼠海马部位组织水肿的情况,AQP4/GFAP双标免疫荧光染色检测AQP4在海马部位的极性分布,qPCR检测海马部位AQP4 mRNA的表达,并对比了其创伤侧与非创伤侧的差异,探索TBI后AQP4在海马组织中的表达以及AQP4与海马组织水肿的相关性,观察TBI后海马组织的MRI征象变化,以期为脑创伤的机制研究与基因药物开发奠定理论基础。
1 材料与方法
1.1 实验动物
选用成年雄性Wistar大鼠50只,购于陆军军医大学大坪医院实验动物中心(动物使用许可证号:SYXK(军)2012-0037;动物生产许可证号:SYXK(军)2012-0012),250~300 g,12 h亮12 h暗,温度控制在22~25 ℃,自由摄取水和食物。根据实验目的将50只大鼠按随机数字表分为对照组(n=10)、创伤组(n=40);创伤组再根据不同时间点分为1、6、24、72 h 4个亚组,每亚组各10只(对照组除外)。每组取6只大鼠行7.0 T多模态磁共振扫描,扫描结束后将大鼠用于qPCR检测双侧海马部位脑组织AQP4的表达,从余下4只大鼠中分别取2只用于病理(HE染色)观察,2只用于激光共聚焦观察AQP4的表达部位。
1.2 建立脑创伤动物模型
采用改良的Feency氏法[8]用PinPointTM颅脑损伤撞击器(美国Hatteras公司)制作脑创伤模型。用1.5 g/L戊巴比妥钠按50 mL/kg对大鼠行腹腔注射麻醉。俯卧位将大鼠头部固定于立体定位头架(ST-7Setagaya-Ku,日本Tokyo公司)上,头部备皮,常规消毒,沿正中线切开头皮约2 cm。应用牙科台式电钻机1.5 mm钻头(转速4 000 r/min)于前后囟之间、中线右旁开2.5 cm处钻开颅骨,以此为中心用蚊式血管钳打开直径为5 mm的圆形骨窗,保持硬脑膜完整,对准骨窗撞击,建立右侧大脑中度脑创伤模型,根据预实验选择参数:撞击速度2.5 m/s,撞击深度3.5 mm,撞击时间0.85 s,撞击头直径4 mm,创伤灶兼有皮髓质损伤,骨蜡封闭骨窗,局部止血后缝合头皮。对照组除不撞击之外,其他操作同创伤组。
1.3 MRI检查
每组6只大鼠,用异氟烷(Aerrane,百特国际有限公司)麻醉后置入维普特V-1动物麻醉机(Vetequip,USA)内行7.0 T多模态MRI扫描,采用BRUKER 7.0 T小动物MRI扫描仪(BRUKER,GERMANY),大鼠仰卧位置于专用相控阵实验动物线圈。以视交叉为中心扫描。扫描参数:Localizer:TR 100 ms,TE 3 ms,层厚1 mm,间距0 mm,视野40 mm×40 mm,矩阵256×256。T2WI:TR 4 000 ms,TE 35 ms,层厚1 mm,间距0 mm,视野35 mm×35 mm,矩阵256×256。DWI:TR 3 000 ms,TE 22 ms,层厚1 mm,间距0 mm,视野35 mm×35 mm,矩阵128×128,分别选用b值为0、1 000 s/mm2进行成像。扫描结束后,将所得图像传送到后处理工作站,测量双侧海马的ADC值,依据公式:ADC(mm2/s)=In(S1/S0)/(b0-b1),S1为b=1 000的信号强度,S0为b=0的信号强度,In为自然对数。
1.4 病理观察与海马定位
获取大鼠大脑组织进行石蜡包埋切片脱蜡,再用苏木素染3~8 min,自来水冲洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流动水冲洗。再伊红染色3 min,最后脱水,中性树胶封片,显微镜下观察双侧海马病理改变,并进行图像采集。
1.5 脑组织切片AQP4/GFAP双标免疫荧光染色检测AQP4在海马中的表达
取损伤区的大脑切片组织,常规进行石蜡包埋和切片。将石蜡切片处理后加正常山羊血清封闭,滴加一抗(兔抗大鼠AQP4-IgG 1∶300和小鼠抗大鼠GFAP-IgG 1∶300)50 μL,4 ℃过夜,37 ℃复温,PBS冲洗后,滴加二抗(羊抗兔IgG-cy3(18) 1∶200和羊抗小鼠IgG- 488(11)1∶100)40~50 μL,处理后滴加DAPI封片,在激光共聚焦扫描显微镜下观察并摄片。
1.6 qPCR检测AQP4相对表达量
总RNA提取:每30 mg组织中加入500 μL,匀浆后加入三氯甲烷,立即颠倒混匀,静置3 min,4 ℃ 12 000 g离心10 min,吸取上清,加入等体积的异丙醇,立即轻轻混匀10次,-20 ℃放置20 min,4 ℃ 12 000 g离心10 min,留沉淀,采用75%乙醇洗沉淀2次,最后弃上清,待乙醇挥发干净,加入50 μL无菌水溶解沉淀。采用逆转录试剂盒将总RNA逆转录为cDNA,染料法荧光定量PCR检测AQP4的mRNA相对表达量。
1.7 统计学分析
2 结果
2.1 TBI后MRI显示海马组织发生水肿
本研究将实验动物分为对照组和创伤组,其中创伤组又根据不同时间点分为创伤后1、6、24、72 h 4个亚组,通过MRI检查发现:① 对照组:DWI及ADC图未见明显异常(图1(a),1(b));② 创伤组创伤侧海马:创伤后6 h,DWI开始出现高信号(图1(c)),并一直持续至创伤后72 h(图1(d));与对照组相比,ADC值在创伤后6 h出现明显下降,创伤后24 h达到最低(P<0.05),随后开始升高,创伤后72 h恢复至正常(表1);③ 创伤组非创伤侧海马:DWI在创伤后1、72 h未见明显异常,创伤后6、24 h呈高信号;与对照组相比,ADC值在创伤后6 h轻微下降(图1(e)),创伤后24 h明显下降(图1(f),P<0.05),随后开始升高,创伤后72 h恢复至正常(表1)。
2.2 TBI后创伤侧海马胶质细胞及颗粒细胞存在明显的细胞内水肿
通过将对照组与创伤后各亚组分别进行HE染色观察海马水肿情况。对照组双侧海马胶质细胞及颗粒细胞形态分布正常,毛细血管较少,未见明显细胞内水肿及血管源性水肿(图2(a))。创伤组创伤侧:在创伤后1 h,海马胶质细胞及颗粒细胞形态分布未见明显异常,毛细血管形态正常;创伤后6 h,可见胶质细胞及颗粒细胞轻度肿胀,胞浆淡染,表现为细胞内水肿,血管内皮周边亦可见水肿,间隙模糊,但此时以细胞内水肿明显(图2(b));创伤后24 h,细胞肿胀程度以及血管周边水肿明显加重,病理表现为混合性水肿,但仍以细胞内水肿为主(图2(b));创伤后72 h,2种水肿明显减轻,尤以细胞内水肿变化为著(图2(b))。创伤组非创伤侧:创伤后1、72 h未见明显病理变化(图2(c));创伤后6 h及24 h可见海马胶质细胞及颗粒细胞水肿,少许血管内膜水肿(图2(c))。
2.3 TBI后未发现海马细胞存在AQP4的明显表达
建立大鼠脑创伤模型,选择创伤后6、24 h作为检测时间点,采用免疫荧光染色检测AQP4在海马中的表达,利用GFAP标记星形胶质细胞。对照组双侧海马胶质细胞及颗粒细胞形态分布正常,均未见明显AQP4(红色)表达(图3(a));创伤组创伤后6 h(图3(b))和24 h组(图3(c))亦未见明显的AQP4表达。

图2 HE染色显示TBI后海马部位显微镜下 病理改变(HE×400)

红色为AQP4,绿色为GFAP
2.4 TBI后海马组织中AQP4的mRNA没有明显变化
本研究采用qPCR检测创伤后6 h和24 h海马组织中AQP4 mRNA的表达。结果同图3,与对照组相比,创伤后6 h和24 h组均未见明显的AQP4表达水平升高(图4,P>0.05)。
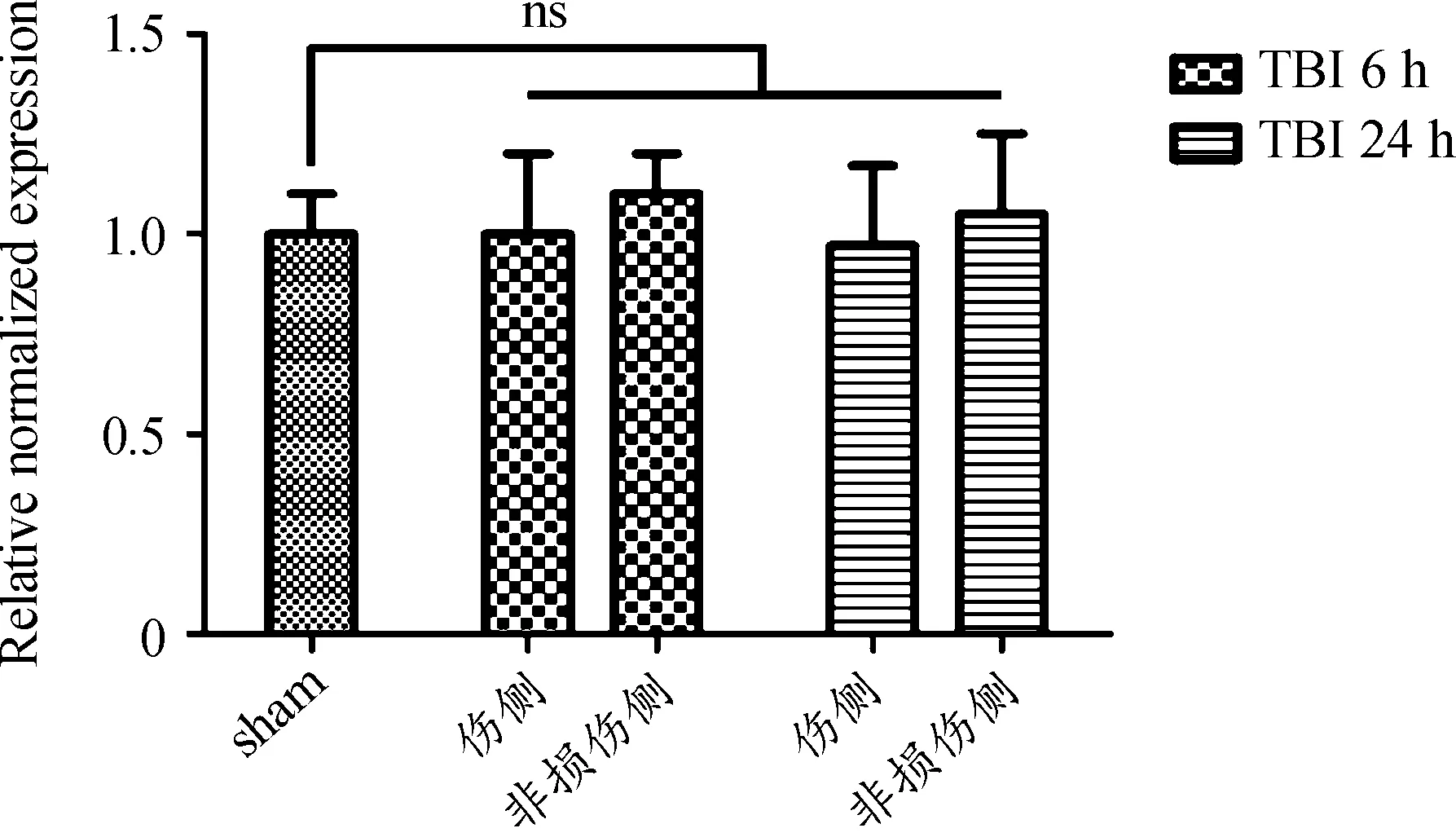
ns:TBI 6、24 h后创伤侧和非创伤侧分别与sham相比没有统计学差异,P>0.05)
3 讨论
1) 本研究按照改良Feency氏法构建脑创伤模型,由于多模态MRI技术中,DWI与ADC值结合能准确反映脑水肿情况及判断脑水肿类型[18],通过MRI技术对实验动物大脑水肿信号的分析,发现:① 创伤后海马的创伤侧与非创伤侧在MRI上都出现了水肿,且水肿类型以细胞内水肿为主,这与病理观察结果一致;② 海马水肿出现时间(创伤侧TBI后6 h,非创伤侧TBI后24 h)均迟于脑损伤皮质区(脑皮质区TBI后1 h即出现,以血管源性水肿为主)。TBI引起海马水肿的具体机制尚不清楚。大量实验证明AQP4在脑水肿的形成中发挥了重要作用,且呈双向性,既可加重脑水肿,亦可减轻脑水肿。推测AQP4参与了海马组织水肿的产生与发展。
2) 为了明确AQP4是否参与了TBI所致的海马组织水肿,本研究通过AQP4/GFAP双标免疫荧光染色检测AQP4在海马部位的极性分布以及qPCR检测海马部位AQP4 mRNA的表达。AQP4/GFAP双标免疫荧光染色检测发现,对照组及TBI组大鼠海马部位星形胶质细胞大量分布,但未检测到AQP4的明显表达;而qPCR检测亦未在对照组和TBI组中检测出AQP4 mRNA的表达,两者结果一致。但本实验中通过HE染色可见TBI后6 h和24 h海马组织明显细胞内水肿。由此推测TBI所致的海马组织水肿可能不是由AQP4主要介导的。脑水肿常常是血管源性水肿和细胞毒性水肿同时存在,只是在不同情况下以某一种水肿占主导。有学者认为AQP4是产生血管源性水肿的原因[19-20];同时也有报道认为AQP4是血管源性水肿的结果[21]。本实验中未检测到明显AQP4的表达,可能是选取的检测时间点不够,也可能是AQP4本身就不是TBI后海马组织水肿形成与发展的主导者。刘辉等[22]的研究结果显示,脑外伤后几乎所有时段,双侧海马AQP4的表达在对照组和创伤组中均无显著差异,与本实验结果相符;但也有研究[23]显示,创伤后1 h,大鼠海马 AQP4 在蛋白质水平上的表达开始升高,并一直持续至创伤后15 d恢复至正常,且脑含水量的增加与HIF-1及AQP4呈正相关。2种观点之所以不同,可能与实验方法不同有关。而且从后一观点可看出,大鼠海马组织水肿与血脑屏障通透性密切相关,这是因为HIF-1是调控血管内皮生长因子(vascular endothelial growth factor,VEGF)的关键因子,而后者又是血管的生理功能及血管生成的主要调节因子。除此之外,脑创伤后AQP4表达的升高,不排除是机体保护机制或其他因素(如VEGF)所致。由此可见,TBI后大鼠海马组织水肿可能是多因素的共同作用所致,而AQP4或许只是其中的“配角”或中间者。
3)本实验中发现TBI后AQP4未在海马组织中明显表达,究其原因,主要有以下几个方面:① 极性分布的影响:有研究发现,穹窿下器官、海马等部位缺乏血脑屏障,AQP4直接表达在这些部位的星形胶质细胞胞膜上,而非表达在终足膜[22],提示这些特殊部位 AQP4 不呈极性表达,这与本研究的结果相符。在本研究中,影像学、病理学都可观察到创伤组大鼠大脑海马的明显水肿,且创伤侧较非创伤侧更重,可见脑创伤大鼠海马存在水肿,但AQP4表达无显著差异,可能是海马缺乏血脑屏障,AQP4无极性表达所致。② 创伤后海马水肿可能存在其他分子机制:脑创伤后海马的水肿可能不由AQP4主导,而是由其他分子机制介导,如同属水通道蛋白家族的AQP1、基质金属蛋白酶、VEGF、紧密连接蛋白、炎性细胞因子及炎性反应、补体系统等也参与了脑水肿的发生发展[23];亦可能是AQP4通过激活某些细胞(如星形胶质细胞)促进介质的释放导致脑水肿。海马的水肿具体由哪些机制介导,尚需进一步研究。③ AQP4的极性转换:本课题组的既往研究证实,创伤早期,由于BBB破坏导致血管源性水肿出现,AQP4表达稍微下调;创伤后12 h, AQP4表达明显上调,致使细胞内水肿程度加重;创伤后48 h,血管源性水肿再次加重(提示血脑屏障2次开放),此时AQP4表达有所下降;创伤后72 h,AQP4表达上调与细胞内水肿的加重一致;创伤后7 d,2种水肿均下降至基线水平;AQP4的表达下调是血管源性水肿的结果,AQP4的上调是细胞内水肿的原因。AQP4通常在胶质细胞终足膜上极性表达,极性反转后,先在胞浆中弥散表达,之后在细胞膜上表达[24],得出AQP4在海马组织中非极性表达。邱国平[25]的研究表明,在海马等AQP4非极性表达的特殊部位,脑出血后,AQP4与β-DG的表达没有明显变化,推测其原因可能与AQP4的非极性表达不受脑出血后病理生理改变的影响有关,也可能非终足膜上表达的AQP4是通过其他某些分子定位,而非β-DG,但具体机制尚不清楚,需要进一步深入研究。
4 结论
通过建立大鼠脑创伤模型,联合应用影像学及病理学方法,得出结论:与对照组相比,创伤组海马明显水肿,且创伤侧较非创伤侧更严重。在AQP4非极性表达的海马脑创伤后,AQP4在星形胶质细胞的表达没有明显变化,推测其原因与AQP4的非极性表达不受脑创伤后病理生理改变的影响或AQP4表达随时间推移、极性反转的动态改变有关,也可能是由于海马的脑水肿由其他分子机制介导,而非AQP4主导。本研究可为进一步探究脑创伤后脑水肿的发病机制及可能的基因治疗方案提供参考。
