双组分转导系统CNX_RS34865/CNX_RS34870对安丝菌素生物合成的调控机制研究
2022-06-16张堃钰张佩佩付加芳康妮宗工理马欣张少伟曹广祥
张堃钰 张佩佩 付加芳 康妮 宗工理 马欣 张少伟 曹广祥,*
(1 山东第一医科大学(山东省医学科学院)生物医学科学学院,济南 250117;2 山东省医药生物技术研究中心,济南 250117)
珍贵束丝放线菌(Actinosynnema pretiosum)是一种重要的微生物资源,能产生大量的初级和次级代谢产物,对人类健康有着重要影响,其生长相关和代谢调控相关的机制也被广泛地研究。A.pretiosumX47是安丝菌素的工业生产菌株,主要生产安丝菌素,还生产四氢异喹啉类生物碱化合物、环肽类化合物、含色氨酸的二酮哌嗪类化合物[1]和珍贵酚[2]等其他类型的化合物。安丝菌素是A.pretiosum产生的通过传统工艺发酵而得到的一种美登素类抗生素的替代物,包括AP-1、AP-2、AP-3和AP-4 4种结构类似物(图1),其中以AP-3活性最强,其作用机制主要是通过抑制细胞微管蛋白聚合和降解聚合后的微管[3],从而抑制肿瘤细胞的生长来发挥抗肿瘤的活性,在临床上主要用于乳腺癌的治疗。AP-3同时也是开发抗体偶联(antibody-conjugated,ADC)药物的重要原料,然而国内的AP-3发酵产量水平较低,在一定程度上限制其ADC药物的研发。
目前A.pretiosumX47基因组的测序已完成[4],其中AP生物合成包括两个基因簇(图2):Cluster A和Cluster B。Cluster A主要编码AP合成关键酶的基因,包括4个I型聚酮合成酶基因asmA-asmD、部分3-氨基-5-羟基苯甲酸(AHBA)合成相关基因asm22-asm25[5]、特殊延伸单元合成相关基因asm13-asm17[6]、后修饰相关基因asm27、asm10-12[7]、asm19[8]和asm21[9]和与转运或抗性基因相关的调控基因[10]。Cluster B主要编码AHBA合成关键酶的基因,包括大部分AHBA合成相关基因asm43-asm45和asm47、调控基因asm39-asm40和asm48和一些可能的转运或抗性基因[7,11-12]。
双组分转导系统(two-component transduction system, TCS)是细菌当中最重要的信号转导系统,能够感知环境或营养成分变化,它们对微生物的初级代谢、次级代谢和形态分化具有全局性的调控作用。TCS由组氨酸激酶和响应调控蛋白两个组分组成:激酶紧贴最外层跨膜部分,负责感应外界信号;响应调控蛋白位于胞质内,接收激酶传递的信号,发挥全局性的调控功能[13]。例如:在Streptomyces coelicolor中,TCS AfsQ1/Q2在特定的培养条件下激活次级代谢产物放线紫红素、十一烷基灵菌红素和钙依赖性抗生素的合成[14];Streptomyces albus中TCS RspA1/A2正调控盐霉素的生物合成[15]。
深入的了解抗生素生物合成的调控机制是阐明抗生素合成途径、提高抗生素产量的关键。在AP-3生物合成基因簇中,已有部分途径特异性调控基因被研究,如asm2[16-17]、asm18[16]和asm39[17]等均被证实是AP-3生物合成的正调控基因。但尚未有全局性调控因子参与AP-3生物合成的研究报道。本研究发现A.pretiosumX47菌株中TCS CNX_RS34865/ CNX_RS34870正调控AP-3的生物合成。通过构建CNX_RS34870基因的缺失突变菌株,比较分析AP-3产量差异及基因转录水平差异,探究CNX_RS34865/CNX_RS34870对AP-3生物合成的影响及作用分析机制,将为构建AP-3高产菌株提供理论基础。
1 材料和方法
1.1 材料
1.1.1 菌株
珍贵束丝放线菌X47(Actinosynnema pretiosumX47)、Escherichia coliDH5α、E.coliET12567/pUZ8002及AP-3生物活性测定指示菌株指甲绒黑酵母菌(Filobasidium uniguttulatum)为本实验室保存。重组质粒pJTU-D34870、缺失突变菌株ΔRS34870来源于本研究。
1.1.2 引物
本研究所用引物及序列见表1。

表1 本研究所用引物及序列Tab.1 Primers and sequences used in this study
1.2 方法
1.2.1 ΔRS34870菌株的构建
以A.pretiosumX47的基因组为模板,以CNX_RS34870 L-F/L-R和CNX_RS34870 R-F/R-R为引物,分别扩增待缺失片段的上下游片段(L和R);以pSET152质粒为模板,利用Apra F/R为引物,扩增阿伯拉霉素抗性基因片段(apramycin resistance cassette)。通过同源重组的方法将上游片段、阿伯拉霉素抗性基因片段以及下游片段连接至pMD-18T载体,得到重组质粒pMD-D34870,然后对其进行HindⅢ和XbaⅠ双酶切,将酶切得到的片段连接到pJTU1278载体上构建重组质粒pJTU-D34870;最后将其转化入E.coliET12567/pUZ8002感受态细胞得到E.coliET12567-D34870菌株。
将E.coliET12567-D34870接种于含氨苄西林(终浓度为50 μg/mL)和卡那霉素(终浓度为50 μg/mL)的LB培养基(氯化钠 1%、酵母提取物 0.1%、胰蛋白胨1%)中,37℃,培养至A600为0.4~0.6,然后用无菌LB培养基重悬菌体3~4次作为供体菌备用。将A.pretiosumX47的孢子混悬液加入到2×YT培养基(酵母提取物1%、酪蛋白氨基酸1%、氯化钙0.11%)中,50℃热击10 min后自然冷却至室温,然后用无菌LB培养基重悬孢子3~4次作为受体菌备用。将供体菌与受体菌混合后涂布于MS培养基(大豆粉2%、甘露醇2%、琼脂粉2%,pH7.0),30 ℃恒温培养20 h后覆盖阿伯拉霉素(终浓度为10 μg/mL)和萘啶酮酸(终浓度为15 μg/mL),继续培养4~5 d即可长出接合子。在含有阿伯拉霉素(终浓度为10 μg/mL)的ISP2培养基(酵母提取物 0.4%、麦芽提取物 1%、葡萄糖 0.4% 、琼脂粉2% ,pH7.0)上对接合子进行划线传代培养,利用引物RS34870 V-F/R对接合子进行PCR验证,筛选获得CNX_RS34870基因的缺失突变菌株ΔRS34870。
1.3 AP-3的发酵产量分析
1.3.1 AP-3的发酵及萃取
分别将X47和ΔRS34870的孢子(106个/mL)接种于种子培养基(葡萄糖2%、可溶性淀粉4%、豆饼粉1%、聚蛋白胨0.5%、氯化钠0.3%、无水氯化钙0.5%,pH7.0),28℃,220 r/min摇瓶培养48 h,以5%的接种量接入发酵培养基(麦芽糊精3%、可溶性淀粉3%、麦芽浸粉1%、聚蛋白胨0.5%、无水氯化钙1%,pH7.0),28℃,220 r/min 摇瓶培养7 d。得到的发酵液用等体积的乙酸乙酯超声萃取2次,将萃取液蒸干,加入甲醇溶解残留物,得到AP-3样品[18]。以上步骤重复3次,取其平均值用于AP-3的发酵产量分析。
1.3.2 HPLC分析
用0.22 μm滤膜过滤含有AP-3的甲醇(CH3OH)溶液,取20 μL进行HPLC检测。HPLC检测条件为[18]:安捷伦1260高效液相色谱仪(美国Agilent公司);Diamonsil C18反相色谱柱(250 mm×4.6 mm);柱温:40℃;检测波长:254 nm;进样量:20 μL;流速:0.6 mL/min;洗脱条件:0~3 min:80% H2O,20% CH3OH;3~20 min:50% H2O,50% CH3OH;20~26 min:10% H2O,90% CH3OH;26~30 min:80% H2O,20% CH3OH。AP-3保留时间在17.9 min。
1.3.3 生物活性测定分析
以F.uniguttulatum为生物活性测定指示菌株[12],检测X47和ΔRS34870菌株的安丝菌素的合成情况。将F.uniguttulatum菌株接种于YPD培养基(酵母提取物1%、聚蛋白胨2%和葡萄糖2%),28℃,220 r/min培养60 h后作为指示菌加入42℃的未凝固YPDA固体培养基中,混合均匀后制成平板。将无菌的8 mm直径圆形滤纸片分散置于生物活性测定平板上,分别向滤纸片上加入5 μL AP-3样品,风干后置于28℃下培养8~12 h,观察抑菌圈直径。
1.4 转录组测序及数据分析
菌株X47和ΔRS34870在发酵培养基培养72 h后,分别收集菌体进行转录水平分析。提取菌体总RNA,质量检测合格后由测序公司(北京诺禾致源生物信息科技有限公司)进行基因组测序。根据测序结果比较分析X47与ΔRS34870菌株中基因的转录水平变化。
2 结果
2.1 TCS CNX_RS34865/CNX_RS34870的分析鉴定
通过序列分析发现,在A.pretiosumX47菌株基因组中存在两个相邻的基因CNX_RS34865和CNX_RS34870。其中CNX_RS34865基因全长1126 bp,编码一个组氨酸激酶;CNX_RS34870基因全长676 bp,编码响应调控蛋白,包含1个LuxR家族的DNA结合结构域。因此,初步推测CNX_RS34865/CNX_RS34870为一对TCS,可能参与初级代谢或次级代谢的调控。
2.2 CNX_RS34870缺失突变菌株的构建及表型分析
通过PCR获得CNX_RS34870基因的上游1656 bp的DNA片段和下游1457 bp的DNA片段,并采用在上下游片段之间连接1100 bp的阿伯拉霉素抗性基因片段替换目的基因,得到敲除质粒pJTU-D34870(图3A)。该质粒经酶切后电泳检测得到9237 bp的载体条带和4213 bp的插入片段(图3B)。通过接合转移得到接合子后进行PCR检测,结果见图3C,以X47菌株基因组为模板时,DNA片段为774 bp,而以ΔRS34870菌株为模板时,DNA片段为1488 bp,与预期值相符。同时分别将X47菌株和ΔRS34870菌株涂布于ISP2培养基上,观察二者的生长状态。结果显示两者的生长速度及表型一致(图3D),说明缺失CNX_RS34870基因不影响A.pretiosumX47的生长。
2.3 菌株AP-3的产量分析
将A.pretiosumX47与ΔRS34870菌株进行液体发酵,分别在2~7 d利用HPLC分析AP-3的产量。结果如图3A所示,X47菌株在第2天开始产生AP-3,第6天的AP-3产量达到14.59 mg/L;而ΔRS34870菌株在第2天几乎检测不到AP-3的合成,第6天的AP-3产量达到9.2 mg/L,较同期X47菌株AP-3产量降低了36.94%(图4A和4B)。同时,将得到的X47与ΔRS34870菌株在第6天的AP-3产物进行生物活性检测, X47与ΔRS34870菌株发酵产物的抑菌圈直径分别为0.95和0.49 cm(图4C),与HPLC结果一致。以上结果说明CNX_RS34870基因的缺失显著影响菌株AP-3的产量,提示CNX_RS34870基因正调控AP-3的生物合成。
2.4 转录分析基因表达差异
分别对X47与ΔRS34870菌株发酵72 h的转录组数据进行测序分析。与X47菌株相比,ΔRS34870菌株中共有1524个基因转录水平发生显著变化,其中242个基因表达上调,1282个基因表达下调(图5A)。这些变化的基因主要参与菌株糖酵解途径、脂肪酸途径、氨基酸代谢途径、糖代谢途径和丙酮酸代谢途径等初级代谢活动,以及安丝菌素生物合成等多种生命活动(图5B)。
进一步的数据分析结果(表2)显示,ΔRS34870菌株中AP-3生物合成基因簇A中的结构基因asm1、asm30、asm32、asm33、asm35和asm37的转录水平出现显著下调;调控基因asm2和asm34也出现了不同程度的下调。根据以上结果推测CNX_RS34870基因通过调控上述基因的转录影响AP-3的生物合成。
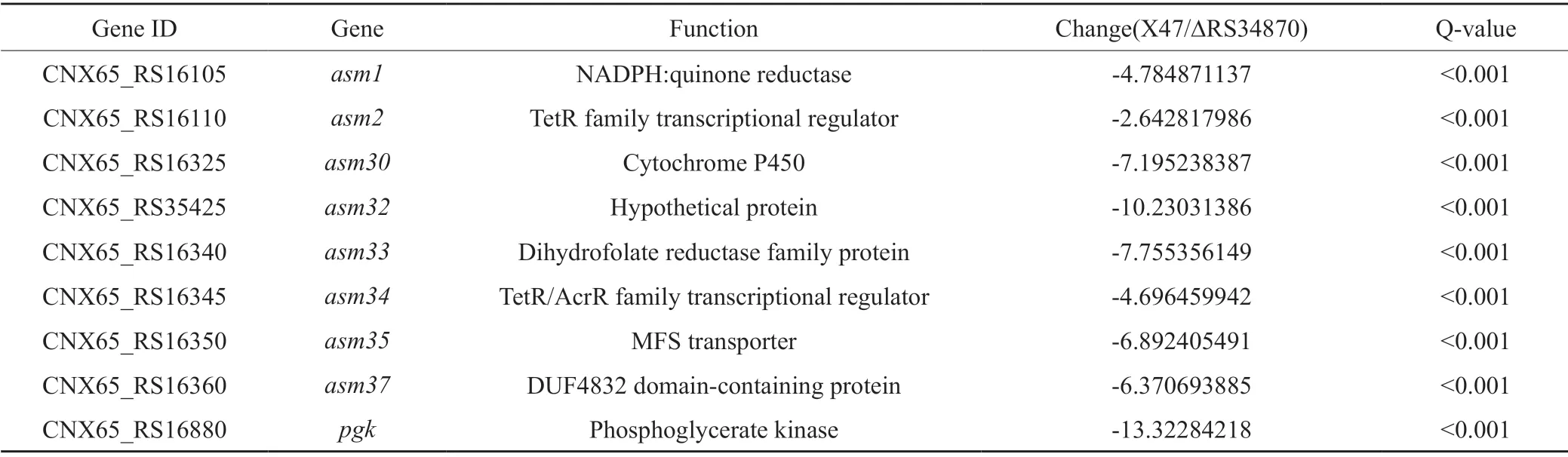
表2 X47与 ΔRS34870 菌株中AP-3 生物合成基因簇基因转录水平差异Tab.2 Transcriptional differences of AP-3 biosynthetic gene cluster between X47 and ΔRS34870 strains
另外,部分与初级代谢相关的基因也出现了显著变化。如莽草酸途径基因pgk等。pgk编码磷酸甘油酸激酶,在莽草酸途径中将甘油酸-1,3-二磷酸转化为丙酮酸,而丙酮酸是AP-3生物合成途径中前体物质丙二酰辅酶A合成的关键物质,因此pgk基因的转录会影响AP-3的生物合成[19]。因此推测CNX_RS34870基因可通过调控与初级代谢相关基因的转录间接影响AP-3的生物合成。但CNX_RS34870基因直接调控的靶基因仍有待通过染色质免疫共沉淀和电泳迁移率分析等试验进一步阐释。
3 结论
放线菌中抗生素的合成受到多层次的调控,关键调控基因的表达水平的变化可显著影响抗生素的合成。本研究侧重于菌株AP-3生物合成的全局性调控研究,以A.pretiosumX47菌株为研究对象,提示TCS CNX_RS34865/CNX_RS34870中调控蛋白CNX_RS34870正调控AP-3的生物合成。CNX_RS34870基因缺失后,AP-3的产量显著下降。本研究将为深入了解AP-3生物合成的调控网络以及工业菌株的遗传改造提供理论指导。
转录水平分析显示CNX_RS34870正调控AP-3生物合成基因簇中结构基因asm1、asm30、asm32、asm33、asm35和asm37以及调控基因asm2和asm34的转录,同时调控初级代谢相关基因pgk的转录,说明RS34870对AP-3生物合成可能是通过全局的、多方面的调控作用来实现的。另外,CNX_RS34870基因缺失后,菌株的糖酵解途径、脂肪酸途径、氨基酸代谢途径、糖代谢途径和丙酮酸代谢途径等相关基因的转录水平均出现了显著变化,提示CNX_RS34870对A.pretiosum具有广泛的调控作用,但其具体的调控功能及作用机制有待进一步研究。
