检测中生菌素的高效液相色谱法
2021-11-17张楠潘忠成杨宏勃李双双李蒲民
张楠潘忠成杨宏勃李双双李蒲民
(1.陕西麦可罗生物科技有限公司,陕西 渭南 714200;2.哈尔滨工程大学材料科学与化学工程学院教育部超轻材料与表面技术重点实验室,黑龙江 哈尔滨 150001)
中生菌素(Zhongshengmycin)又名农抗751,属N-糖苷类抗生素,是浅灰色链霉菌海南变种(Streptomyces lavendulae var heinanensis n.var)的代谢产物。对细菌、真菌及昆虫具有活性。该产生菌是中国农业科学院生物防治研究所从海南土壤中分离得到的[1]。中生菌素有效成分为链丝菌素(Streptothricins)F,是由Waksman等[2]于1942年从Streptomyces lavendulae中分离到的。随后,链丝菌素的其它组分(链丝菌素A、B、C、D、E和X)也相继被发现,其各组分的结构中均包含一分子古洛糖胺、一分子链里定内酰胺和数量不等的β-赖氨酸[3,7],见图1。

图1 中生菌素标准品液相色谱图
国内目前对于中生菌素的检测以生物测定法为主,而生物测定法在生产上因其检测局限性及特异性较差,无法广泛用于生产。2012年西北农林科技大学报道了液质联用法检测中生菌素[8],该检测方法精密度线性加标回收率良好,但是由于液质联用仪价格高昂,很难在实际生产中普及。而目前国内中生菌素生产厂家达40多家,品种100多个,因此建立一个有效便捷的检测方法很有必要。本文采用高效液相色谱法对中生菌素母药及中生菌素可湿性粉剂中各有效成分进行定性定量分析,该方法操作简单快速、定量分析准确,易于推广。
1 材料与方法
1.1 仪器与试剂
岛津LC-20A高效液相色谱仪,配制DAD检测器;Waters symetryshield RP18,粒径5μm,150mm×4.6mm(id)不锈钢色谱柱;中生菌素B~F标准品(西安麦斯迪生物工程有限公司提供),各组分纯度均>90%;中生菌素母药及中生菌素可湿性粉剂(纯度未知),由福建凯立生物制品有限公司提供。试剂乙腈(色谱纯,科密欧)、磷酸氢二钠(分析纯,天津致远)、庚烷磺酸钠(分析纯,MREDA)、磷酸(分析纯,富宇精细化工)、超纯水(自制)。
1.2 方法描述
试样用超纯水溶解,以乙腈加水加庚烷磺酸钠加磷酸氢二钠加磷酸为流动相,使用反相C18为填料的不锈钢柱和可变波长紫外检测器(200nm),对试样中的中生菌素进行高效液相色谱分离和鉴定。
1.3 仪器条件

表1 仪器条件

表2 梯度程序
1.4 测定步骤
1.4.1 标准溶液配制
分别称取含中生菌素F约0.025g、中生菌素E约0.003g、中生菌素D约0.015g、中生菌素C约0.008g、中生菌素B约0.005g(精确至0.0001g)的中生菌素标样,置于同一50mL容量瓶中,加水至刻度,摇匀,备用。
1.4.2 试样溶液的配制
称取含中生菌素F约0.025g(精确至0.0001g)的中生菌素试样,置于50mL容量瓶中,加水至刻度,摇匀,用0.45μm滤膜过滤,备用。
1.4.3 测定
在上述条件下,待仪器稳定后,连续注入数针标准溶液,直至相邻两针中生菌素峰面积相对变化小于1.2%,按照标样溶液、试样溶液、试样溶液、标样溶液的顺序进行测定。
1.4.4 计算
1.4.4.1 中生菌素各组分的计算
将测得的两针试样溶液以及试样前后两针标样溶液中中生菌素的面积分别进行平均,试样中中生菌素F(E、D、C、B)的质量分数ω1(%)按式(1)计算:
(1)
式中,ω1(2、3、4、5)为试样中中生菌素F(E、D、C、B)的质量分数,%;A1为标样溶液中,中生菌素F(E、D、C、B)峰面积的平均值;A2为试样溶液中,中生菌素F(E、D、C、B)峰面积的平均值;m1为中生菌素F(E、D、C、B)标样的质量,g;m2为试样的质量,g;ω0为标样中中生菌素F(E、D、C、B)的质量分数,%。
1.4.4.2 中生菌素总组分的计算
中生菌素总组分质量分数ω(%)按照式(2)计算:
ω=ω1+ω2+ω3ω4+ω5
(2)
式中,ω为中生菌素总组分的质量分数,%。

图2 中生菌素母药液相色谱图
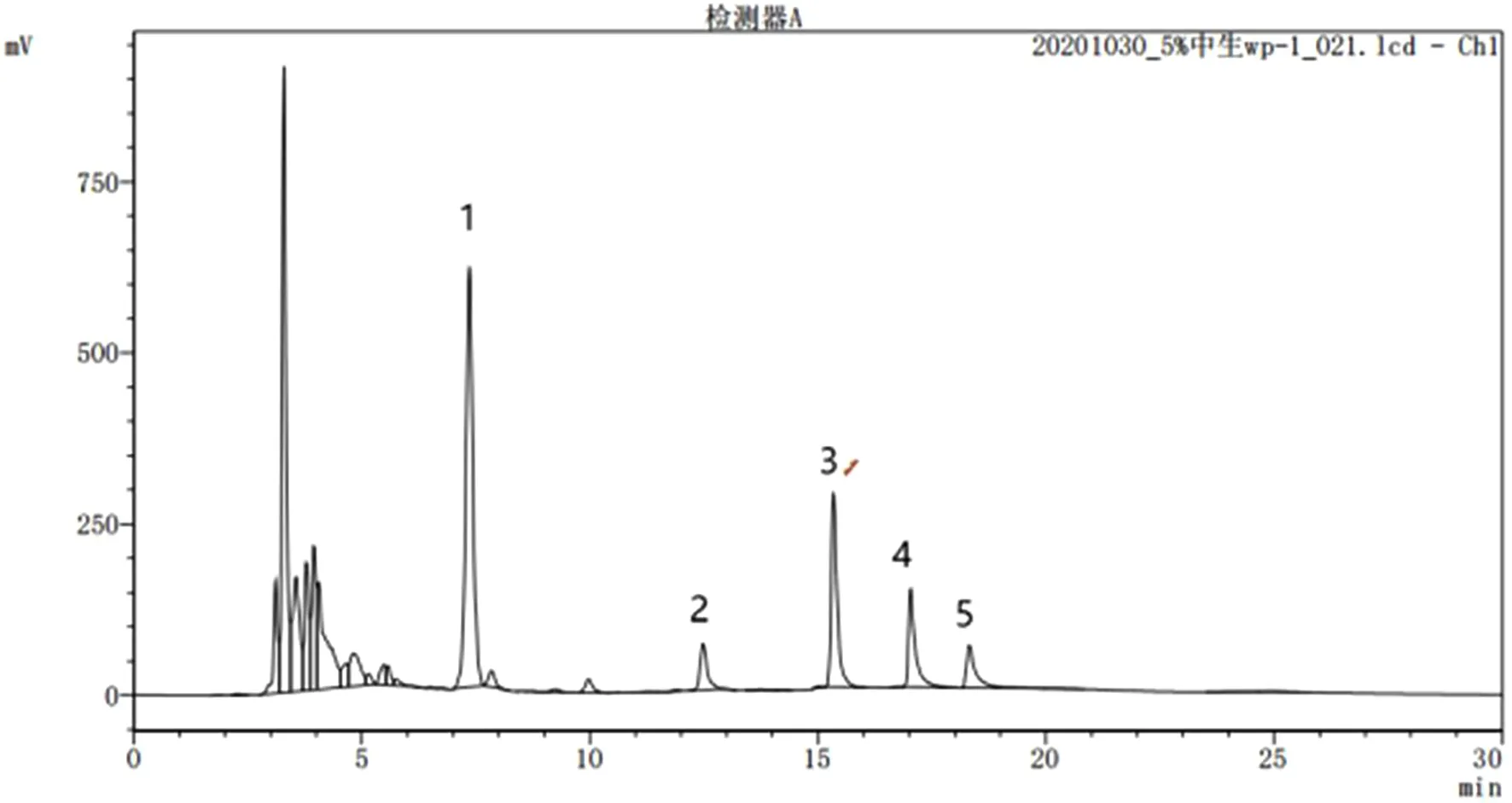
图3 中生菌素可湿性粉剂液相色谱图
2 方法评价
2.1 线性相关测定
根据母药中各组分比例情况,分别配制不同浓度的标准品,分别考察了中生菌素F在浓度250~750μg·mL-1、中生菌素E在浓度22.5~90μg·mL-1、中生菌素D在浓度136.67~410μg·mL-1、中生菌素C在浓度76.67~230μg·mL-1、中生菌素B在浓度46.67~140μg·mL-1范围内具有良好的线性关系。具体结果见表3。

表3 中生菌素各组分线性方程及相关系数
2.2 精密度测定
取中生菌素母药样品按照1.2中方法测定中生菌素母药中各组分,5次计算结果见表4。供试母药中中生菌素含量最高,为5.14%;其次是D、C、B,含量分别为3.46%、2.00%、1.39%;中生菌素E含量最低,为0.61%。由表4还可以看出,所建立的方法具有良好的精密度,中生菌素母药中各组分的相对标准偏差均小于其所对应的Horwitz方程的计算结果。表明该方法能满足中生菌素母药中各有效成分的定性及定量分析。

表4 中生菌素母药精密度测定
取中生菌素可湿性粉剂样品按照1.2中方法测定中生菌素可湿性粉剂中各组分,5次计算结果见表5。由表5可以看出,所建立的方法具有良好的精密度,中生菌素可湿性粉剂中各组分的相对标准偏差均小于其所对应的Horwitz方程的计算结果。表明该方法能满足中生菌素可湿性粉剂中各有效成分的定性及定量分析。

表5 中生菌素可湿性粉剂精密度测定
2.3 准确度测定(加标回收率测定)
按照母药各组分比例,将除中生菌素各组分标品混匀,得到一个实验室“合成”样品,平行制得5个样品,进行回收率测定,测定结果见表6。结果表明,在此检测方法下平行测定5次后中生菌素F加标回收率范围为98.23%~99.37%,在98%~102%范围内;中生菌素E加标回收率范围为98.76%~102.00%,在98%~102%范围内;中生菌素D加标回收率范围为98.29%~99.02%,在98%~102%范围内;中生菌素C加标回收率范围为98.03%~101.87%,在98%~102%范围内;中生菌素B加标回收率范围为99.90%~101.76%,在98%~102%范围内,均符合NY/T 2887要求。

表6 中生菌素母药准确度测定

续表 中生菌素母药准确度测定
按照配方比例要求,将除原药以外的所有助剂混匀,制作制剂空白。按3.0%的含量向空白中添加有效成分中生菌素,即得到一个实验室“合成”样品,平行制得各样品,进行回收率测定,测定结果见表7。结果表明,在此检测方法下平行测定5次后中生菌素F加标回收率范围为97.19%~99.17%,在97%~103%范围内;中生菌素E加标回收率范围为96.79%~99.49%,在95%~105%范围内;中生菌素D加标回收率范围为95.06%~99.78%,在95%~105%范围内;中生菌素C加标回收率范围为96.70%~104.27%,在95%~105%范围内;中生菌素B加标回收率范围为98.96%~104.64%,在95%~105%范围内,均符合NY/T 2887要求。
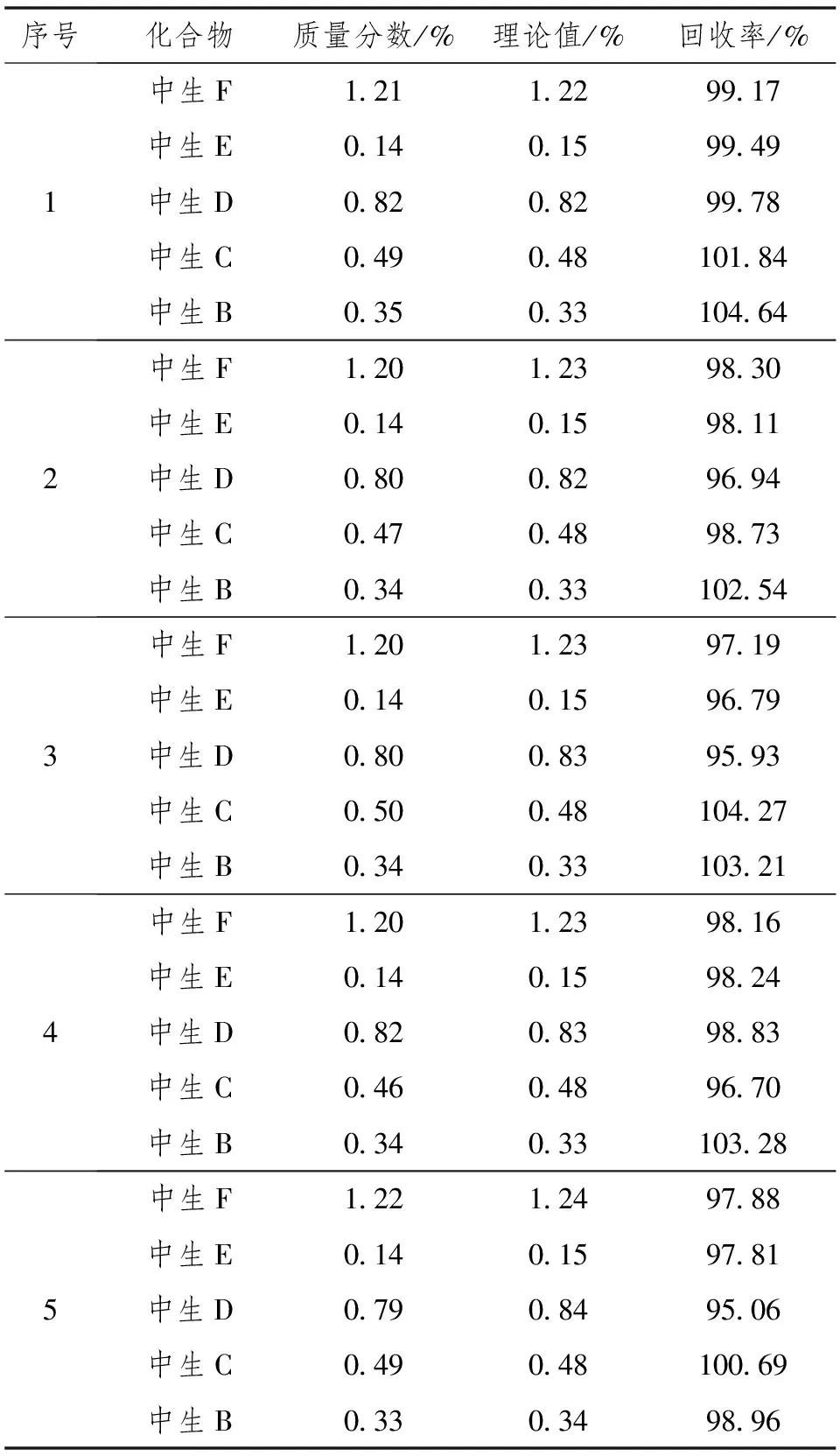
表7 中生菌素可湿性粉剂准确度测定
3 结论
本研究采用高效液相色谱法对中生菌素母药及中生菌素可湿性粉剂中各有效成分进行检测,以乙腈-庚烷磺酸钠水溶液为流动相进行梯度洗脱,中生菌素母药及可湿性粉剂各有效成分在C18色谱柱上均可达到基线分离;各有效成分的准确度和精密度均可达到农药常量分析的要求,且在一定的浓度范围内,线性关系良好。由于链丝菌素类化合物的抑菌活性与其赖氨酸的数目呈正相关关系,即赖氨酸数量越多,其抑菌活性越强,因此,中生菌素原药中链丝菌素A~F均应为其活性有效成分。本研究建立的高效液相色谱法对进一步实现中生菌素母药及相关制剂产品的质量控制具有一定的指导意义。
