蛇黄凝胶处方工艺的优化
2022-06-15瞿孝兰林义平袁强华
田 斌, 瞿孝兰, 林义平, 宋 英, 袁强华*
(1.成都中医药大学,四川 成都 610075;2.成都中医药大学附属医院,四川 成都 610072)
湿疹是一种以剧烈瘙痒与皮肤炎症为主要症状,伴有干燥、脱落、渗液、出血等的过敏性炎性反应性皮肤病[1],临床上常根据其皮损表现分为急性湿疹、亚急性湿疹、慢性湿疹。中医认为,湿疹发病原因与先天禀赋不足后外感风、湿、热等邪气,内热外热相结合发于肌肤相关[2-3];西医认为,它主要与遗传因素、环境因素、药物因素、免疫因素、肠道与皮肤微生物群落失调、肠黏膜屏障功能异常有关[4-7]。
目前,治疗湿疹以消除皮肤炎症和感染,保护和恢复皮肤屏障功能,控制恶化因素为主要目标[8],常用药物包括类固醇、皮质类激素、抗组胺药物、抗生素、糖皮质激素、局部钙调神经磷酸酶抑制剂等[9],但长期使用后会引起皮肤干燥、脆性增加,色素沉着与多毛,皮肤皱缩、皱襞等不良反应[10]。中药外治湿疹大多用清热燥湿解毒、杀虫止痒药[11],从而达到止痒、抗炎、杀菌的目的,其中蛇黄软膏由黄柏、蛇床子组成,用于治疗亚急性湿疹,但其采用原粉入药,存在载药量较小、单次用量大、有效成分逸出缓慢等弊端。凝胶剂作为近年来外用制剂的研究热点,具有稳定性较好、附着性强、释药稳定、涂布均匀、易清洗、不污染衣物等优点[12],故本实验开发新制剂蛇黄凝胶以解决上述问题。
1 材料
1.1 仪器 Agilent 1260型高效液相色谱仪(美国Agilent公司);BP-211D型电子天平(十万分之一,德国赛多利斯公司);LE204E型电子天平(万分之一,瑞士梅特勒-托利多公司);KH-250B型超声波清洗器(昆山禾创超声仪器有限公司);PHS-3C型酸度计(上海精密仪器科学有限公司);DF-101Z型集热式恒温加热磁力搅拌器(上海秋佐科学仪器有限公司);TG-20型台式高速离心机(四川蜀科仪器有限公司);DHG-9023A小型台式干燥箱(上海精宏实验设备有限公司)。
1.2 试剂与药物 盐酸黄柏碱(批号111895-201504,纯度94.9%)、盐酸小檗碱(批号110713-201613,纯度86.8%)、蛇床子素(批号110822-201710,纯度99.5%)对照品均购自中国食品药品检定研究院;欧前胡素对照品(批号191120,纯度98%)购自成都植标化纯生物技术有限公司。壳聚糖(批号20032504)、羟丙甲纤维素(批号19041504)均购自湖南新绿方药业有限公司;羧甲纤维素钠(批号TF78200401)购自湖南九典宏阳制药有限公司;卡波姆940(批号20200522)购自博新化工原料有限公司;甘油(批号000120180804)购自湖南尔康制药股份有限公司,生理盐水(批号18081611)购自四川美大康佳乐药业有限公司;透析袋(截留分子量3 500)。磷酸、乙腈均为色谱纯。
2 方法与结果
2.1 黄柏-蛇床子提取物制备 采用课题组前期筛选出的最优提取工艺,即取黄柏600 g、蛇床子300 g,粉碎至粗粉,混匀,加24倍80%乙醇浸渍8 h后以2 mL/min体积流量进行渗漉提取,收集提取液,回收乙醇,水浴蒸发至稠膏状,进行减压干燥,即得。
2.2 色谱条件 Inertsil ODS-3色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)-[乙腈-0.1%磷酸(每100 mL含0.2 g SDS)](B)(15∶85),梯度洗脱(0~18 min,27%~29%A;18~23 min,29%~37%A;23~40 min,37%~38%A;40~60 min,38%A);体积流量1.0 mL/min;柱温30 ℃;检测波长220 nm(欧前胡素)、230 nm(盐酸黄柏碱、盐酸小檗碱)、322 nm(蛇床子素);进样量5 μL。
2.3 凝胶剂基质选择 表1显示,卡波姆效果最理想,但由于黄柏提取物主要成分为生物碱,与其混合后黏度急剧降低,产生不可溶性沉淀,导致药物难于分散均匀,不宜作为基质;CMC-Na、HPMC也均可形成均匀细腻的凝胶,但其在黏性、流变性方面未达到凝胶基质要求,故将两者混用以改善上述问题。
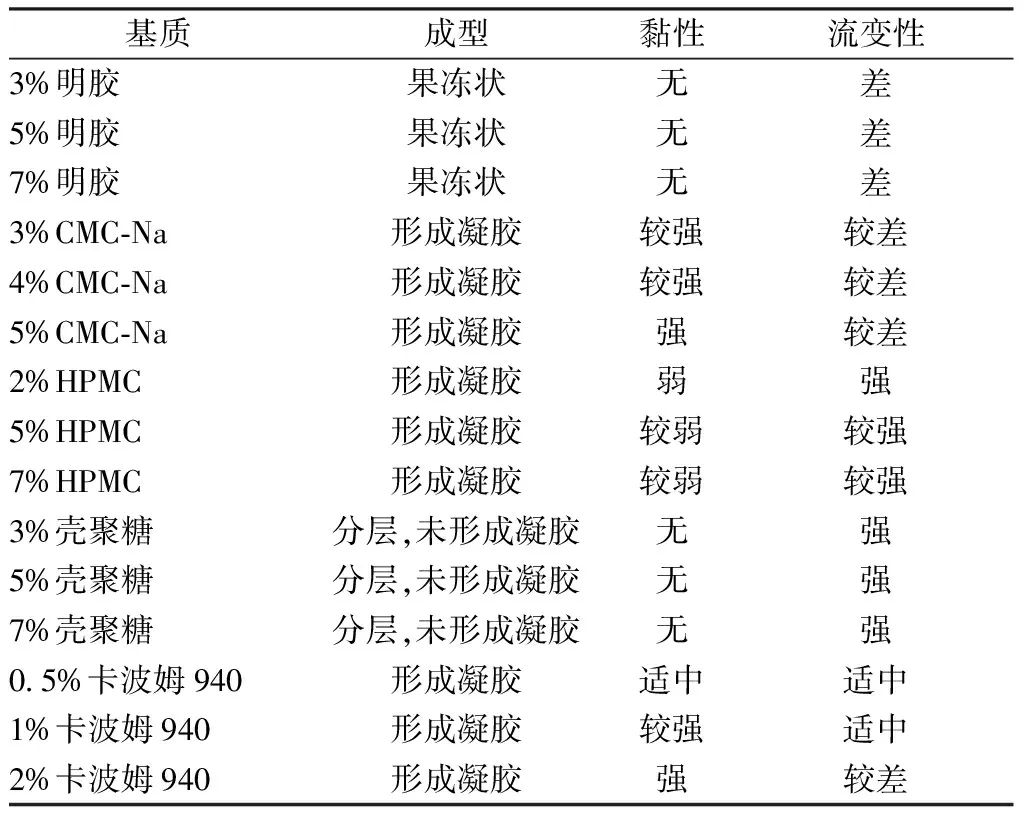
表1 不同基质考察结果
2.4 单因素试验
2.4.1 HPMC用量 每10 g凝胶中固定黄柏-蛇床子提取物用量0.5 g,pH 7,甘油用量1 g,CMC-Na用量0.1 g,设定HPMC用量为2%、3%、4%、5%、6%,结果见表2。由此可知,当HPMC用量大于5%时,凝胶整体黏稠度较大,较难涂布,也难以将药物均匀覆盖至皮肤表面;当用量小于3%时,凝胶成型性较差,黏稠度较低,导致药物在皮肤附着性较差;当用量在3%~5%范围内时,凝胶外观光滑均匀细腻,黏稠度适中,成型性好,易于涂布,故选择3%~5%作下一步考察。

表2 HPMC用量筛选结果
2.4.2 甘油用量 每10 g凝胶中固定黄柏-蛇床子提取物用量0.5 g,pH 7,HPMC 0.4 g,CMC-Na 0.1 g,设定甘油用量为0、5%、10%、15%、20%,结果见表3。由此可知,当不加入甘油时,凝胶黏度较低,皮肤附着性较差;当用量达到20%时,凝胶黏稠度较大,不易涂展;用量在5%~15%范围内时,黏度适中,涂展性较好,故选择5%~15%作下一步考察。

表3 甘油用量筛选结果
2.4.3 载药量 每10 g凝胶中固定HPMC 用量0.4 g,CMC-Na用量 0.1 g,pH 7,甘油用量1 g,设定载药量为3%、5%、7%、9%、11%,结果见表4。由此可知,当载药量在3%~7%范围内时,凝胶成型性较好,黏稠度适中,容易涂展;当载药量达到9%后,凝胶质地不均,出现结块现象,成型性较差,黏稠度较大,不易涂展;当载药量达到11%时,凝胶稠度过大,难以混合均匀,药物结块不能分散,故选择3%~7%作下一步考察。

表4 载药量筛选结果
2.5 Box-Behnken响应面法 在单因素试验基础上,选择HPMC用量(A)、甘油用量(B)、载药量(C)作为影响因素,综合评分作为评价指标,计算公式为综合评分Y=(制剂得分/最大值)×0.5+(体外释放度/最大值)×0.5,其中制剂得分=外观性状×0.4+黏稠度×0.3+涂展性×0.3,满分为100分,采用Box-Behnken响应面法优化处方,评分标准见表5,因素水平见表6,结果见表7,Box-Behnken设计响应曲面拟合结果见表8。

表5 制剂评分标准
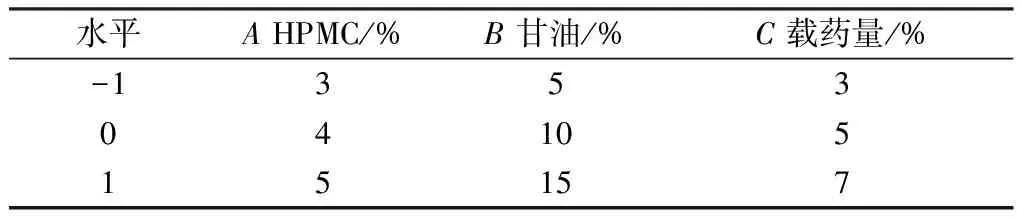
表6 因素水平
响应面分析见图1。由此可知,HPMC用量与甘油用量、HPMC用量与载药量、甘油用量与载药量的3D曲线均较陡,等高线均趋于椭圆,表明三者之间交互作用显著,与表8一致。通过Design-Expert 8.0.6软件,最终得到最优处方为HPMC用量3.93%,CMC-Na用量1%,甘油用量10.17%,载药量4.74%,pH 7,考虑到实际操作的便捷性,将其修正为HPMC用量4%,CMC-Na用量1%,甘油用量10%,载药量5%,pH 7。
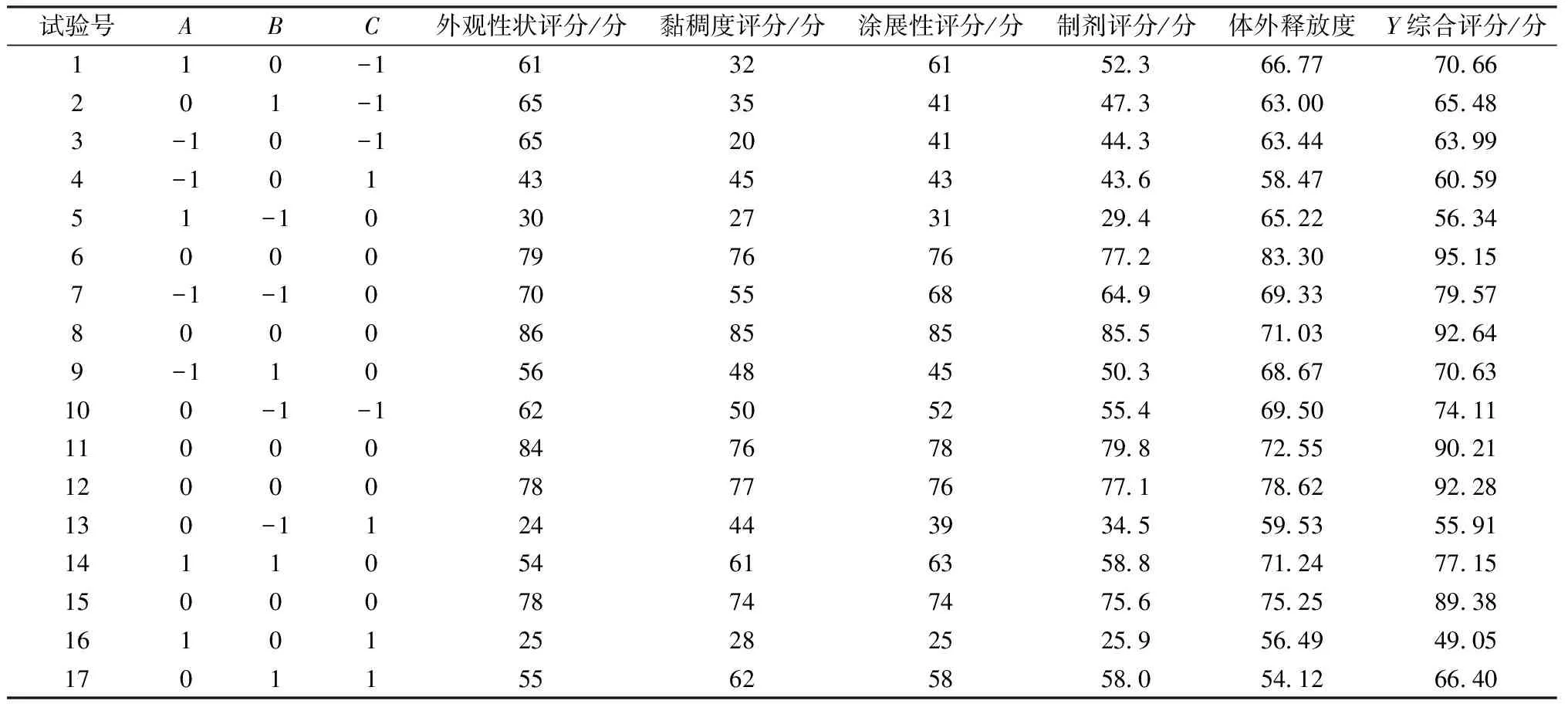
表7 试验设计与结果
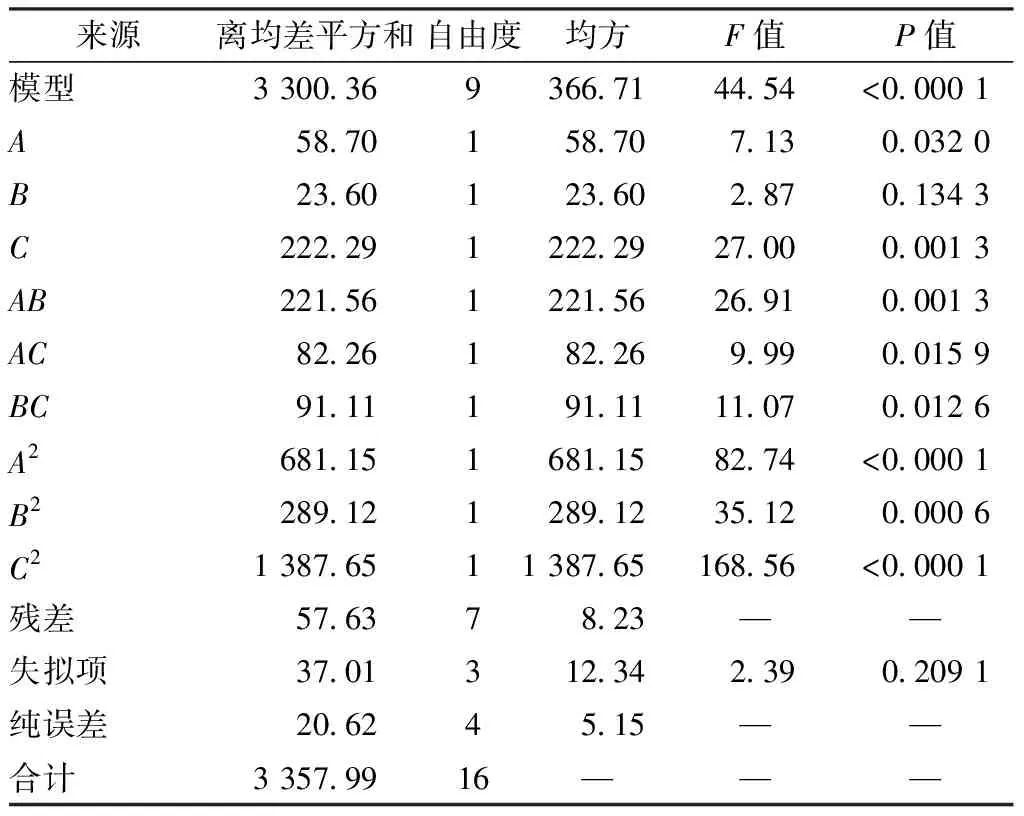
表8 方差分析
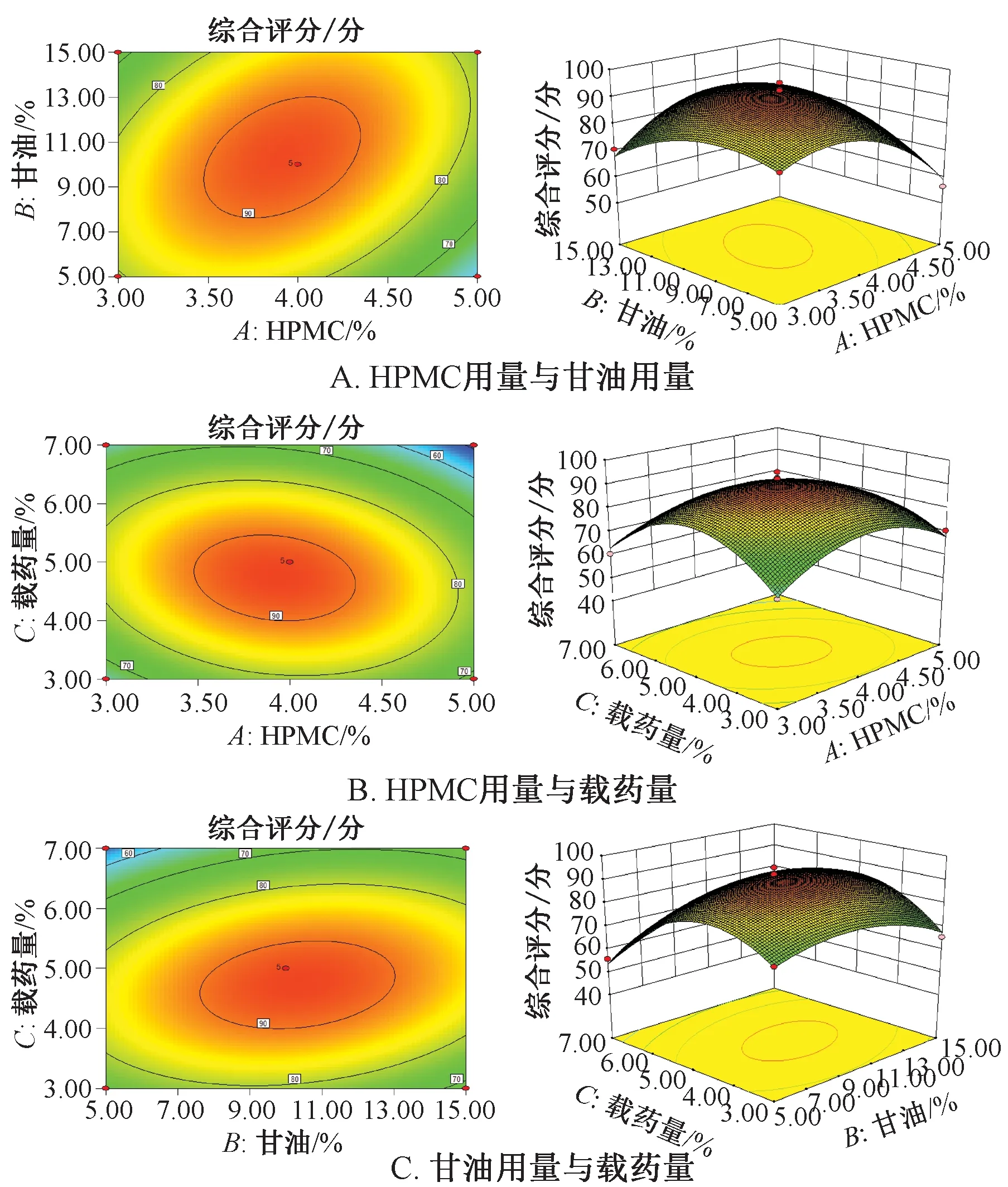
图1 各因素响应面图
2.6 验证试验 按上述优化工艺制备5批凝胶,进行验证试验,结果见表9,可知该工艺稳定可行。
2.7 体外释放度测定
2.7.1 线性关系考察 精密称取盐酸黄柏碱、盐酸小檗碱、欧前胡素、蛇床子素对照品2.82、28.65、2.42、4.07 mg,置于50 mL量瓶中,甲醇溶解定容至刻度,摇匀,精密吸取1、3、5、7、9 mL至20 mL量瓶中,甲醇定容至刻度。以质量浓度(X,μg/mL)为横坐标,峰面积(Y)为纵坐标进行回归,在“2.2”项色谱条件下进样测定,结果见表10,可知各成分在各自范围内线性关系良好。
2.7.2 提取物含量测定 精密称取“2.1”项下提取物0.1 g,置于100 mL锥形瓶中,精密加入50 mL甲醇,称定质量,超声提取30 min,放冷,甲醇补足减失的质量,滤过,取续滤液,作为供试品溶液,在“2.2”项色谱条件下进样测定,计算含量。结果,每1 g提取物含盐酸黄柏碱18.094 6 mg、盐酸小檗碱154.244 9 mg、欧前胡素9.951 8 mg、蛇床子素26.194 1 mg。

表9 验证试验结果(n=5)
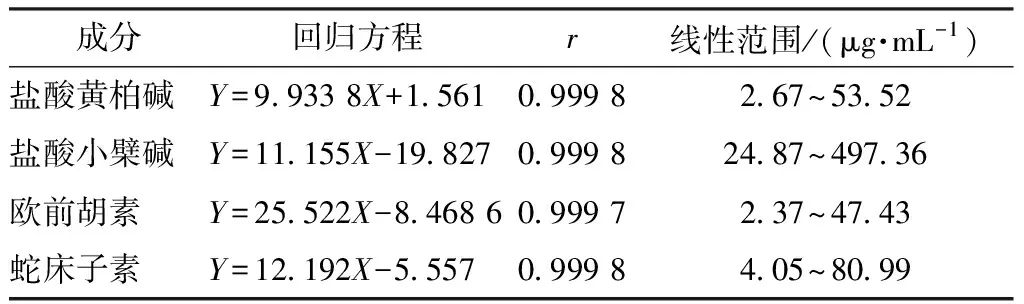
表10 各成分线性关系
2.7.3 测定方法 参照2015年版《中国药典》四部第三法[13],精密称取蛇黄凝胶1 g,置于透析袋(截留相对分子质量3 500)中,以含20%乙醇的生理盐水200 mL为接收液,将透析袋置于扩散池中,在温度(37±0.5) ℃、转速100 r/min条件下于1、2、4、6、8、10、12 h取接收液各5 mL,同时补充等温度、等体积的接收液,0.45 μm微孔滤膜过滤,取续滤液,在“2.2”项色谱条件下进样测定,计算各成分在不同时间点的累积释放度。
2.8 稳定性考察
2.8.1 耐高温试验 取5批蛇黄凝胶,在60 ℃下恒温加热12 h后取出,静置至室温,发现该制剂外观性状无明显变化,质地均匀细腻,黏稠度适中无变稀现象,易于涂布,表明其耐热性良好。
2.8.2 耐寒试验 取5批蛇黄凝胶适量,在-20 ℃下冷藏24 h后取出,静置至室温,发现该制剂外观性状无明显变化,也无分层、变稀现象,易于涂布,表明其耐寒性良好。
2.8.3 离心试验 取5批蛇黄凝胶,置于离心管中,4 500 r/min离心20 min,发现该制剂外观性状均匀,无分层、变稀现象,涂展性良好,表明其离心稳定性良好。
3 讨论
在药物处方筛选优化过程中,所用方法主要包括正交设计、均匀设计、Box-Behnken响应面法等,其中正交设计、均匀设计存在试验精密度较低、模型预测性较差等问题;Box-Behnken响应面法基于非线性模式进行研究,可确定在试验范围内任何试验点的预测值,具有试验次数少、精密度和结果可信度高、预测性好等优点[14-16]。本实验以制剂外观性状、体外释放度为评价指标,通过Box-Behnken响应面法优化蛇黄凝胶剂处方工艺,并进行验证试验,发现该工艺合理可行,稳定易控。
生物碱类成分易与卡波姆发生反应,从而导致凝胶黏度降低,产生不溶性沉淀。pH虽对基质黏度有较大影响,但本实验控制pH在卡波姆较为适宜成型的范围内依然无法成型,其原因可能是黄柏中主要提取出的生物碱为盐酸小檗碱,属季胺碱、强电解质,而离子浓度可影响整个凝胶系统的流变学行为,导致黏度降低。
课题组前期在药材成分含量测定中发现,酸性条件会导致蛇床子中有效成分欧前胡素发生结构转化,生成花椒毒素,后者虽具有一定抗炎抗菌作用,但其结构中的酚羟基在空气中易氧化为无效物质[17]。综合考虑制剂成型性、对药效成分保护作用、使用时对皮肤保护作用,最终拟定pH为7。
目前,市面上常用的中药凝胶剂较少,这与中药处方药味众多、成分复杂、辅料选择有限有一定关系。在后续中药凝胶剂的开发过程中,一方面应重点关注药效物质指认、提取、分离纯化;另一方面,应致力于新辅料研发,平衡药物与辅料、生物体之间的相容性,从而为相关研究提供新思路。
