TiO2纳米晶{001}面选择性沉积Co3O4及其光催化性能研究
2022-06-15李瑞瑞刘有智焦纬洲张巧玲
班 垚, 李瑞瑞, 刘有智, 焦纬洲, 张巧玲, 郭 婧
(1. 中北大学 化学工程与技术学院, 山西 太原 030051;2. 中北大学 超重力化工过程山西省重点实验室, 山西 太原 030051)
0 引 言
纺织品行业染料废水的多样性、 毒性和持久性等是水体污染的重要来源之一[1]. TiO2光催化剂因其无毒、 环保、 矿化彻底等优势在处理水体中低浓度有机污染物方面具有突出优势. 但TiO2的禁带宽度较宽, 光响应范围窄, 量子效率偏低, 限制了其实际应用, 通常需通过离子掺杂、 贵金属负载、 半导体复合等方法进行改性以提高其光催化效率[2-4]. 此外, 改变TiO2的晶面结构也可显著影响其光催化性能[5]. 研究表明, TiO2{101}与{001}面共同暴露可形成表面异质结, 有利于光生电子空穴的迁移和分离[6-7]. Yu等[8]通过控制HF用量制备了系列不同{101}和{001}晶面暴露比例的TiO2纳米晶, 当晶面比例为45∶55时, 其CO2还原制CH4的光催化活性最佳. Han等[9]以钛酸正丁酯为钛源, HF为形貌控制剂, 制备的89%{001}晶面暴露TiO2纳米片光催化降解甲基橙(MO)的效率远优于商业P25. Miao等[10]以TiF4为前驱体, 通过水热法处理TiF4-HCl溶液制备超过90%{001}晶面暴露的TiO2微球也显示出优异的光降解MO活性. 上述研究多使用容易致癌的含氟物质作为形貌控制剂, 因此, 需找到一种更加绿色环保的方法来制备{001}和{101}晶面共暴露的TiO2晶体. 钛酸钾纳米线因其水解速率慢, 可作为前驱体用于制备特定晶型的TiO2. Hong等[11]以钛酸钾纳米线为前驱体成功制备了独特的类纳米棒状TiO2晶体. Ye等[12]以钛酸钾纳米线为前驱体采用无氟形貌控制剂分别得到了{001}, {101}, {010}单一晶面暴露比例大于90%的TiO2纳米晶体.
半导体复合改性主要是利用改性材料与TiO2能带位置的差异来促进电子和空穴的转移, 抑制其复合. 此外, TiO2的光催化活性还强烈依赖于其晶型结构, {001}晶面活性更高, 倾向于容纳空穴, {101}晶面相对稳定, 倾向于容纳电子[13], 大多数无规随机沉积忽略了晶面效应, 往往会削弱其应有的强化作用. Liu等[14]利用选择性沉积制备的Fe2O3/TiO2/Pt催化剂的制氢能力分别是随机沉积和纯TiO2催化剂的2.2倍和30倍. Meng等[15]通过光沉积选择性地将MnOx和Pt分别沉积在TiO2的{001}面和{101}面, 构造的TiO2/MnOx/Pt三元复合材料光催化还原CO2制CH4和CH3OH的收率是未改性TiO2纳米片的3倍以上. 所以, TiO2的晶面调控与选择性沉积相结合可有效增强其光催化活性. Co3O4在水性介质中性质稳定, 禁带宽度窄(Eg为2.07 eV), 且其价带和导带位置均高于TiO2, 可促进TiO2光生电子和空穴的转移[16]. 此外, Co3O4可有效捕获空穴[17], 因此, 本文选取Co3O4为助催化剂, 选择性沉积在TiO2富空穴的{001}晶面以进一步提高其光催化活性.
综上, 本文以钛酸钾纳米线(KTNWs)为前驱体, (NH4)2CO3为形貌控制剂, 合成系列不同{001}面暴露比例的TiO2纳米颗粒, 在最优暴露比例的基础上选择性沉积Co3O4, 并选取罗丹明B染料为目标降解物探究其光催化降解性能.
1 试剂与仪器
1.1 试 剂
碳酸铵((NH4)2CO3, AR, 30% NH3), 硝酸钴(Co(NO3)2·6H2O, AR, 质量分数≥99%), 上海阿拉丁生化技术有限公司; 纳米二氧化钛(商业P25, 20 nm), 上海麦克林生化有限公司; 氢氧化钾(KOH, AR, 质量分数≥85%), 无水乙醇(CH3CH2OH, AR, 质量分数≥99.7%), 碘酸钾(KIO3, AR, 质量分数≥99.8%), 氯化钾(KCl, AR, 质量分数≥99.5%), 罗丹明B(RhB, AR), 天津光复精细化学研究所.
1.2 仪 器
D8 AdvanceX射线衍射仪(XRD), 德国布鲁克科技有限公司; Agilent cary 5000 紫外-可见漫反射(UV-Vis DRS), 美国安捷伦科技有限公司; Gemini SEM 300扫描电镜(SEM), 德国卡尔蔡司公司; X-MaxN50X射线能谱仪(EDS), 英国牛津仪器公司; Quantachrome Autosorb-iQ比表面积分析仪(BET),美国康塔公司; BrukerA 5000电子顺磁共振波谱仪(EPR), 德国Bruker公司.
2 实验方法
2.1 TiO2纳米晶的制备
将1 g P25加入到40 mL KOH溶液中(9.98 mol/L), 搅拌30 min; 在高压反应釜中200 ℃ 保温16 h, 产物经离心洗涤干燥得到KTNWs前驱体[18]. 将KTNWs和(NH4)2CO3超声分散在蒸馏水中形成白色悬浮液, 将悬浮液转移到高压反应釜中200 ℃下保温16 h. 反应后离心分离, 用蒸馏水和无水乙醇反复洗涤至上清液呈中性, 将产物在80 ℃下干燥. 通过改变(NH4)2CO3的浓度调整{001}晶面的暴露比例, 如表 1 所示, 分别将制备的TiO2纳米晶表示为0 Ti, 0.005 Ti, 0.01 Ti, 0.015 Ti, 0.02 Ti, 0.03 Ti, 0.04 Ti.
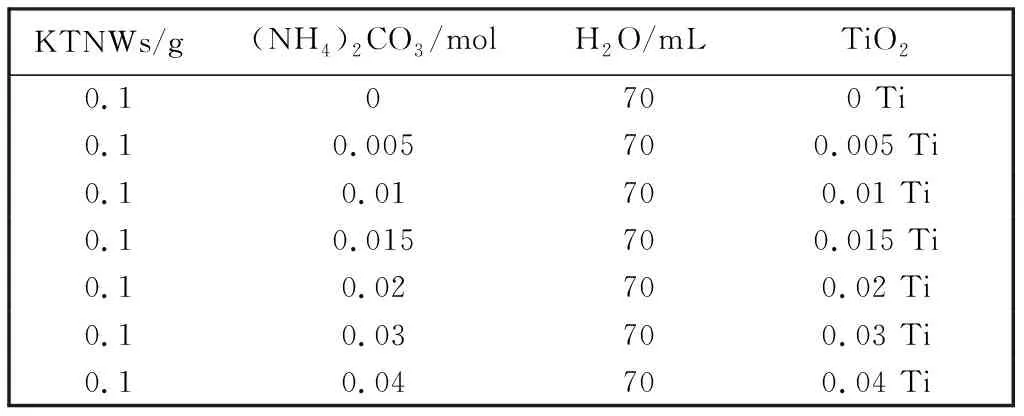
表 1 添加不同浓度(NH4)2CO3制备的TiO2
2.2 TiO2{001}晶面选择性沉积Co3O4
在{101}和{001}晶面最优暴露比例催化剂 0.005 Ti 上选择性沉积Co3O4. 以Co(NO3)2为前驱体, KIO3为电子清除剂, 通过光活化氧化在TiO2{001}面沉积Co3O4. 将50 mg TiO2分散在KIO3溶液中(0.01 mol/L), 加入适量30 mmol/L的Co(NO3)2溶液持续搅拌, 并在紫外灯下辐照2 h. 离心收集白色沉淀, 洗涤后将产物在烘箱中干燥. 如表 2 所示, 以0.005 Ti样品为基底, 通过调整Co(NO3)2的加入量制备系列不同Co3O4含量的样品, 产物分别标记为0.018% Ti-Co, 0.5% Ti-Co, 1% Ti-Co, 2% Ti-Co, 3% Ti-Co, 4% Ti-Co(其中0.018% Ti-Co表示Co/TiO2的质量比为0.018%).
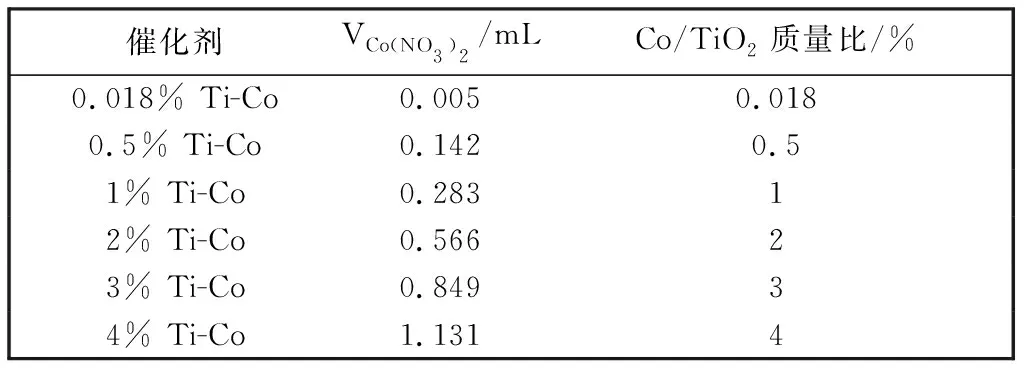
表 2 TiO2{001}晶面选择性沉积不同含量Co3O4
2.3 光催化降解RhB活性测试
称取30 mg TiO2样品加入至30 mL RhB(10 mg/ L)溶液中, 在15 W、 波长365 nm紫外灯下进行光催化实验. 在暗箱中搅拌30 min使染料在TiO2表面达到吸附-脱附平衡, 量取2 mL溶液, 离心分离获得上清液, 并在554 nm下测量溶液的吸光度值, 记录为A0.光照间隔固定时间取点, 测定其吸光度并记为At, 根据式(1)计算RhB的降解率R[19].
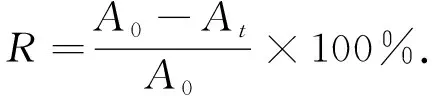
(1)
2.4 最优晶面暴露比例的计算
为确定最优光催化活性TiO2样品{001}晶面的暴露比例, 采用图 1 所示方法进行计算.
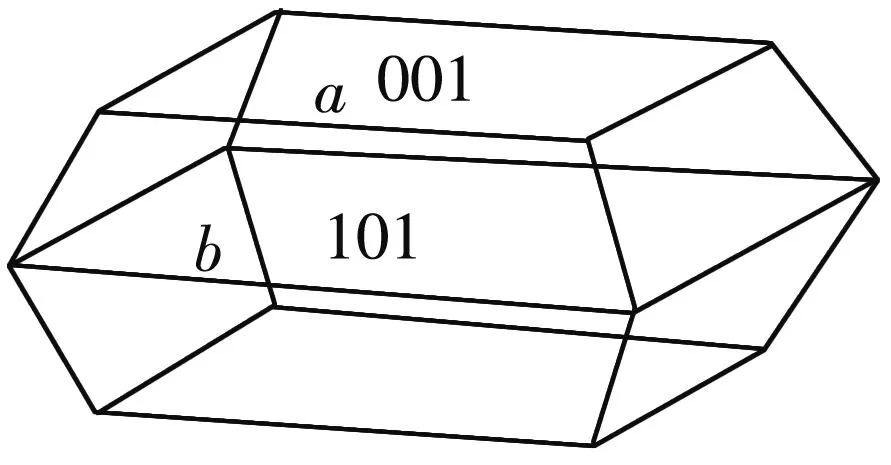
(a) TiO2纳米晶结构模型图
图 1(a) 为截断的十面双锥体锐钛型TiO2纳米晶结构模型图, 其由上下两个方形{001}面和8个梯形{101}面构成. 如图1(b)所示, TiO2纳米晶{001}面和{101}面的面积及{001}面所占比例可由式(2)~式(4)进行计算[20].
S001=2a2,
(2)
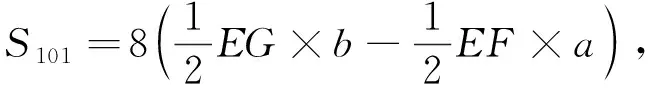
(3)
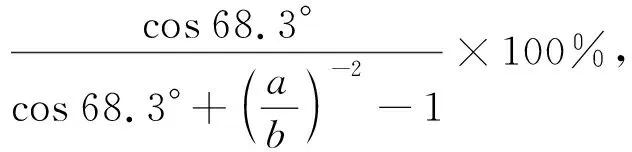
(4)
式中:θ为{001}和{101}晶面的面夹角理论值,θ=68.3°;a和b分别为十面体顶部{001}和{101}晶面共用边的边长和侧面{101}晶面共用边的边长, 且0≤a/b≤1.
2.5 光催化机理探究
分别加入硫代硫酸钠(Na2S2O3)、 叔丁醇(TBA)和乙二胺四乙酸二钠(EDTA-Na2)作为电子(e-)、 羟基自由基(·OH)和空穴(h+)的清除剂, 其他操作与光催化测试实验相同.
3 结果与讨论
3.1 SEM分析
为探究不同条件下TiO2纳米晶的生长趋势, 对系列TiO2样品进行了SEM测试. 图2(a)为所制备的KTNWs前驱体的SEM图, 由图可知P25与KOH混合后经水热可形成纳米线且分布较均匀. 图 2(b)~图 2(f)为所制备系列TiO2纳米晶的SEM图. 锐钛矿TiO2{001}, {101}, {100} 3个主要晶面的表面能分别为0.90 J·m-2, 0.44 J·m-2和 0.53 J·m-2[20], 在自然条件下TiO2会沿着高活性晶面生长, 最终暴露出低能{101}晶面以降低表面能, 因此, 在不添加形貌控制剂的情况下, TiO2主要是由热力学稳定的{101}晶面组成, 如图2(b) 所示, TiO2主要表现为暴露{101}晶面的八面双锥体结构, 而加入(NH4)2CO3形貌控制剂后, 其分解产生的碳酸根离子会吸附在{001}晶面从而有效降低{001}晶面的表面能, 使{001}晶面逐渐暴露[21]. 如图 2(c)~图2(e)所示, 加入(NH4)2CO3后TiO2样品出现{001}晶面, 且随着(NH4)2CO3浓度的增加, {001}面暴露比例逐渐增大, 形貌也由八面双锥体逐渐变为截断的十面双锥体结构, 上下两面是{001}面, 侧面8个等腰梯形是{101}面[22]. 由图 2(b)~图 2(e)可知, 随着(NH4)2CO3浓度的增加, TiO2的晶粒尺寸也不断增大, 由SEM图统计量取颗粒平均粒径得到颗粒平均粒径的分布图, 如图 3 所示. 由图 3 可知, 不加形貌控制剂的0Ti样品平均粒径约为48 nm, 加入形貌控制剂后样品0.01 Ti 的平均粒径约为78 nm, 随着(NH4)2CO3浓度的增加, 样品0.03 Ti的平均粒径约为85 nm. 如图2(f)所示, 进一步增加(NH4)2CO3浓度所形成的TiO2纳米颗粒形状不规则且表面较粗糙, 说明(NH4)2CO3浓度过高时会失去形貌控制能力. 以上分析表明, 形貌控制剂(NH4)2CO3可有效促进TiO2{001}面的形成, 可通过控制(NH4)2CO3的浓度来控制{001}面的暴露比例. 高活性{001}晶面的暴露可与{101}晶面形成表面异质结, 从而促进光生电子空穴对的迁移和分离, 利于TiO2光催化活性的提高.

图 2 TiO2纳米晶的SEM图

图 3 TiO2纳米晶粒径分布图
3.2 XRD分析
通过XRD测试来探究晶面调控所制备TiO2催化剂的晶型结构, 结果如图 4 所示. 由图可知, 0 Ti, 0.02 Ti, 0.05 Ti 的主要衍射峰均在25.18°, 37.90°, 48.09°, 53.96°, 55.00°, 63.71°, 68.76°, 70.31°和75.03°处, 分别对应于TiO2的 {101}, {004}, {200}, {105}, {211}, {204}, {116}, {220}和{215}面[23], 与锐钛型TiO2标准XRD式样一致(JCPDSNo.021-1272). 由此可知, 所制备样品均具有高度结晶的锐钛矿相, 无杂质相, 表明晶面调控制备的TiO2均为锐钛型TiO2.
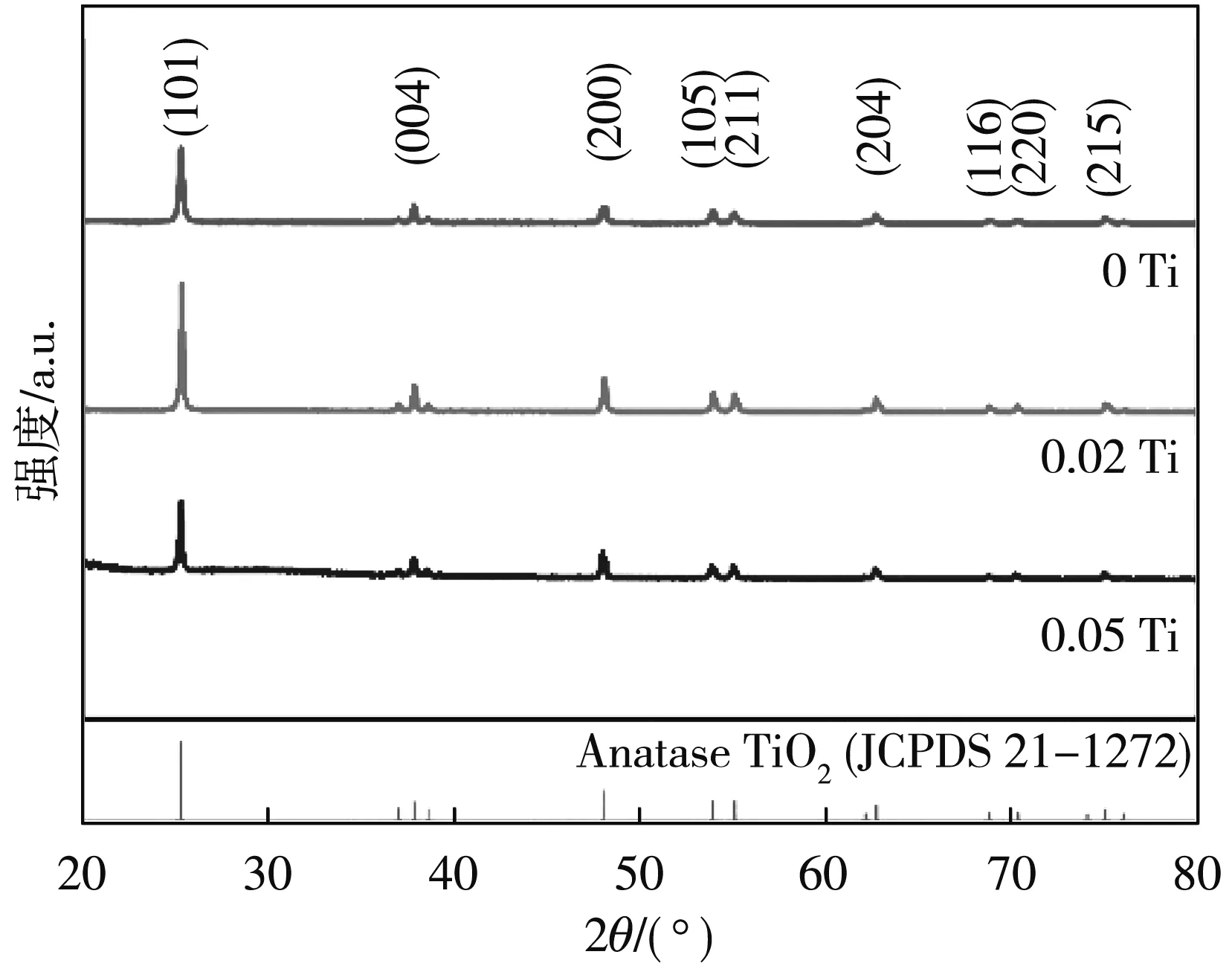
图 4 TiO2纳米晶XRD图谱
3.3 TiO2-Co3O4 EDS分析
由于TiO2{001}晶面与{101}晶面间存在表面异质结, 光生空穴和电子可以分别转移到{001}面与{101}面上, 因此, 在光化学反应中{001}晶面与{101}晶面分别提供了氧化位点和还原位点[14]. 光沉积时集中在{001}晶面上的空穴作为天然的氧化剂可诱导Co3O4的形成, 利于将Co3O4助催化剂选择性地负载到TiO2{001}晶面上. 采用EDS探究0.018% TiO2-Co3O4催化剂的元素构成及分布情况, 如图 5 所示. 由图 5(a) 可知, 样品存在Ti, O, Co信号, 表明Co3O4已成功负载在TiO2表面. 由图 5(b) 可知, Co元素亮点并非均匀分布于TiO2颗粒表面, 而是有明显的稀疏和稠密之分, 且多呈线形分布(如图 5(b) 标注所示), 这可间接表明Co3O4在TiO2的{001}晶面有选择性沉积的趋势, 在{101}晶面没有分布或分布较少. 由于Co3O4的价带位置较高, TiO2{001}晶面上的光生空穴易于转移到Co3O4上, 从而进一步促进光生电子与空穴的迁移和分离, 提高TiO2的光催化活性.

图 5 0.018% TiO2-Co3O4光催化剂的EDS mapping图
3.4 比表面积测定
催化剂比表面积是影响其催化性能的重要因素, 因此, 利用BET来测定系列催化剂的比表面积. 如表 3 所示, P25比表面积为105.961 m2·g-1, 未添加(NH4)2CO3制备的样品0 Ti比表面积为48.357 m2·g-1, 添加(NH4)2CO3的样品0.005 Ti 比表面积为28.434 m2·g-1, 所制备样品的比表面积明显小于商业P25, 随着(NH4)2CO3的加入, 其比表面积进一步降低, 该结果与SEM显示的样品粒径随(NH4)2CO3浓度的增加而增大的结果保持一致.
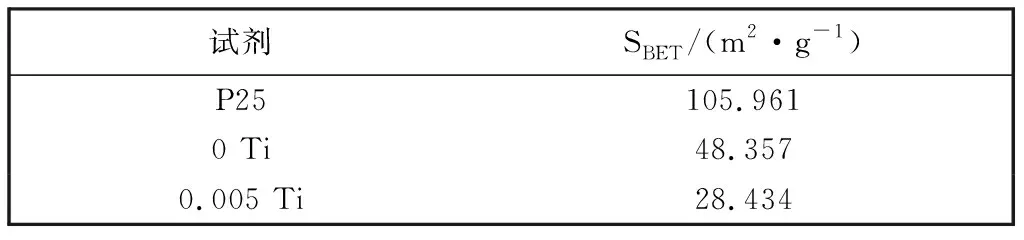
表 3 TiO2样品的比表面积
3.5 EIS测试
通过电化学阻抗谱(EIS)测试来探究所制备样品光生电子空穴的分离和复合情况, 阻抗半径越小表明光生电子空穴分离效率越高[24]. 图 6 为加入不同浓度(NH4)2CO3制备TiO2的EIS图, 由图可知, 所制备的样品中0.005 Ti的阻抗弧半径最小, 说明其光生电子空穴分离效率最高. 随着(NH4)2CO3浓度的增加, 阻抗半径逐渐增大, 这是因为{001}晶面过多会成为光生载流子的复合中心, 进而阻碍光生载流子的分离. 因此, 作为光催化剂TiO2{001}晶面的暴露比例并不是越高越好, 其存在最优比例.
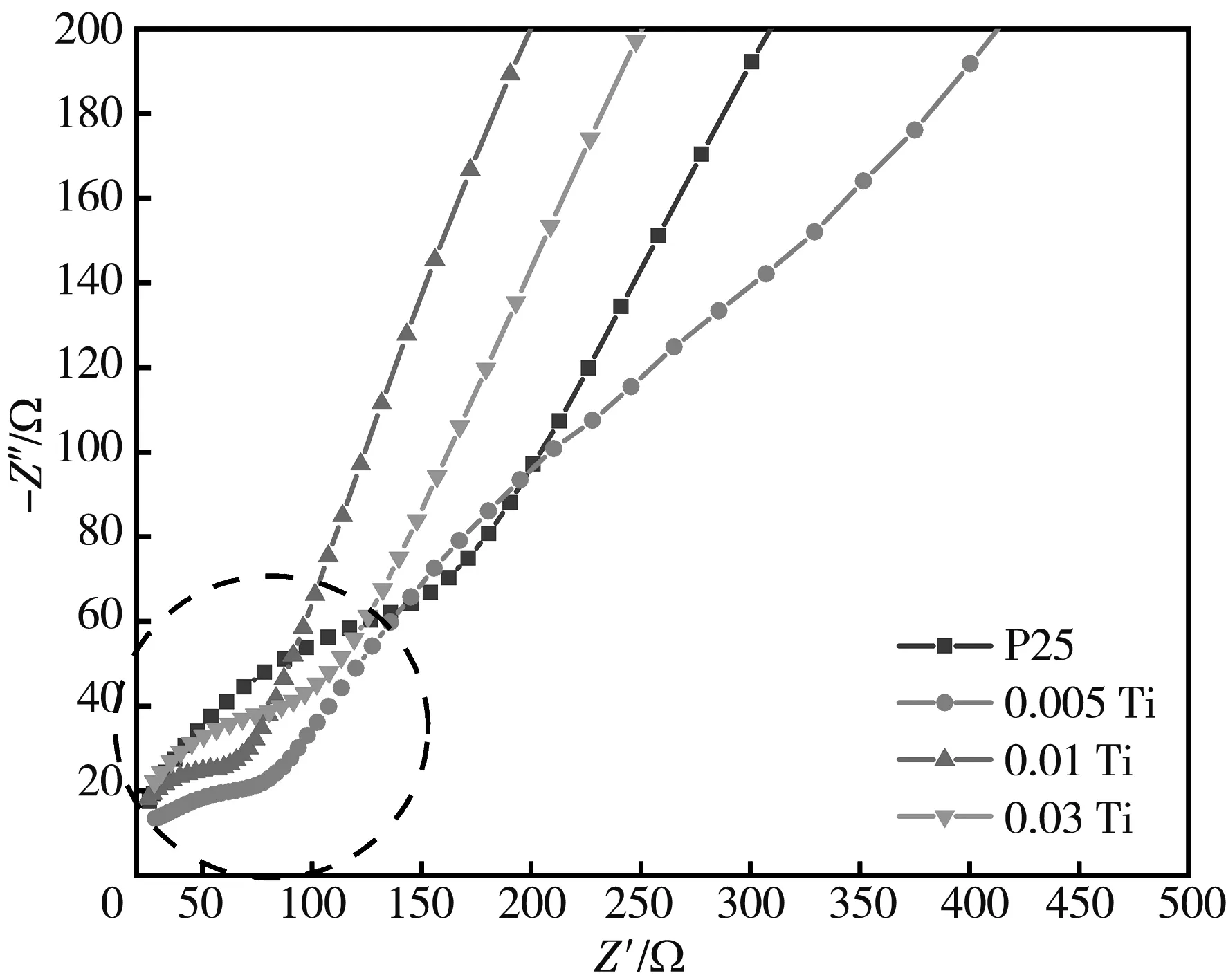
图 6 TiO2纳米晶的EIS图
3.6 紫外可见漫反射分析
通过UV-Vis DRS来分析晶面调控所制备TiO2样品的光响应范围, 研究晶面调控对光学带隙的影响, 结果如图 7 所示.
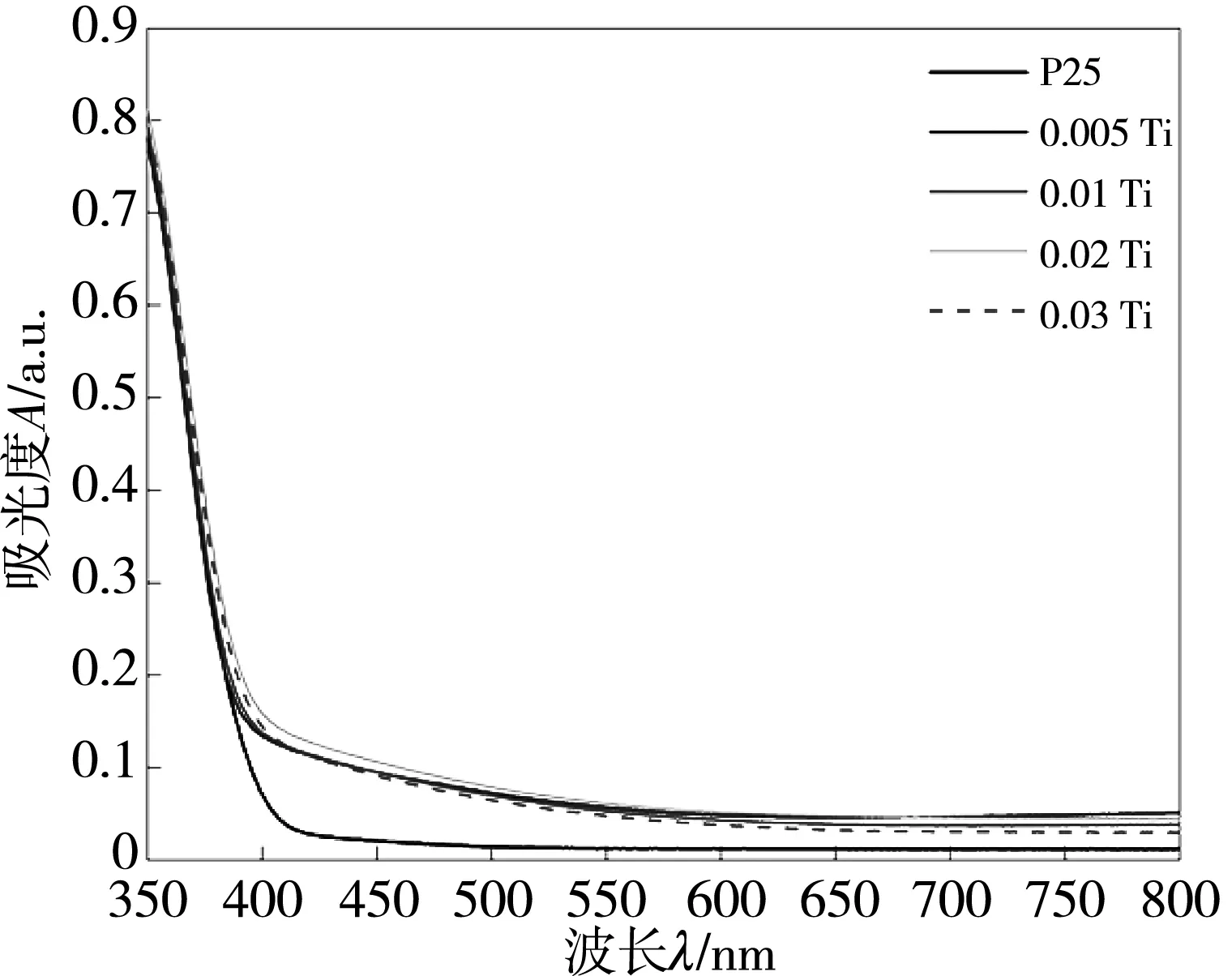
(a) 系列TiO2纳米晶光吸收范围图
由图可知, 所有样品的曲线形状相似, 表明晶面调控没有改变TiO2的晶型结构, 但所制备的系列TiO2相较商业P25的光吸收范围有所扩大, 提高了光能利用率, 且其最大吸收波长随(NH4)2CO3浓度的不同发生变化. 对图 7(a) 中各曲线在吸光度下降最为剧烈处做切线, 与X轴的交点即为光吸收范围的边界值. 由图 7(b) 可知, P25的吸收波长为400 nm, 0.005 Ti的吸收波长为406 nm, 0.01 Ti 的吸收波长为412 nm, 0.02 Ti 的吸收波长为416 nm, 0.03Ti的吸收波长为409 nm. 由公式λ=1 240/Eg得其带隙分别为3.10 eV, 3.05 eV, 3.00 eV, 2.98 eV, 3.03 eV, 由此可知, 晶面调控降低了TiO2的禁带宽度, 提高了其光能利用率.
3.7 光催化测试结果
3.7.1 TiO2纳米晶光催化性能测试
图 8(a) 为系列TiO2光催化降解RhB的活性图. 由图可知: 晶面调控TiO2光催化活性均优于P25; 随着(NH4)2CO3浓度的增加, 其光催化活性呈先增强后降低的趋势, (NH4)2CO3添加量为0.005 mol 即浓度为0.0714 mol/L时, 其光催化活性最强. 图 8(b) 为RhB降解动力学图, 图 8(c) 为0.005 Ti不同光照时间降解RhB的波长扫描. 以不同(NH4)2CO3浓度为横坐标,kapp为纵坐标作图得图 8(d). 由图 8 可知, 0.005 Ti样品光催化活性最强, 光照190 min时RhB的降解率达97%以上, 其具有最优的晶面暴露比例, 结合 0.005 Ti 样品的SEM图统计得,a边长度为30.29 nm,b边长度为 61.93 nm, 由式(2)~式(4) 计算可得此时{001}晶面的暴露比约为10%. 尽管0.005 Ti比表面积仅为P25的1/3, 其降解效率却是P25的3倍, 说明{001}和{101}面共暴露形成的表面异质结可明显提升TiO2纳米晶的光催化效率.

(a) 系列TiO2光降解RhB的活性图
3.7.2 选择性沉积Co3O4改性TiO2光催化降解RhB
为进一步提升光催化剂的催化活性, 在最优暴露比例样品0.005 Ti的{001}晶面上选择性沉积Co3O4, 考察不同Co3O4沉积量对改性TiO2光催化效果的影响. 由图 9 可知, 0.018% Ti-Co对RhB的光降解效率最高, 其光催化效率(0.012 75 min)约为P25(0.003 63 min)的3.5倍. 该结果表明, 选择性沉积Co3O4可进一步提升光催化剂的催化活性, 但其含量不是越高越好. 这是由于0.005 Ti样品{001}晶面占比较少, 容纳Co3O4的能力有限, 过量的Co3O4会覆盖TiO2{001}晶面的活性位点进而削弱其光催化活性, 此外过多的Co离子会成为光生电子和空穴的复合中心, 也会减弱其光催化活性.
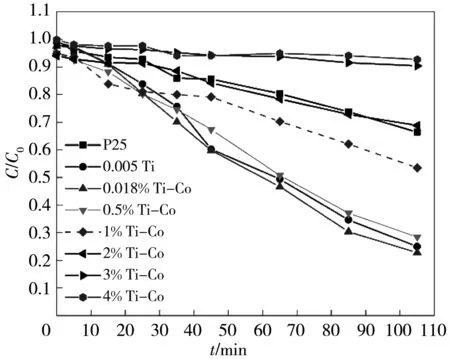
(a) TiO2-Co3O4光催化降解RhB的活性图
3.8 TiO2-Co3O4自由基捕获实验
为探究TiO2-Co3O4光降解的机理, 对 0.018% Ti-Co样品进行自由基捕获实验, 分别加入Na2S2O3, TBA和EDTA-Na2作为e-、 ·OH 和h+的捕获剂使自由基发生猝灭, 探究各自由基的作用. 由图 10 可知, 加入捕获剂可使 0.018% Ti-Co光催化活性得到抑制, 抑制效果强弱顺序为h+>·OH>e-, 表明在0.018% Ti-Co光催化降解RhB过程中h+是起主要作用的活性基团.
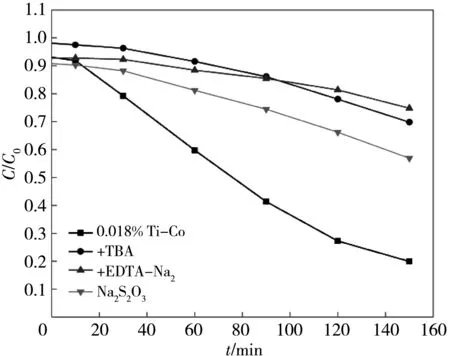
(a) 0.018% Ti-Co中加入不同抑制剂光催化降解RhB的活性图
3.9 EPR分析
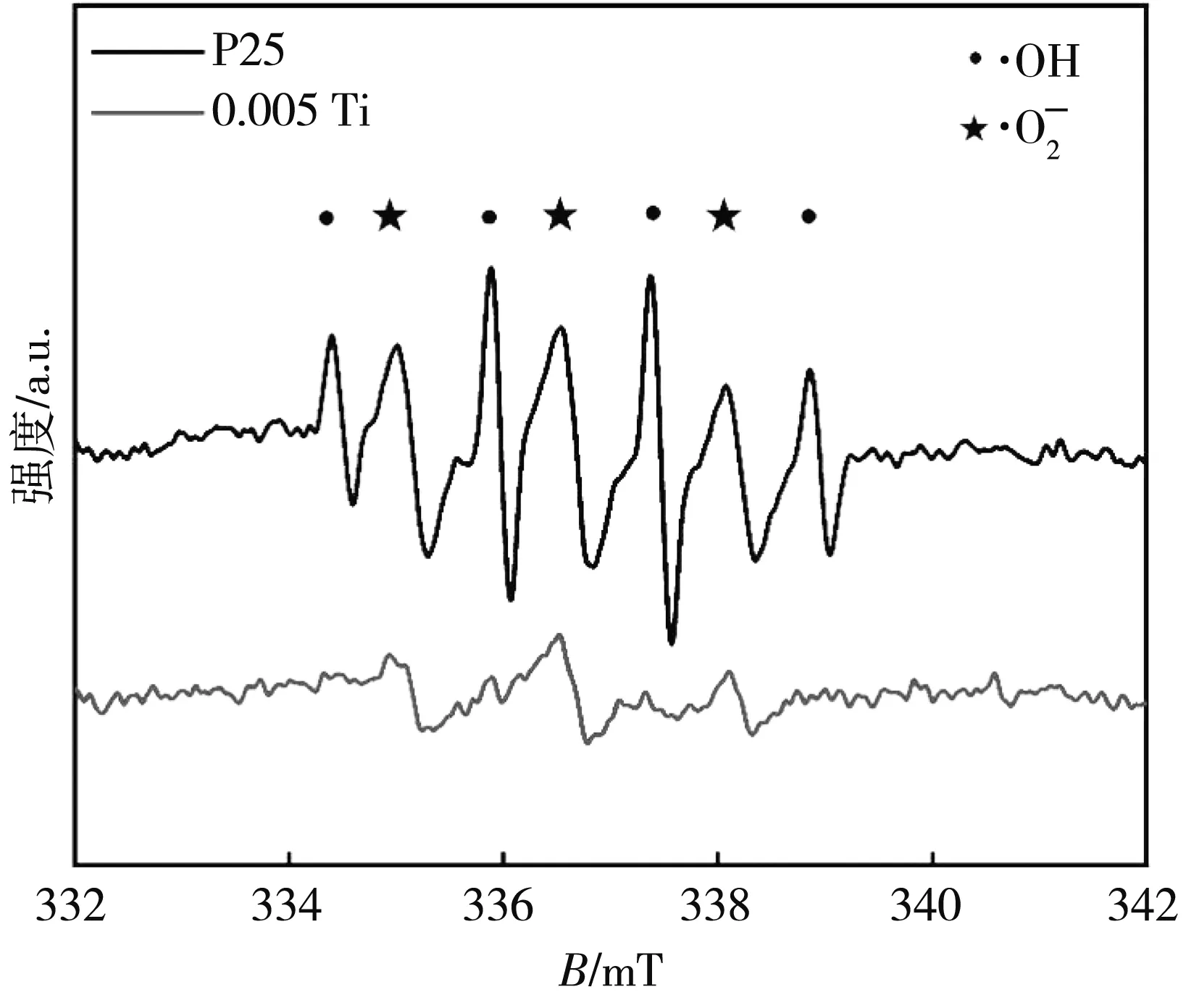
图 11 TiO2 样品的EPR图谱
4 TiO2-Co3O4光催化降解机理推测
图 12 为0.018% Ti-Co光降解机理示意图. 光照下, 0.018% Ti-Co样品中TiO2的电子被激发, 由价带(VB)跃迁至导带(CB), {001}和{101}表面异质结的存在可使光生电子和空穴分别向{101}和{001}晶面迁移, 促进了电子和空穴的分离.
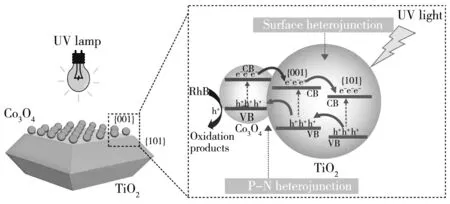
图 12 0.018% Ti-Co光降解机理示意图
通过光氧化过程在N型半导体TiO2富空穴的{001}晶面选择性附着P型半导体Co3O4, 在界面处形成了P-N结. 由于Co3O4的价带和导带位置均高于TiO2[16], 因此, 该P-N结可使{001}晶面的空穴进一步向Co3O4转移, 而光生电子倾向于向相反方向迁移, 表面异质结和P-N结的协同作用可有效促进光生电子和空穴的分离, 进而提升了其光降解RhB的活性.
5 结 论
本文采用水热无氟路线制备了暴露{001}晶面的锐钛型TiO2纳米晶. 通过改变形貌控制剂(NH4)2CO3的浓度可调整TiO2纳米晶{001}晶面的暴露情况. 由光催化实验可知{001}和{101}面的最佳暴露比例约为1∶9, 在此基础上对其进行Co3O4选择性沉积改性, Co3O4最佳沉积量约为0.018%, 其光催化效率是商业P25的3.5倍. Co3O4的选择性沉积和{101}与{001}晶面异质结的协同效应可促进光生电子和空穴的有效分离, 进而提高其光催化活性. 本研究表明, {101}和{001}晶面共暴露及选择性沉积改性可有效提升光催化剂的催化活性, 可为高活性光催化材料的设计和制备提供借鉴.
