不同抗血小板策略对高血压合并2型糖尿病病人冠脉搭桥术后桥血管通畅率的影响
2022-06-14王文君高峰石磊刘巍何学志庄熙晶
洋 王文君 高峰 石磊 刘巍 何学志 庄熙晶
桥血管通畅是冠脉搭桥术(coronary artery bypass grafting,CABG)疗效的重要保证[1]。抗血小板治疗可改善CABG术后桥血管通畅率[2]。高血压及2型糖尿病是冠心病病人常见的合并疾病,加速血管硬化进展[2-4]。我国常用抗血小板药物为阿司匹林+替格瑞洛/氯吡格雷[4]。但高血压合并2型糖尿病的CABG病人这两种治疗方式孰优孰劣尚无定论。本研究比较此两种抗血小板策略治疗高血压病合并2型糖尿病病人CABG术后1年的桥血管通畅率。
对象与方法
一、对象
2016年3月~2020年8月确诊或参照高血压及糖尿病诊疗指南初诊为高血压及2型糖尿病[2-3],于我院因冠心病择期行CABG的病人78例。排除标准:同期接受其他心脏手术;替格瑞洛/氯吡格雷禁忌证;同期接受肝酶诱导剂/抑制剂治疗;需肾脏替代治疗。本研究经我院伦理委员会批准。
二、方法
1.抗血小板治疗方法:A组予氯吡格雷75 mg,1日1次,口服。B组予替格瑞洛90 mg,1日2次,口服。且均规律服用阿司匹林及其他CABG术后二级预防药物[4]。
2.评价指标:包括心源性死亡、新发心肌梗死、心源性休克、新发心绞痛及脑出血、心包积血、失血性休克、眼内出血或输血超过2U的出血事件及其他小出血事件发生至术后1年。术后1年行CTA评估桥血管情况,FitzGibbon A级和B级为桥血管通畅[5]。
三、统计学方法
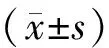
结果
1.两组一般临床基本资料比较见表1。结果表明,共纳入78例病人,根据随机数字法分为两组,A组41例,B组37例。两组一般资料比较,差异无统计学意义(P>0.05)。

表1 两组一般资料比较
2.不良事件:随访未见心源性死亡、心肌梗死、心源性休克、主要出血事件。A组2例、B组3例病人新发心绞痛(P=0.664)。A组8例、B组9例病人出现小型出血事件(P=0.607)
3.桥血管通畅率比较见表2。结果表明,两组总桥血管及动脉桥血管、不同靶血管的桥血管通畅率比较,差异无统计学意义(P>0.05)。B组静脉桥血管通畅率高于A组(76.8%vs.89.2%,P<0.05)。Logistic分析显示,替格瑞洛可降低静脉桥血管狭窄风险(OR=2.488,95%CI:1.016-6.091,P<0.05)。

表2 两组桥血管通畅情况比较(血管支,%)
讨论
阿司匹林联合P2Y12受体拮抗剂的双联抗血小板治疗被广泛应用于CABG术后二级预防[4]。糖尿病病人血糖调控能力下降,异常血糖会改变血流动力学,损伤血管内皮细胞[6]。长期高血压影响血管内皮细胞[7]。血管内皮损伤诱导血小板系统聚集和活化从而加速血管硬化[6-7]。因此,高血压合并2型糖尿病病人桥血管硬化的风险较一般人群显著升高。本研究发现,CABG术后1年时,应用替格瑞洛的病人静脉桥血管通畅率显著高于应用氯吡格雷的病人,可能与此两种P2Y12受体拮抗剂的抗血小板效果有关。
氯吡格雷为噻吩吡啶类衍生物类P2Y12受体拮抗剂,本身非活性药物,在口服后被小肠吸收分解,经肠道排出,少部分经CYP450代谢为活性产物,不可逆的与血小板表面ADP受体结合,达到抑制血小板聚集的作用,受肝酶细胞色素P450-2C19基因型影响较大[8]。替格瑞洛为环戊基三唑嘧啶类P2Y12受体拮抗剂,本身为活性药物,不受肝酶细胞色素P450-2C19基因型影响,为可逆性结合的二磷酸腺苷受体拮抗剂,原型及其活性代谢产物均有更快速、强效抑制血小板聚集的特点[9]。
本研究结果表明,虽然B组不同靶血管的静脉桥血管通畅率均高于A组,但各组间比较,差异无统计学意义。虽然既往基于PCI的研究结果表明,对于高缺血风险的病人,替格瑞洛可更好地降低不良心血管事件发生[8-9],但本研究未发现。
虽然替格瑞洛能更强地抑制血小板聚集从而可能有着更高的出血风险,但研究发现,与其他P2Y12受体拮抗剂相比,替格瑞洛并未显著增加出血事件风险[8-9]。与本研究结果一致。
高血压合并2型糖尿病病人接受CABG术后1年内,替格瑞洛可更好地降低静脉桥血管狭窄,并没有增加出血风险。本研究主要局限性在于:因研究规模所限,对于桥血管材料存在限制,并且样本量受限。未行抗血小板药物基因检测,可能存在抵抗因素。
