出口梗阻型便秘病人的差异表达蛋白及其生物学功能-基于同位素标记相对和绝对定量的蛋白质组学研究
2022-06-14李文哲万松林刘韦成吴云华江从庆钱群
李文哲 万松林 刘韦成 吴云华 江从庆 钱群
我国慢性便秘(chronic constipation,CC)患病率近年来明显上升,已经成为影响人们生活质量的一个重要因素[1]。据统计慢性便秘发病率达20%,在我国成人慢性便秘患病率为4%~6%,但是60岁以上人群慢性便秘患病率可高达22%[1]。慢性便秘主要类型为出口梗阻型便秘(obstructed defecation syndrome,ODS),临床表现为排便困难,排便过程肛门堵塞[2]。导致ODS的解剖学改变主要为直肠内脱垂,直肠前突等。虽然目前针对ODS治疗的方法较多,但临床疗效并不确切[1-2]。目前已有便秘治疗一线方案对这类慢性便秘主要类型治疗效果欠佳[3]。通过手术治疗短期效果尚可,但是存在急便感等并发症,影响病人术后满意度。随着随访时间延长,便秘复发比例增加。目前ODS治疗对于临床医生仍然是挑战[1,4-5]。我们采用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ) 技术,比较ODS病人与相应非便秘病人手术切除直肠标本中的差异蛋白谱,以了解ODS病人存在解剖学改变直肠蛋白质组表达差异。
对象与方法
一、对象
我院结直肠肛门外科2016年1~5月间收治直肠内脱垂/直肠前突导致出口梗阻型便秘病人20例,年龄31~82岁,平均年龄(62.3±15.3)岁。纳入标准:诊断均符合罗马Ⅳ便秘诊断标准[6]。排除标准:合并子宫阴道脱垂;合并直肠肛管炎症性疾病;盆底痉挛综合征或者耻骨直肠肌肥厚导致便秘;合并肛门直肠狭窄;合并慢传输便秘、肠易激综合征、炎症性肠病;合并精神疾病或者拒绝手术;合并肛门失禁。同期选取与入组病人的年龄、性别匹配的混合痔Ⅳ度脱垂病人10例,年龄29~88岁,平均(60.1±15.1)岁。所有病人均采用经肛门吻合器直肠切除术并收集手术切除直肠标本,术前完成慢传输试验,排粪造影,结肠镜检查。本研究经武汉大学中南医院医学伦理委员会批准(No.2015048),中国临床试验注册中心临床研究注册(No.ChiCTRORN-16007696),所有研究对象均签署知情同意书。
二、方法
1.实验方法:所有收集ODS组以及混合痔组切除直肠标本用预冷的PBS清洗;液氮充分研磨,将研磨后的粉末转移至离心管中。加入适量的lysis buffer(含有终浓度1% PMSF 的PBS溶液),冰浴超声5分钟;4 ℃,12 000 g离心10分钟,取上清;加等体积的100%乙腈溶液,混合均匀,冰上放置1小时;沉淀完成后10 000 g离心10分钟,取除沉淀外的所有上清液;冷冻抽干至体积缩小一半后,用预先润湿的10 kD超滤管10 000 g,4 ℃离心20分钟,然后用200 μl超纯水重复上述操作,收集穿透液,加入1%的甲酸调pH至2~3。在-80 ℃下保存待测。共分为2组进行实验,包括ODS组、对照组(混合痔组),各自将组内所有样本进行混合。取适量样本用Bradford法进行蛋白定量,根据标准曲线和蛋白样品稀释倍数计算出蛋白浓度,进行酶解除盐,iTRAQ标记后进行肽段组分分离,最后进行液相色谱-多级质谱联用分析。
2.生物信息分析:为了研究所鉴定蛋白的生理功能,我们将上述鉴定的显著差异表达蛋白和NR动物库进行blast比对,然后借助blast2go软件将蛋白映射到基因本体论(GO),从而实现蛋白的GO功能注释和富集分析;为了研究所鉴定的显著差异蛋白可能参与的通路途径,我们使用京都基因与基因组百科全书 Pathway数据库进行通路富集分析。GO富集分析和KEGG Pathway富集分析均采用费舍尔精确检验,并认为P-value≤0.05作为显著富集的功能条目。我们采用软件信号肽(SignalP)4.0进行蛋白的信号肽预测,最后根据软件的Dmax得分来评估蛋白是否含有信号肽区及信号肽区域,结果以Dmax为0.45作为阈值,大于0.45则认为蛋白含信号肽区域。
结果
1.质量检测:电泳结果显示总蛋白提取质量较好,总量足够,各组样本分离情况佳且基本相同,见图1;色谱-质谱分析中,肽段长度整体集中在10aa附近,表明酶解正常,质谱性能稳定,见图2,可进行下一步实验。

注:1、2分别为ODS组、混合痔组,M为电泳条带标志物。图1 两组样本SDS-PAGE 电泳图
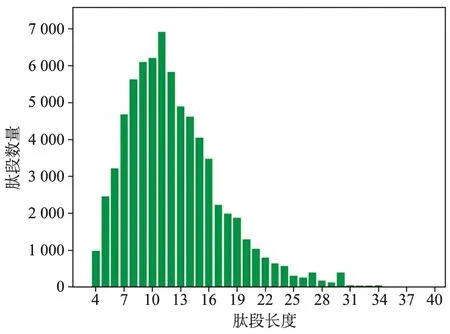
图2 肽段长度分布图
2.质谱数据检测结果:共采集到153 332张二级谱图,其中有52 560张得以解析,共对应29 455种肽段,匹配到3 122种蛋白group。
3.生物信息学分析结果:(1)定量分析:质谱下机数据通过ProteinPilot V4.5(AB SCIEX,USA)与Uniprot人属蛋白数据库进行匹配分析,按照Unused得分在1.3以上匹配结果进行筛选,从质谱数据中匹配上29 455个肽段,共3 122个蛋白,部分信息见表1。(2)差异分析:本研究根据蛋白质组学定量结果,在ODS组:混合痔组中,通过控制筛选中标准差异系数(Fold Change,FC)和矫正后的假定概率(Adjust.P value,adj.P)的阈值来实现差异筛选。本研究使用的筛选阈值为FC≥1.5或FC≤0.667及adj.P≤0.05,共筛选出了164个显著差异的蛋白(上调蛋白88种,下调蛋白76种)。见图3。(3)GO分析:对ODS组以及混合痔组相比的164种差异表达蛋白进行GO功能分类,涉及20种生物学过程、3种细胞组分和15种分子功能。其中,生物过程包括细胞进程(154种差异蛋白)、生物调节(129种差异蛋白)、代谢过程(88种差异蛋白)、刺激反应(75种差异表达蛋白)、运动(23种差异蛋白)、免疫系统过程(34种差异表达蛋白)、行为(6种差异表达蛋白)、生长(6种差异表达蛋白)等,分子功能主要表现为结合(157种差异表达蛋白)、催化活性(56种差异表达蛋白)、结构分子活性(35差异表达蛋白)、运输活性(14种差异表达蛋白)、抗氧化活性(8种差异蛋白)等,细胞组分主要为细胞解剖实体(163种差异表达蛋白)、含蛋白复合体(74种差异表达蛋白)、病毒组件(1种差异表达蛋白)等,见图4。(4)KEGG通路分析:对ODS组以及混合痔组比较的差异表达蛋白经过KEGG Pathway注释,共涉216条条通路,包括代谢通路(27种差异表达蛋白)、糖尿病性心肌病(13种差异表达蛋白)、阿尔茨海默病(10种差异表达蛋白)、血小板激活(10种差异表达蛋白)等,特别地,注释到较多神经性相关疾病的通路,见图5。(5)SignalP分析:为了研究可能的信号肽,我们使用SignalP 4.0进行蛋白的信号肽预测。
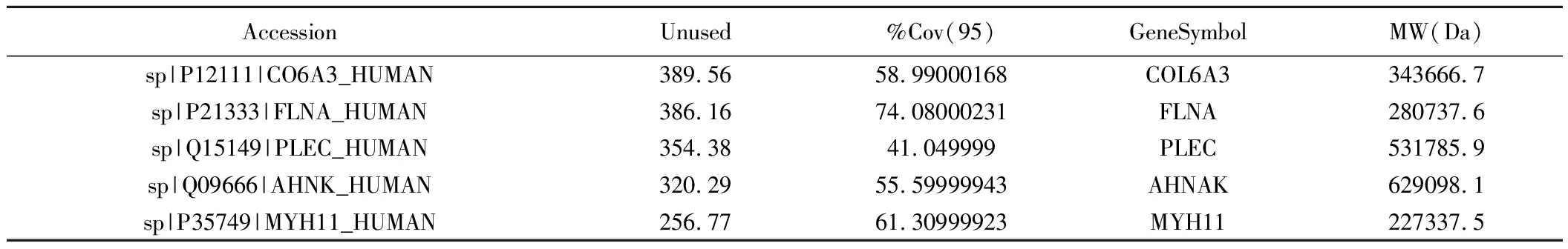
表1 Unused得分排名前5的蛋白结果
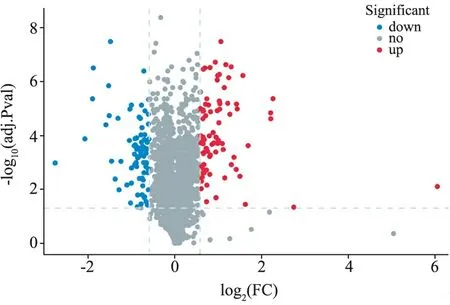
图3 差异蛋白火山图
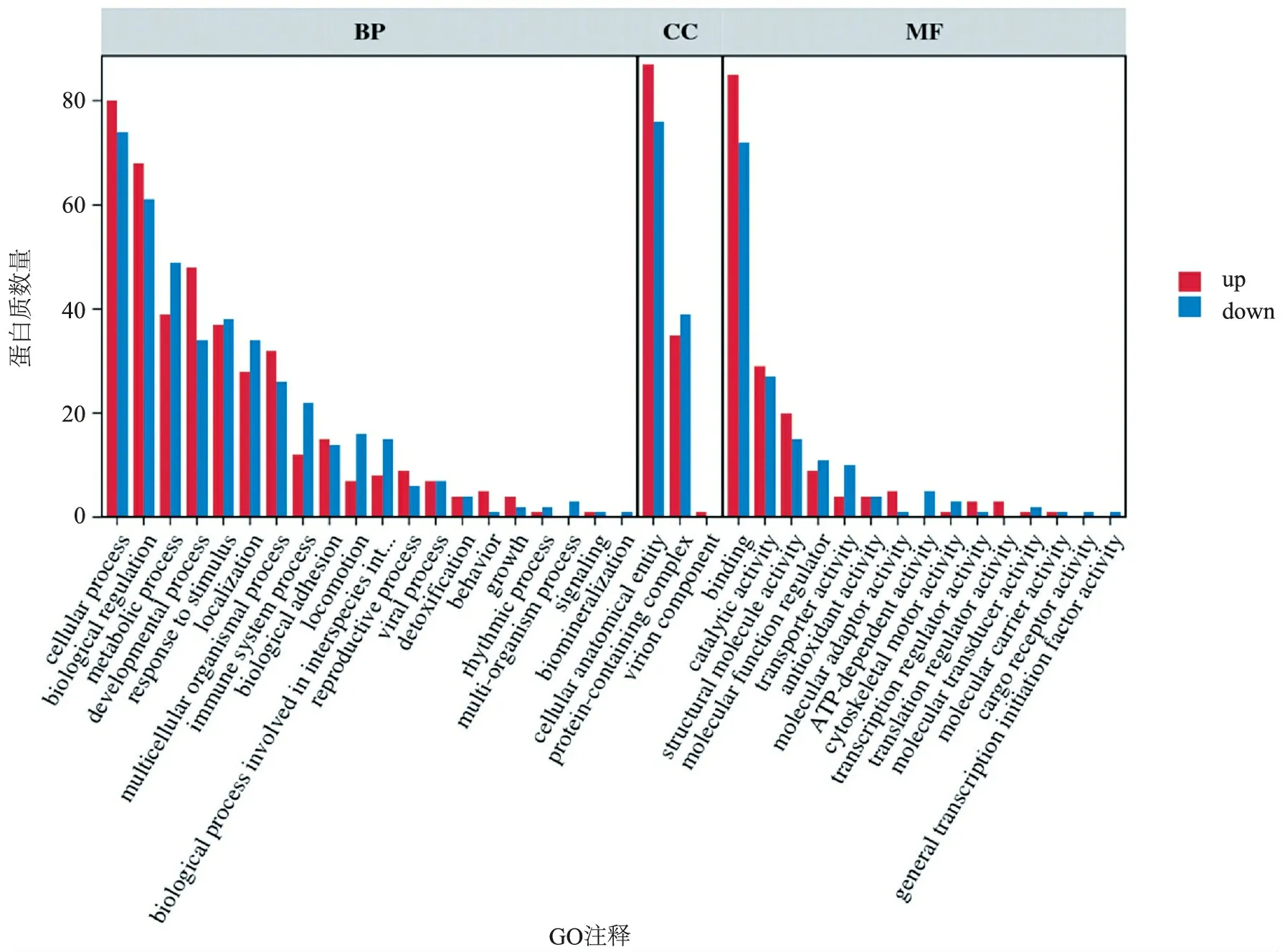
图4 差异蛋白GO注释
在164种差异蛋白中,我们预测到有42种蛋白可能是信号肽,如基质金属蛋白酶(MMP9,在细胞外基质的局部蛋白水解和白细胞迁移中起重要作用)、IGKV3-20(免疫球蛋白轻链可变区域的V区,参与抗原识别)、DEFA3(防御素2和防御素3具有抗生素、杀菌剂和抗病毒活性)等。(6)PPI互作分析:在针对差异蛋白的GO,KEGG注释结果中,我们发现许多神经调控通路以及神经疾病相关的蛋白都出现了显著的上下调差异。为了寻找神经调控与ODS之间可能存在的潜在联系,在注释结果中我们筛选出了两个在功能注释中明显富集的通路negative regulation of neuron apoptotic process(GO-biological process)和Neurodegenerative disease(KEGG),共24个蛋白进行了蛋白互作分析(protein-protein interaction,PPI),见图6,其中红色为上调蛋白,蓝色为下调蛋白,灰色为通路名。
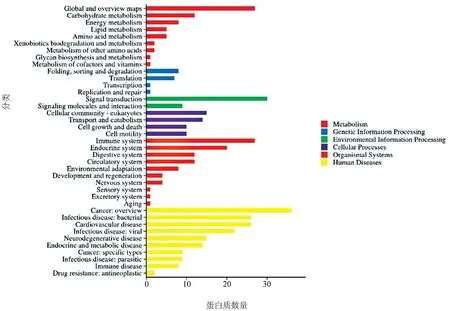
图5 差异蛋白KEGG Pathway注释结果
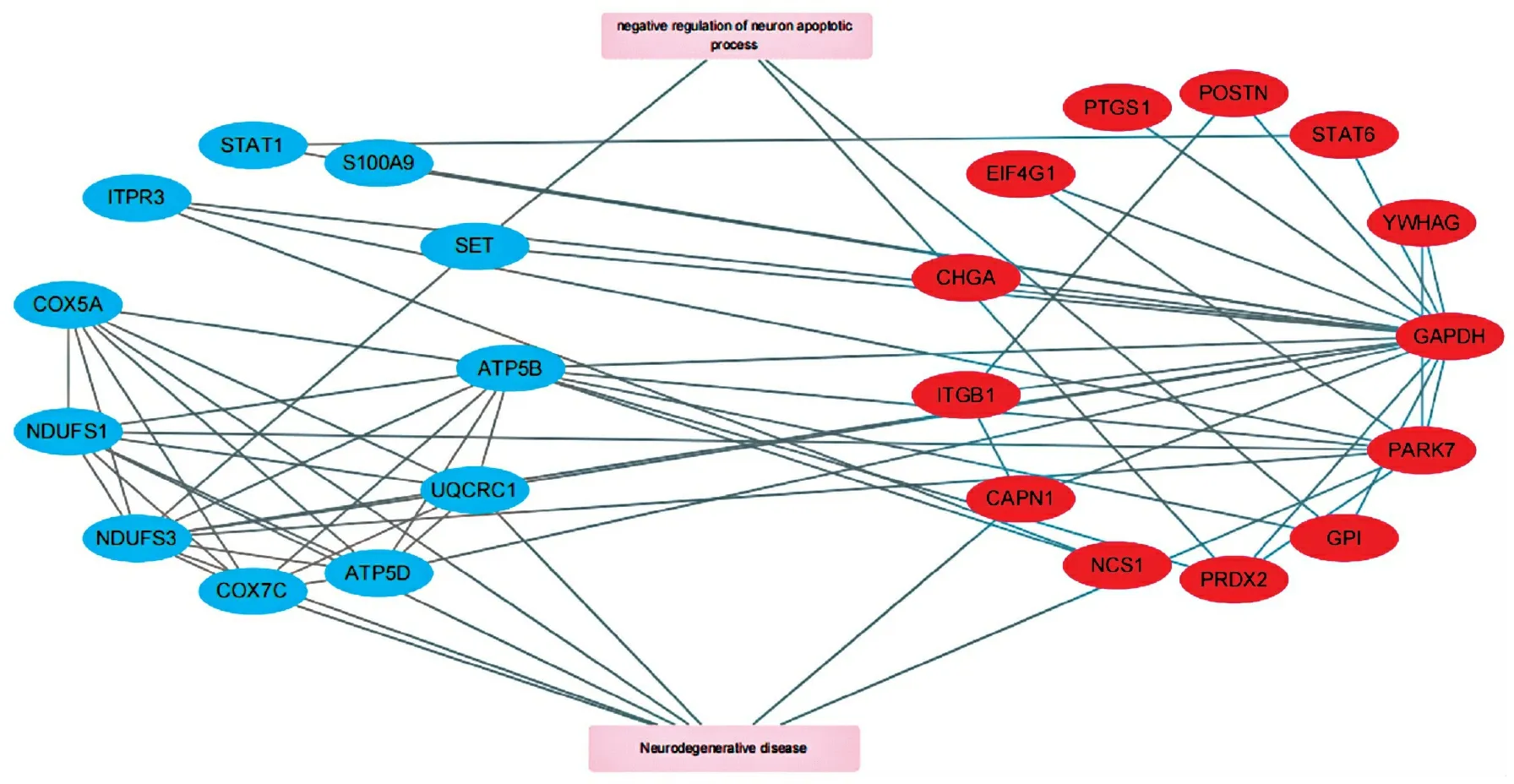
图6 PPI互作分析结果
讨论
直肠内脱垂、直肠前突是导致ODS症状主要解剖学异常。目前,临床对ODS病人一线治疗方案主要为饮食调节、常规泻剂、生物反馈等行保守治疗,但疗效并不确切[1-2]。保守治疗无效病人需要手术切除直肠内脱垂、直肠前突部分恢复正常解剖学结构。手术治疗的短期疗效尚可,但随着手术时间推移,病人便秘症状多再次出现[1,3-5]。因此,存在相当数量ODS病人经过保守甚至手术治疗后依然需要泻剂等辅助排便。
基于质谱的高通量蛋白质组学是研究大规模蛋白质表征的核心技术,是一个多组学研究领域,旨在有效整合基因组学、转录组学和蛋白质组学。通过这种方法,可以识别可能对疾病发展,特别是新的病人特异性蛋白形式。通过蛋白质组学能够更好地解释疾病的分子机制,识别病人特异性蛋白质形式并更好地了解疾病的分子机制,进而为精准和个性化医疗开辟道路[7-8]。
目前,在外科研究领域,蛋白质组学研究主要集中在肿瘤相关疾病,对于功能性疾病蛋白质组学研究较少,对于ODS的蛋白质组学研究尚鲜见报道[9-10]。iTRAQ 蛋白质组学技术作为一种新的蛋白质定量技术,能够提供有关疾病对蛋白质改变影响的信息,可以同时筛查疾病中几乎全部蛋白质的改变,以及对疾病治疗所涉及的潜在机制和途径的深入了解,从而发现致病过程中的关键蛋白质分子[11]。
我们利用iTRAQ技术分析ODS组以及混合痔组病人组织标本中差异蛋白的表达谱,结果显示,ODS组与混合痔组比较,88种蛋白质表达水平升高,76种蛋白质表达水平降低。ODS组以及混合痔组之间的差异表达蛋白中,共涉及216条通路,包括代谢通路(27种差异表达蛋白)、糖尿病性心肌病(13种差异表达蛋白)、阿尔茨海默病(10种差异表达蛋白)、血小板激活(10种差异表达蛋白)等,特别地,注释到较多神经性相关疾病的通路,具有临床意义。
线粒体是细胞进行有氧呼吸的主要场所,为细胞的生命活动提供能量,在细胞能量代谢、维持氧化还原平衡和调节细胞凋亡中起着重要作用[12]。线粒体功能障碍在多种疾病过程中发挥重要作用,如神经系统疾病、肾脏疾病、肝脏疾病、心血管疾病、癌症等[13-15]。线粒体呼吸链是线粒体的主要功能单元,线粒体呼吸链是由复合体Ⅰ(NADH-泛醌还原酶)、Ⅱ(琥珀酸-泛醌还原酶)、 Ⅲ(泛醌-细胞色素C还原酶)、 Ⅳ(细胞色素C氧化酶)、Ⅴ(ATP合成酶)组成。在氧化磷酸化过程中,线粒体呼吸链上的大部分电子向下传递到细胞色素C氧化酶,然后与质子和氧反应形成水。但是电子在经过线粒体呼吸链传递过程中极易发生逃逸,与氧反应形成超氧阴离子(O2-)自由基, 进而形成过氧化氢(H2O2)等[16]。线粒体是细胞中ROS形成的主要部位。在本研究中,我们发现,在ODS病人的直肠组织标本中线粒体呼吸链上多个蛋白发生明显变化,包括NDUFS1和NDUFS3(复合体I的亚基),COX5A 和COX7C(复合体IV的亚基),ATP5B 和 ATP5D(复合体V的亚基)。其中,NDUFS1是线粒体复合体I最大的核心亚基,在维持复合体I的结构和功能方面起关键作用。在成纤维细胞以及星形胶质细胞与神经元中的研究发现,NDUFS1 表达降低不利于线粒体复合体I 组装成超级复合体,削弱氧气消耗,导致线粒体ROS 升高。因此,我们推测线粒体呼吸链损害导致的线粒体ROS增多或细胞氧化应激可能通过某些通路参与到ODS的发病过程。
脑组织具有很高的能量需求,有研究表明,线粒体功能障碍是抑郁症、自闭症和双相情感障碍等精神疾病病理生理学的潜在机制[17-18]。在线粒体一系列的生理活动中,氧化磷酸化是为细胞提供能量的重要环节。有研究发现,COX5A、COX5B等参与氧化磷酸化的蛋白质在抗压模型小鼠中表达上调,这些蛋白的调节为小鼠面对压力应激时提供保护,降低其患抑郁症等精神性疾病的风险[19]。而在我们的研究中,COX5A蛋白表达下调,这可能说明ODS病人同时患上抑郁症等精神疾病的风险会增加。
ITPR3基因可编码肌醇1,4,5三磷酸受体(IP3R)[20],后者可介导Ca2+从内质网释放到细胞质,该信号传导途径被证实与哺乳动物脑神经功能、外分泌等重要生理活动密切相关[21-22]。IP3R可在胃肠道的肌肉细胞中表达[23],也可在肠道神经元上发生表达[24],胃肠道平滑肌收缩障碍或者胃肠神经元受损均可导致胃肠道消化功能障碍。有研究发现,IP3R在调节体内肠道的生理功能中起着关键作用,缺乏IP3R的小鼠肠动力显著减弱,全肠道传输时间延长,导致假性肠梗阻,这说明IP3R可能和维持肠道的正常生理功能有关。同时,这项研究中初步发现IP3R的缺乏可能会导致肠神经元结构的细胞分化和功能出现微小的畸形或缺陷[23]。本研究发现,ODS病人直肠组织标本中ITPR3表达发生下调。因此,ITPR3的表达变化可能与ODS的潜在发病机制有一定的相关性。
综上所述,基于iTRAQ技术的蛋白质组学分析发现,ODS病人以及混合痔病人之间存在较多差异表达蛋白,这些蛋白质涉及包括免疫过程在内的众多生物学过程及分子功能,可能参与了ODS分子发病机制。
