脾多肽注射液与R- CHOP 方案在弥漫大B 细胞淋巴瘤中的疗效及对机体免疫功能、VEGF、bFGF 水平的影响分析
2022-06-13张倩颜宗海
张倩 ,颜宗海
1.杭州市余杭区良渚医院内科,浙江杭州 311100;2.安徽医科大学附属巢湖医院血液内科,安徽合肥 238000
弥漫大B 细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤中较为常见的一种病理亚型,不同DLBCL 患者临床表现、病灶组织形态及预后情况均存在显著差异,是一种较为复杂的恶性肿瘤。据相关研究数据显示,DLBCL 在我国的发病率可高达40%左右,该病好发于中老年群体,相较于女性群体,男性群体的发病风险相对较高[1]。 DLBCL 患者的淋巴结生理结构大多会被肉瘤状组织破坏并取代, 经内镜检查可见存在明显异质性的大细胞在组织内呈弥漫分布状, 其发病多是由于免疫系统内的细胞恶变所致, 目前临床对DLBCL 患者进行诊断时主要依靠病理组织学和免疫组化学, 细胞内的免疫因子水平对该类患者的病情发展及预后评估有着重要意义[2]。 针对DLBCL患者此前常用的为CHOP 化疗方案, 该疗法可一定程度上保证患者的治愈率,近年来,随着医疗技术的不断发展,利妥昔单抗+CHOP,即R-CHOP 化疗方案逐渐取代传统CHOP,成为DLBCL 患者的一线治疗方案, 该方案对提升患者的治疗效果有着一定促进作用[3]。脾多肽注射液是一种治疗免疫缺陷病的辅助用药, 对改善肿瘤患者组织恶变及预后有着重要意义。 为进一步提高DLBCL 患者的临床疗效、改善患者预后, 该研究选取2019 年10 月—2021 年10月期间该院收治的84 例DLBCL 患者为研究对象,对采用脾多肽注射液联合R-CHOP 化疗方案治疗的效果进行深入探讨, 并进一步分析此联合治疗方案对患者免疫功能、血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)水平的影响。 现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的84 例弥漫大B 细胞淋巴瘤为研究对象, 采用随机数字表法将其分为研究组和对照组,每组 42 例。 研究组中男 22 例(52.38%)、女 20例(47.62%);年龄 40~70 岁,平均(55.41±5.59)岁;疾病分期:Ⅰ~Ⅱ期 19 例(45.24%)、Ⅲ~Ⅳ期 23 例(54.76%);首次淋巴瘤国际预后指数(IPI)评分为 1~4 分,平均(2.51±0.49)分。对照组中男 24 例(57.14%)、女 18 例(42.86%);年龄 42~68 岁,平均(55.36±5.64)岁;疾病分期:Ⅰ~Ⅱ期 20 例(47.62%)、Ⅲ~Ⅳ期 22 例(52.38%);首次 IPI 评分为 2~3 分,平均(2.43±0.57)分。 两组患者的性别、年龄、疾病分期、IPI 指数等临床资料比较,差异无统计学意义(P>0.05),具有可比性。 纳入标准:①均符合中国临床肿瘤学会(CSCO)提出的《淋巴瘤诊疗指南》[4]中关于弥漫大B 细胞淋巴瘤临床诊断标准; ②经临床评估其功能状态评分(KPS)均在 70 分以上、体力状况评分(ZPS)均在 2分以下[5];③符合R-CHOP 化疗相关适应证;④预计生存周期均在3 个月以上。排除标准:①对化疗不耐受者或存在高危风险因素者; ②已知对该研究所用药物既往存在严重过敏史者; ③依从性较差不愿配合者。该研究经过该院医学伦理会批准,入组患者均为自愿参与该研究。
1.2 方法
R-CHOP 化疗方案:该化疗方案由利妥昔单抗(R)、环磷酰胺(C)、多柔比星(H)、长春新碱(O)、泼尼松龙(P)5 种化疗药物组成,常规利妥昔前应用预防过敏。 第1 天(D0)予以利妥昔单抗(国药准字S20200022;规格:100 mg,10 mL/瓶)按 375 mg/m2剂量经静脉滴注;第2 天(D1)起则予以环磷酰胺(国药准字 H32026196;规格:0.5 g)按 750 mg/m2剂量+多柔比星(国药准字 H33021981;规格:50 mg)按 50 mg/m2剂量经静脉滴注,同时D1 予以长春新碱(国药准字H20065857;规格:1 mg/支)按 1.4 mg/m2剂量经静脉推注,单次推注剂量不可超过 2 mg;第 1~5 天(D1~D5)每日予以泼尼松龙片(国药准字H31020605;规格:5 mg)口服治疗,60 mg/d,可分为多次服用,D0~D5 为1 个疗程,该组患者需持续治疗3 个月。
研究组:脾多肽注射液(国药准字H22026497;规格:2 mL)用药方法及剂量:取10 mL 本品与250 mL浓度为0.9%的生理盐水充分混匀后经静脉缓慢滴注,持续治疗10 d 为1 个疗程,化疗方案同对照组,该组患者需持续治疗3 个月。
1.3 观察指标
①两组患者实施治疗3 个月后采用影像学观察病灶改善情况, 均参照RECIST1.1 肿瘤疗效评估标准[6]对其近期疗效进行综合评估,主要包括客观缓解率(ORR)、疾病控制率(DCR)及中位总生存期(OS)3项指标,若治疗后肿瘤病灶消失、未出现新病灶且各项血清肿瘤标志物水平在正常控制范围内维持4周及以上时可判定为完全缓解(CR);若治疗后靶向病灶的最大直径之和减少了30%及以上、且可维持4周则判定为部分缓解(PR);最大直径之和减少20%~30%则判定为病情稳定(SD)。 ORR=(CR 例数+PR例数)/总例数×100.00%。 DCR=(CR 例数+PR 例数+SD 例数)/总例数×100.00%。 OS 具体指患者从随机化分组开始,至因任何原因引起死亡的时间。
②取患者静脉血5 mL 为样本, 经3 000 r/min速度离心处理, 取上层清液经放射免疫法检测免疫因子水平及血清相关指标, 免疫因子包括CD3+、CD4+、CD8+、CD4+/CD8+等 , 血 清 相 关 指 标 包 括VEGF、bFGF。
③统计两组患者的并发症发生情况, 该研究中患者治疗后的并发症主要包括血常规异常、 骨髓抑制、恶心腹泻、头晕头痛等4 种,总发生率=(血常规异常例数+骨髓抑制例数+恶心腹泻例数+头晕头痛例数)/总例数×100.00%。
1.4 统计方法
采用SPSS 26.0 统计学软件进行数据分析,符合正态分布的计量资料以()表示,采用t 检验;计数资料以[n(%)]表示,采用 χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者病灶改善情况对比
研究组治疗 3 个月后的 ORR、DCR 高于对照组、OS 低于对照组[(6.62±0.37)年 vs (5.14±0.25)年 ],差异有统计学意义(P<0.05),见表 1。
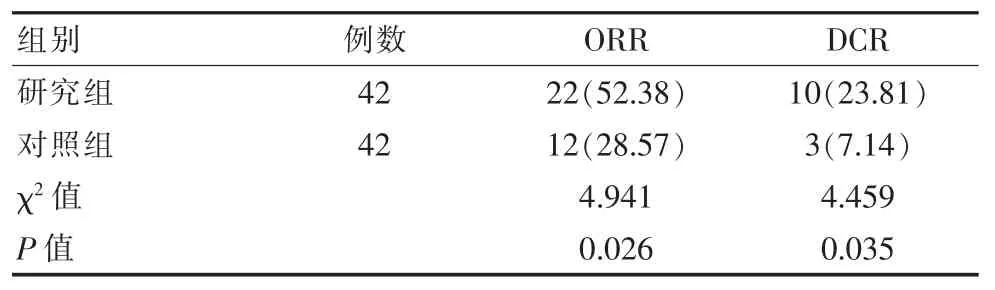
表1 两组患者病灶改善情况对比[n(%)]
2.2 两组患者免疫功能对比
两组患者治疗前的免疫因子水平比较, 差异无统计学意义 (P>0.05), 研究组治疗后 CD3+、CD4+、CD8+均低于对照组,CD4+/CD8+高于对照组,差异有统计学意义(P<0.05),见表 2。
表2 两组患者免疫因子对比()
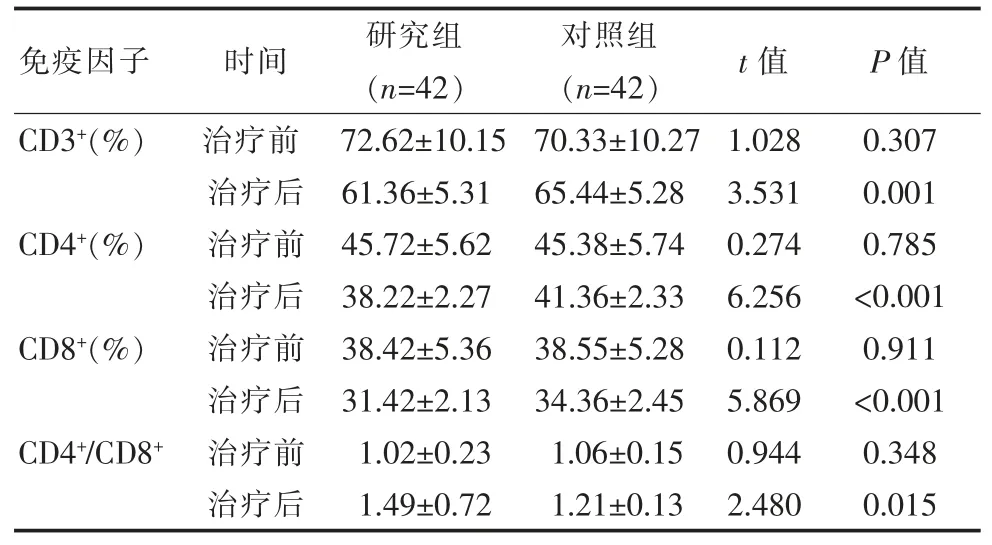
表2 两组患者免疫因子对比()
免疫因子 时间 研究组(n=42)对照组(n=42)t 值 P 值CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后72.62±10.15 61.36±5.31 45.72±5.62 38.22±2.27 38.42±5.36 31.42±2.13 1.02±0.23 1.49±0.72 70.33±10.27 65.44±5.28 45.38±5.74 41.36±2.33 38.55±5.28 34.36±2.45 1.06±0.15 1.21±0.13 1.028 3.531 0.274 6.256 0.112 5.869 0.944 2.480 0.307 0.001 0.785<0.001 0.911<0.001 0.348 0.015
2.3 两组患者血清相关指标对比
两组患者治疗前的血清相关指标对比, 差异无统计学意义(P>0.05);研究组治疗后 VEGF、bFGF 均低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者血清相关指标对比()
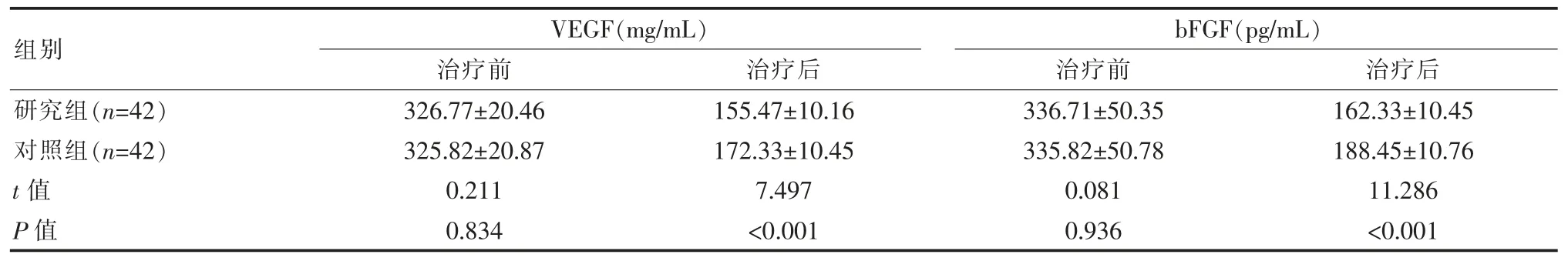
表3 两组患者血清相关指标对比()
组别研究组(n=42)对照组(n=42)t 值P 值VEGF(mg/mL)治疗前 治疗后326.77±20.46 325.82±20.87 0.211 0.834 155.47±10.16 172.33±10.45 7.497<0.001 bFGF(pg/mL)治疗前 治疗后336.71±50.35 335.82±50.78 0.081 0.936 162.33±10.45 188.45±10.76 11.286<0.001
2.4 两组患者并发症发生率对比
研究组治疗后的并发症发生率14.28%(6/42)低于对照组35.71%(15/42),差异有统计学意义(P<0.05),见表 4。
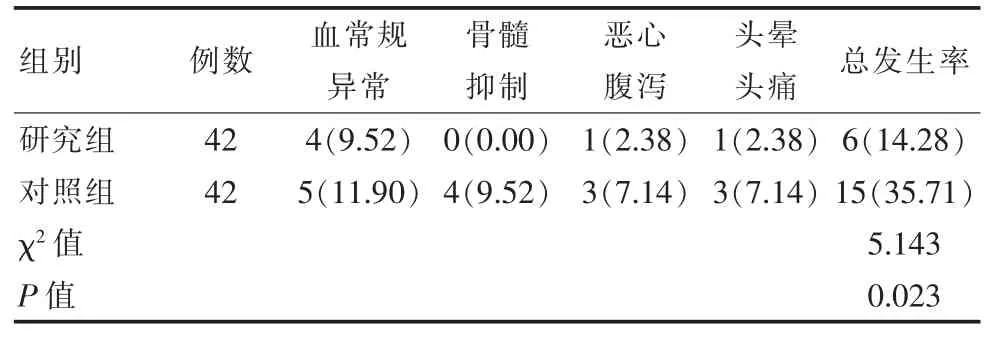
表4 两组患者并发症发生率对比[n(%)]
3 讨论
通常临床在对DLBCL 患者病情进行评估时会率先进行体格、肝功肾功、血常规等基础检查,其次会通过各类CT、MRI、PET-CT 影像学手段明确病灶的形态、大小及累及范围,在对其病情进行系统性评估后则会结合个人情况选择合理的治疗方案。 临床通常会在结合IPI 指数的情况下, 选择合理的化疗方案对患者进行治疗, 以IPI 在2 分及以上的中高危患者一线化疗方案为 R-chemo, 相较于传统CHOP 而言,R-CHOP 的疗效更佳,但在 R-CHOP 化疗基础实施强化治疗或可取得更加理想治疗效果[7]。在予以R-CHOP 化疗基础上加用抗肿瘤基因药物进行配合治疗,利妥昔单抗是一种针对DLBCL 等非霍奇金淋巴瘤患者的主要分子靶向药。 利妥昔单抗可通过与B 细胞上的CD20 免疫因子抗原进行特异性结合,进而促进B 细胞产生溶解机制,肿瘤细胞经溶解后可直接从细胞膜上脱落, 此时患者体内的CD20 抗体也不会产生内在化改变[8]。 现阶段有大量研究表明,R-CHOP 化疗方案治疗DLBCL 患者的效果显著, 但利妥昔单抗作为一种人鼠嵌合性单克隆抗体,对机体也可产生较多不良反应,若用药时间过长或药物过量也可能导致机体的B 细胞功能衰竭,对患者的整体疗效产生不同程度的负面影响[9]。
该研究结果显示:两组患者经R-CHOP 方化疗方案治疗后均取得一定疗效, 其肿瘤病灶均得到一定改善,但相比之下,研究组在脾多肽注射液的配合治疗下,ORR、DCR 高于对照组,OS 也高于对照组(P<0.05),分析原因为,脾多肽注射液主要成分提取于健康小牛脾脏,作为一种无菌水溶液,此药可通过抑制NK 细胞的杀伤活性及免疫细胞吞噬指数来实现提高机体免疫功能的效果。 葛鹏等[10]表示,脾多肽注射液具有抑制肿瘤转移相关蛋白的效果。此外,该药还可有效促进NK 细胞活性, 通过激活NK 细胞毒性来达到调节淋巴细胞及巨噬细胞功能的效果,可通过改善机体造血功能实现抗肿瘤效果[11]。研究组患者经此药配合R-CHOP 化疗方案治疗后的CD3+、CD4+、CD8+均低于对照组,CD4+/CD8+低于对照组,其免疫功能得到显著提升;目前临床认为VEGF 和bFGF是肿瘤细胞生长增殖的主要因素, 对二者水平进行有效抑制也可实现减少DLBCL 患者肿瘤细胞释放、改善患者病情转归的效果[12]。张艺婷等[13]表示,VEGF在DLBCL 患者血清中呈高水平表达; 李江等[14]表示,bFGF 在此类患者体内也呈显著增高。 该研究中研究组所用的脾多肽注射液可增强细胞表面的抗原表达,对肿瘤细胞的生长、繁殖均可起到一定抑制效果,在脾多肽注射液的作用机制下,患者的化疗用药量得到一定控制,因此该组患者治疗后的并发症发生率也低于对照组,该研究所得研究数据与秦国祥[15]研究结果基本一致, 该学通过对DLBCL 分别实施RCHOP 化疗单独治疗及联合脾多肽注射液治疗后结果显示,经联合治疗的观察组患者的VEGF 和bFGF水平优于对照组,CD3+、CD4+、CD8+均低于对照组,CD4+/CD8+高于对照组,且观察组患者的不良反应发生率也低于对照组。可见该治疗方案的有效性及安全性均较高。
综上所述,脾多肽注射液+R-CHOP 化疗方案治疗DLBCL 可有效控制患者病灶及病情发展,对提高患者免疫功能、抑制新生血管增长均有着积极作用,将此联合方案用于DLBCL 患者的临床治疗可在提升其生存质量同时降低发病并发症的风险, 建议可进一步推广应用。
