刺梨果粉缓解过度训练大鼠骨骼肌氧化应激损伤效果的研究
2022-06-11张帅军唐月梅张大鼎
张帅军,唐月梅,张大鼎,张 锦
(1.赣南师范大学科技学院,江西赣州 341000;2.平顶山市第一人民医院,河南平顶山 467000)
氧化应激 (oxidative stress,OS)是指体内氧化与抗氧化作用失衡的一种状态[1]。氧化应激作用下,组织细胞内的核酸、蛋白质和脂质等生物分子发生交联、灭活、从而引起膜损伤以及一些生理生化过程的紊乱[2-3]。刺梨[4](Rosa roxburghiiTratt) 系蔷薇科落叶灌木刺梨的果实,是一种天然的药食两用植物,在《本草纲目》和《中药大辞典》中均有收载,其果肉脆、酸甜,富含维生素C、维生素B、超氧化物歧化酶(superoxide dismutase,SOD)、多糖以及多种人体必需的氨基酸,果皮富含黄酮和酚类等物质。研究显示刺梨具有抗疲劳、抗氧化、抗肿瘤、免疫调节、促消化等功能,曹晶晶等[5]通过水煮刺梨提取刺梨多糖,发现刺梨多糖对负重游泳小鼠具有抗疲劳作用;于丽伟等[6]研究刺梨果汁对拘束负荷诱发小鼠肝损伤具有一定的保护作用;夏星等[7]研究刺梨提取物可增加机体糖原储备,显著增强小鼠的抗疲劳和耐缺氧能力;周禹佳等[8]研究刺梨果渣具有丰富的营养成分和保健价值。近些年来随着对刺梨研究开发的深入,其抗氧化应激的功能越来越突出。
运动训练是为了提高竞技能力和运动成绩,专门组织的有计划的体育活动,随着社会的发展,竞赛水平的提高,运动训练的强度越来越大,对运动员来说存在过度训练的风险,可引发机体功能紊乱或病理状态,严重影响运动成绩的发挥。为减少过度训练对骨骼肌造成的氧化应激损伤,较多研究者从不同的方向提出了缓解的措施和方法,在营养、药物干预方面,刺梨缓解过度训练引起骨骼肌氧化应激损伤方面的研究不多,因此本研究拟建立过度训练的大鼠模型,通过补充不同剂量的刺梨果粉,观察大鼠骨骼肌组织形态结构变化,检测骨骼肌细胞损伤标志物以及氧化应激指标水平,并结合组织内核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路相关因子基因、蛋白表达以及骨骼肌细胞凋亡蛋白表达水平,探究不同剂量的刺梨果粉对过度训练大鼠骨骼肌氧化应激损伤的保护作用,为刺梨作为药品或功能性运动饮料的进一步开发提供理论参考依据。
1 材料与方法
1.1 材料与仪器
SPF级雄性SD大鼠 购自江西中医药大学动物实验中心(动物生产合格证号:SCXK(赣)2018-0003)。体质量(236.78±1.21) g,7周龄,饲养于(22±2) ℃、相对湿度(60%±5%)的环境中,自由饮食,喂食国家标准啮齿类动物饲料,正常昼夜节律;刺梨果粉 陕西盛恒生物有限公司,由甄选于当年9~10月份贵州乌蒙山上圆形饱满、色泽金黄的成熟果实,晾干研磨而成;肌酸激酶(creatine kinase,CK)试剂盒 东软威特曼生物科技(南京)有限公司;血清白细胞介素-1β(inter leukin-1β,IL-1β)试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒
亚诺法生技股份有限公司;SOD、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)试剂盒 北京索莱宝科技有限公司;大鼠Nrf2检测试剂盒 北京百奥莱博科技有限公司;血红素氧合酶-1(heme oxygenase-1,HO-1)、Kelch样环氧氯丙烷相关蛋白1(kelch-like ECH-associated protein 1,Keap1)试剂盒 亚科因(武汉)生物技术有限公司;B细胞淋巴瘤因子-2(B cell lymphoma 2 protein,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)试剂盒 上海研生生化试剂有限公司。
JD-PT动物实验跑台 上海继德教学实验器械厂;LD-96A酶标仪、LD-PCR荧光定量PCR反应仪山东莱恩德智能科技有限公司;UC0102核酸扩增仪 杭州优思达生物技术有限公司;YKY-1100荧光显微镜 基恩士(中国)有限公司;WD-9413B凝胶成像分析系统、DYCZ-40K转印电泳仪 北京六一生物科技有限公司。
1.2 实验方法
1.2.1 灌胃溶液的配制 低浓度刺梨果粉溶液:参照何诚[9]《动物实验学》中的方法,称取1 g刺梨果粉溶于50 mL去离子水中,配制质量浓度为20 mg/mL的刺梨果粉溶液;高浓度刺梨果粉溶液:称取1 g刺梨果粉溶于20 mL去离子水中,配制质量浓度为50 mg/mL的刺梨果粉溶液。
1.2.2 动物分组与模型的建立 45只SD大鼠,以10 m/min、10 min/d、坡度10°的跑台运动方式进行筛选,剔除运动能力较差的5只,剩余40只按随机原则,分为安静对照组(C组,10只),运动组(HT组,10只)、低浓度刺梨果粉+运动组(L-HT组,10只)、高浓度刺梨果粉+运动组(H-HT组,10只)。参照《动物实验学》中动物灌胃给药量的标准,L-HT、H-HT组分别以20、50 mg/mL质量浓度的刺梨果粉溶液每天20 mL/kg的剂量灌胃,C组和HT组采用相同剂量的生理盐水灌胃,每天灌胃一次。C组不进行运动干预,HT组、L-HT组、H-HT组采用改良后的递增负荷跑台运动方案[10-11],运动干预6周,每周5 d,每次从10 m/min开始,每5 min速度增加5 m/min,直至目标速度,如果无法维持目标速度,则运动至力竭。方案见表1。
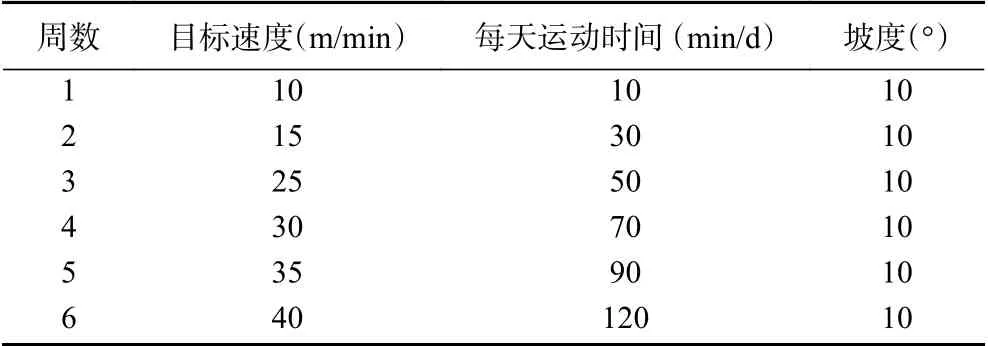
表1 大鼠跑台运动方案Table 1 Treadmill exercise program in rats
1.2.3 血液标本采集和骨骼肌组织的提取 6周末次运动后,次日上午10:00用10%的巴比妥腹腔注射麻醉,尾静脉取血3 mL,置于抗凝管内,4 ℃、3000 r/min,离心10 min,分离血清,分装置于-20 ℃冰箱保存待测。
断头处死各组大鼠,立即取腓肠肌,置于冰浴中,剔除脂肪及周围的结缔组织,用预冷的生理盐水冲洗血渍,待滤纸吸干后标记分装,一份置于4%的多聚甲醛溶液中,另一份用电子天平称重1 g,按照1:4的比例用眼科剪剪碎置于玻璃匀浆管,加入4 mL介质PBS,电动匀浆器匀浆,4 ℃、6000 r/min、10 min,取上清液分装,置于-80 ℃冰箱保存。
1.3 指标测试
1.3.1 血清中骨骼肌损伤标志物的检测 取待测血清,采用N-乙酰半胱氨酸法测定CK活性,ELISA法检测炎症因子IL-1β、TNF-α的水平,检测严格按照试剂盒说明进行。
1.3.2 骨骼肌组织形态微结构变化的检测 将腓肠肌从多聚甲醛中取出放入包埋盒中,流水冲洗30 min、置于不同浓度的酒精中脱水后、再置于透明剂二甲苯中渗透、然后石蜡包埋、切片、展片、烤片、脱蜡、HE染色、光学显微镜下观察骨骼肌组织结构变化。
1.3.3 骨骼肌组织中氧化应激指标的检测 取待测组织液,参照柳爱莲等[12]《精编运动人体科学实验指南》中的微量酶标法测定GSH的浓度,硫代巴比妥酸法测定MDA含量,黄嘌呤氧化酶法测定SOD的活性,检测严格按照试剂盒说明进行。
1.3.4 骨骼肌组织Nrf2信号通路中相关蛋白mRNA表达的检测 RT-PCR检测:取待测组织液,在RIPA裂解液中加入蛋白酶抑制剂,摇匀置于冰水浴中沉淀,用Trizol法提取总RNA,每个样本以2 μg RNA作为初始模板,配置20 μL的总反应体系,应用反转录试剂盒在逆转录酶的作用下反转录成cDNA。参照李丹等[13]设计的基因引物序列(表2)进行设计后,依照试剂盒说明配制20 μL的反应体系,每组样本检测3个复孔,利用两步法进行实时荧光PCR反应,反应条件为预变性95 ℃、30 s,PCR反应95 ℃、5 s,60 ℃、30 s,共40个循环,最后根据各反应孔的Ct值,采用2-ΔΔCT算法计算出样本中mRNA的相对表达量。

表2 Real-time PCR基因引物序列Table 2 Gene primer sequences of Real-time PCR
1.3.5 骨骼肌组织中Nrf2信号通路和细胞凋亡相关蛋白表达的检测 Western Blot检测:取待测组织液,在RIPA裂解液中加入蛋白酶抑制剂,摇匀置于冰水浴中沉淀,用BCA法测定各组待测液蛋白浓度,并稀释至相同蛋白浓度,蛋白定量后加入上述混合液,100 ℃煮沸5 min,按照4:1的体积比例加入十二烷基硫酸钠-聚丙烯酰胺凝胶电泳蛋白上清液5X,分离样品并转膜,用TBST洗涤3次后,用牛清蛋白封闭2 h,再用TBST洗涤3次,加入二抗后在室温下孵育,用TBST洗脱二抗,用增强型化学发光试剂在WD-9413型凝胶成像系统显影。以β-actin为内参,计算目的蛋白Nrf2、Keap1、HO-1、Bcl-2、Bax条带的积分光密度,换算蛋白质相对表达量。
1.4 数据处理
2 结果与分析
2.1 刺梨果粉对过度训练大鼠血清骨骼肌损伤标志物的影响
为明确是否成功建立过度训练大鼠模型,本研究以6周递负荷的跑台运动进行训练,通过对血清CK活性和炎症因子IL-1β、TNF-α水平的变化进行分析[14],结果显示(表3),与C组相比,HT组血清CK活性、IL-1β和TNF-α的水平显著升高(P<0.01)。与HT组相比,L-HT组血清CK活性下降、IL-1β和TNF-α的水平降低(P<0.05);H-HT组血清CK活性下降、IL-1β和TNF-α的水平显著降低(P<0.01)。与L-HT组相比,H-HT组CK活性下降、IL-1β和TNF-α的水平降低(P<0.05)。上述结果表明,过度训练大鼠模型建模成功,且不同浓度的刺梨果粉可以有效缓解过度训练引起的骨骼肌氧化应激损伤。
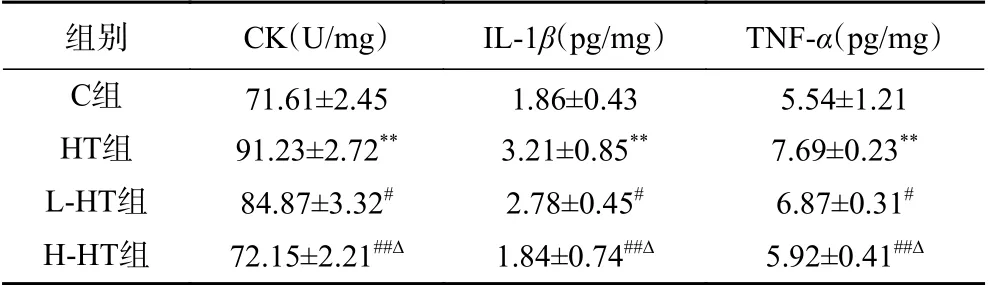
表3 各组大鼠血清中骨骼肌损伤标志物水平(n=10)Table 3 Serum markers of skeletal muscle injury of rats in each group (n=10)
2.2 刺梨果粉对过度训练大鼠骨骼肌组织结构形态变化的影响
光镜下观察(图1),C组骨骼肌组织结构完整,肌纤维排列规则,未出现变性、水肿及空泡状等现象,细胞核均匀的分布于周边,核仁明显,无浸润炎症现象;HT组肌组织形态较C组发生异常显著性改变,肌纤维出现空泡,间隙扩大,排列不规则,连接处出现组织严重炎症浸润,核仁排列杂乱;L-HT组肌组织形态学变化较HT组有所改善,损伤炎症程度减轻,但仍见有水肿、炎症局部空泡现象;H-HT组肌组织形态学较HT组有较好改变,水肿、炎症几乎没有,只是局部偶见细胞空泡,肌纤维排列规则、核仁明显。光镜下各组大鼠骨骼肌组织病理形态学变化。
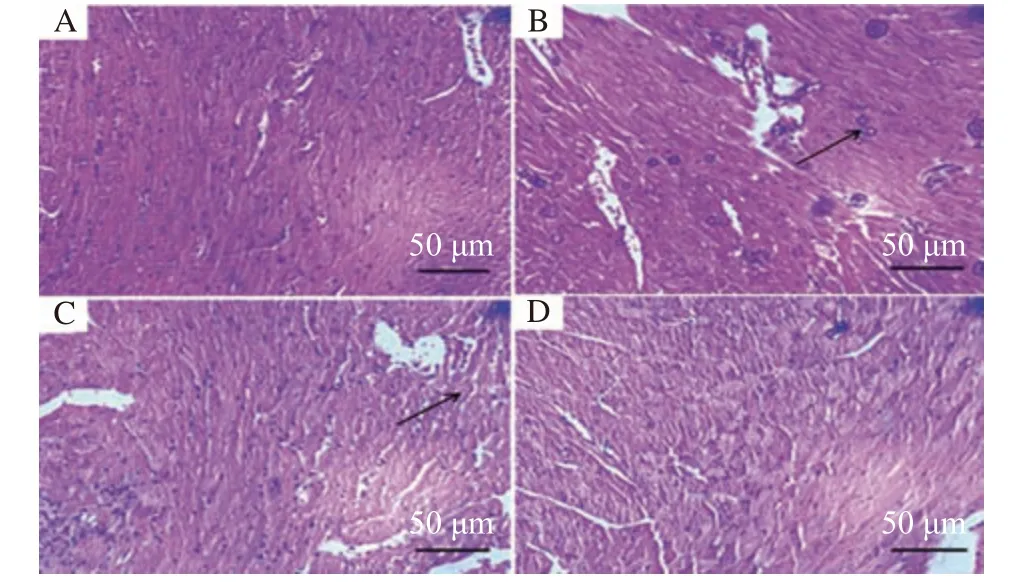
图 1 各组大鼠骨骼肌组织病理形态学变化HE染色Fig.1 HE staining of histopathological changes of rat skeletal muscle in each group
2.3 刺梨果粉对过度训练大鼠骨骼肌组织中氧化应激指标的影响
机体内各种抗氧化酶和小分子抗氧化剂构成了机体重要的防御体系,以对抗氧化应激,保持内环境稳定[15]。各组大鼠肌组织中的GSH、SOD和MDA结果(表4)显示,与C组相比,HT组中GSH浓度降低、SOD活性下降以及MDA含量增多,有异常显著性统计学差异(P<0.01)。与HT组相比,L-HT组肌组织中GSH浓度上升、SOD活性增强以及MDA含量降低,有显著性统计学差异(P<0.05);H-HT组肌组织中GSH浓度上升、SOD活性增强以及MDA含量降低,有异常显著性统计学差异(P<0.01)。与L-HT组相比,H-HT组SOD活性升高,MDA含量降低,有显著性统计学差异(P<0.05)。

表4 各组大鼠骨骼肌组织中氧化应激指标 (n=10)Table 4 Oxidative stress indicators of skeletal muscle of rats in each group (n=10)
2.4 刺梨果粉对过度训练大鼠骨骼肌组织中Nrf2信号通路相关蛋白mRNA表达的影响
mRNA是含有与DNA分子中某些功能片段相对应的碱基序列的一类单链核糖核酸,作为蛋白质生物合成的直接模板,指导蛋白质的合成。各组大鼠肌组织中的Nrf2、Keap1和HO-1的mRNA 表达结果(表5)显示,与C组相比,HT组Nrf2、HO-1的mRNA相对表达水平明显降低(P<0.01)。与HT组相比,L-HT组Nrf2、HO-1的mRNA相对表达水平升高(P<0.05);H-HT组Nrf2、HO-1的mRNA相对表达水平明显升高(P<0.01)。与L-HT组相比,H-HT组Nrf2、HO-1的mRNA相对表达水平升高(P<0.05)。Keap1 mRNA的相对表达量在各组间没有变化。
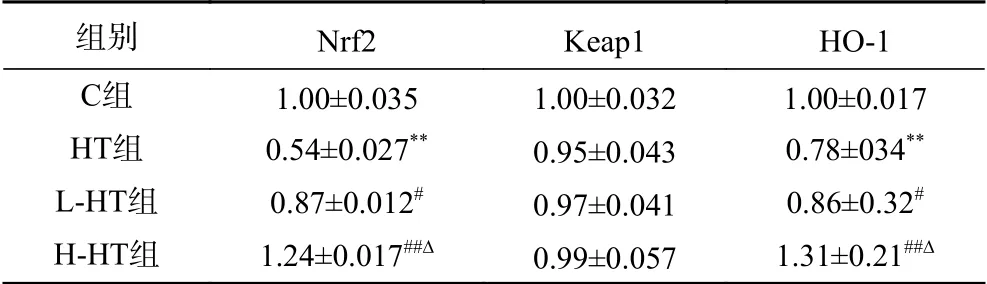
表5 各组大鼠骨骼肌组织中Nrf2信号通路相关蛋白的mRNA相对表达量 (n=10)Table 5 Relative mRNA expression levels of Nrf2 signaling pathway related proteins in skeletal muscle tissue of rats in each group (n=10)
2.5 刺梨果粉对过度训练大鼠骨骼肌组织中Nrf2信号通路相关蛋白表达的影响
Nrf2信号通路是生物体内最为重要的内源性抗氧化应激通路[16],通过Nrf2、Keap1的结合态,调控HO-1的抗氧化作用。各组大鼠肌组织中的Nrf2、Keap1和HO-1蛋白表达结果(图2)显示,与C组相比,HT组Nrf2表达水平显著降低(P<0.01);HO-1表达水平下降(P<0.05)。与HT组相比,L-HT组Nrf2、HO-1表达水平升高(P<0.05);H-HT组Nrf2、HO-1表达水平明显升高(P<0.01)。与L-HT组相比,H-HT组Nrf2、HO-1表达水平升高(P<0.05)。Keap1蛋白的表达在各组间没有变化。
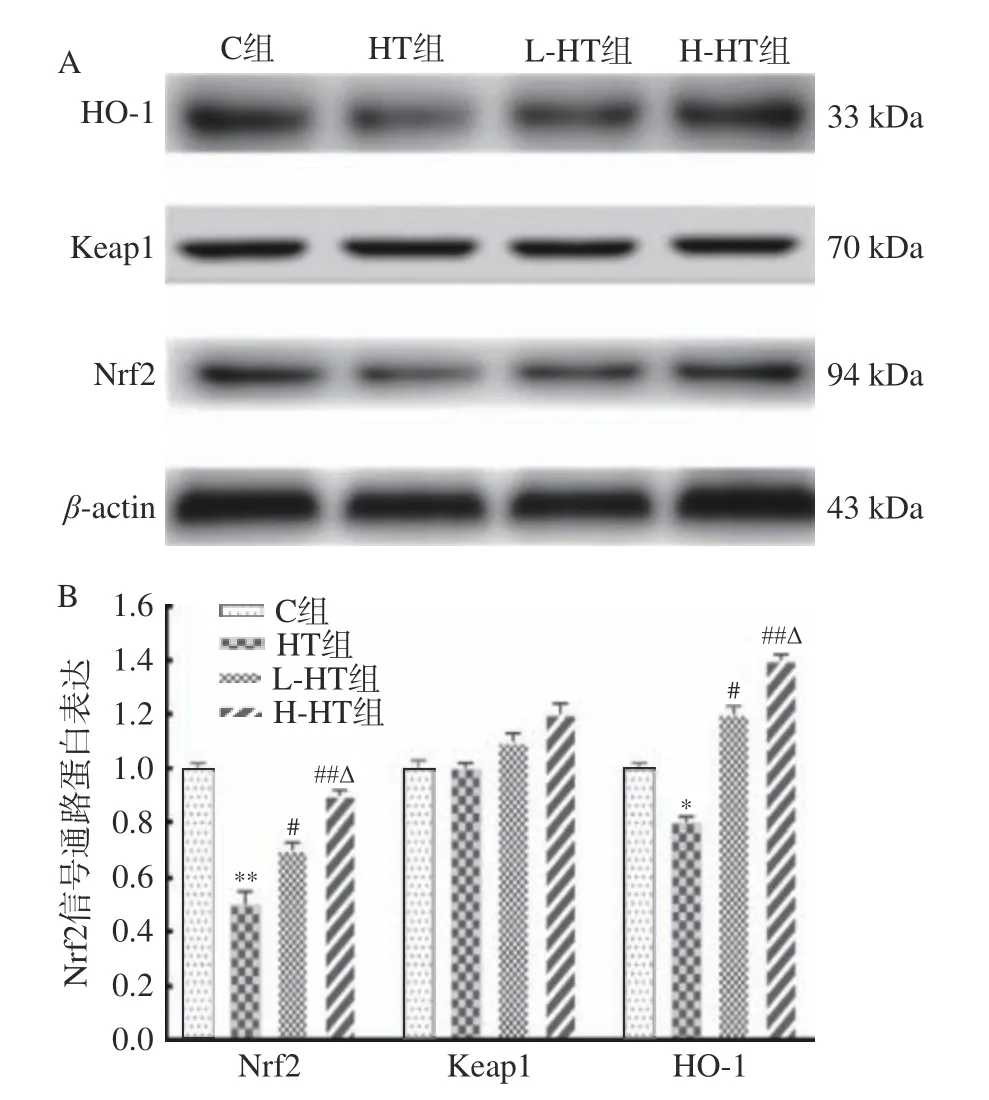
图 2 各组大鼠骨骼肌组织中Nrf2信号通路相关蛋白表达Fig.2 Expression of Nrf2 signaling pathway related proteins in skeletal muscle tissue of rats in each group
2.6 刺梨果粉对过度训练大鼠骨骼肌组织中细胞凋亡相关蛋白表达的影响
细胞凋亡是多因素、多阶段和多基因严格控制的过程,通过级联反应降解底物,出现凋亡特征性的形态和生化改变。Bcl-2家族蛋白被视为调节细胞凋亡的开关,抗凋亡蛋白Bcl-2和促凋亡蛋白Bax之间的相互作用,决定了细胞死亡的阈值[17]。各组大鼠肌组织中的Bcl-2、Bax蛋白表达结果(图3)显示:与C组相比,HT组Bcl-2表达水平下降、Bax表达升高、Bcl-2/Bax值下降,有异常显著性统计学差异(P<0.01)。与HT组相比,L-HT组Bcl-2表达水平升高、Bax表达下降、Bcl-2/Bax值增加,有统计学差异(P<0.05);H-HT组Bcl-2表达水平升高、Bax表达降低、Bcl-2/Bax值升高,有异常显著性统计学差异(P<0.01)。与L-HT组相比,H-HT组Bcl-2表达水平升高,有显著性统计学差异(P<0.05),Bcl-2/Bax值升高,有显著性统计学差异(P<0.05)。
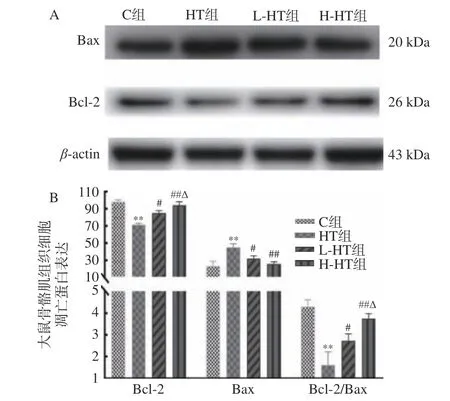
图 3 各组大鼠骨骼肌组织中细胞凋亡相关蛋白表达Fig.3 Expression of apoptosis-related proteins in skeletal muscle tissue of rats in each group
3 讨论
3.1 过度训练引起大鼠骨骼肌组织结构氧化应激损伤的分析
骨骼肌是机体运动系统的有机组成部分,一般情况下运动训练引起的机体氧化应激变化在肌肉中表现得最为明显,这种现象反应了自由基产生的组织差异以及不同组织抗氧化能力的不同。CK[18]是肌肉收缩时能量供应以及运动后磷酸肌酸再合成过程中关键的一种酶,生理状态下只有少量的CK逸出。IL-1β[19]又称淋巴细胞活化因子,是炎症反应的重要个体,TNF-α是一种促炎症细胞因子。血清CK和炎症因子IL-1β、TNF-α等是间接反应骨骼肌氧化应激的一些敏感性指标,且与损伤程度呈正相关[14]。本研究中,6周递增负荷跑台运动后,HT组血清中CK、IL-1β和TNF-α的水平与C组相比明显升高,同时结合光镜下肌组织病理性形态学的变化,说明长期大强度运动能够诱发大鼠骨骼肌出现氧化应激损伤,这与已有的长期大强度运动,容易导致局部产热过多,引起肌肉收缩装置改变[20]、细胞膜和内部微结构破坏[21],出现肌肉微损伤;以及长时程、大强度运动可诱导大鼠血清CK[22]水平升高,机体炎性因子IL-1β[23]水平增加和TNF-α[24]水平升高等研究具有一致性。即再次证实了长期大强度运动能够产生氧化应激损伤,同时也说明了实验的设计是科学合理的。其原因可能与长期运动中肌纤维的过度牵拉以及大强度运动导致机体出现的局部高温等有关,引起机体出现过氧化应激反应,造成骨骼肌内部收缩装置和细胞膜的微损伤,使CK大量透过细胞膜逸出到体液中,刺激机体出现炎症反应,产生大量的炎性因子IL-1β和TNF-α。
SOD是生物体内最重要的抗氧化酶,研究证实SOD活性越高,机体抗氧化能力就越强[25]。GSH是体内重要的抗氧化剂之一,在清除自由基及衍生物的毒性中起主要作用。MDA是脂质过氧化的产物。正常情况下机体不断产生活性氧,但不会对机体造成严重损害,主要由机体内部的抗氧化防御系统发挥作用。长期大强度运动时,组织代谢率增加,耗氧量增多,产生大量的活性氧,导致自由基代谢失衡,引起一系列运动氧化应激损伤。本研究中,6周递增负荷跑台运动后,HT组匀浆中SOD、GSH水平明显低于对照组,MDA含量明显高于对照组,说明HT组骨骼肌内生成了大量的自由基,与骨骼肌细胞膜发生了大量的脂质过氧化反应,这与牛衍龙等[26]、周海涛等[27]、李影等[28]研究过度训练引起大鼠骨骼肌氧化应激加强,引起机体出现强烈地抗氧化反应,导致SOD、GSH水平下降等研究具有一致性。其原因可能与过度训练通过黄嘌呤氧化酶[27]、通过诱发线粒体呼吸链电子漏形成[29]等引起大量超氧阴离子和羟自由基的产生有关,即过度训练中,机体需要大量的能量,能源物质在能量的转换和转移过程中,特别是在线粒体生物氧化过程NADHH+和FADH2中的氢,经氧化呼吸链将电子传递给氧生成水驱动ADP磷酸化合成ATP的过程中,生成大量的电子漏,漏出的电子可直接与氧作用,产生部分被还原的氧,即大量的超氧阴离子、过氧化氢、羟自由基等活性氧成分,引起机体抗氧化酶/剂的大量消耗。同时电子漏也可引起质子漏[30]的产生,质子漏的增多是氧化磷酸化偶联程度下降的重要因素,即在一定程度上又促进了活性氧的形成。
3.2 过度训练对大鼠骨骼肌Nrf2信号通路相关蛋白和细胞凋亡蛋白表达影响的分析
Nrf2信号通路是机体最为重要的内源性抗氧化应激通路,Nrf2是Nrf2信号通路上最重要的调节因子。正常情况下与其负调节因子Keap1结合,处于无活性状态,当氧化应激增强时,活性氧异化Keap1结构域,引起Keap1变构,使其与Nrf2解离,游离的Nrf2通过与抗氧化反应元件相互作用,激活下游的抗氧化酶系统发挥作用。Bcl-2家族蛋白被视为调节细胞凋亡的开关,Bcl-2和Bax之间的平衡,决定了细胞死亡的阈值。Nrf2可通过与Bcl-2基因启动子反向链上核苷酸-3 148-140之间的抗氧化反应元件结合[31],上调Bcl-2和下调Bax的表达,减少细胞凋亡。本研究中,6周递增负荷跑台运动后,HT组肌组织中Nrf2转录活性降低、HO-1表达水平下降,抗凋亡蛋白Bcl-2水平明显下降,促凋亡蛋白Bax水平明显升高,说明长期大强度运动可引起Nrf2信号通路相关蛋白Nrf2、HO-1和凋亡蛋白Bcl-2、Bax表达的变化,即降低Nrf2信号通路的抗氧化应激能力和增加骨骼肌细胞的凋亡水平,这与已有的长期大强度运动后大鼠骨骼肌Nrf2表达下降,Keap1表达不明显[32];长期大强度运动诱导大鼠肾脏细胞HO-1表达减少,Bax表达明显增强,Bcl-2表达明显减少[33];长期大强度运动诱导大鼠心肌细胞HO-1表达下降[34]等研究具有一致性。其原因可能长期的大强度运动刺激,引起机体氧化应激增强,产生大量的活性氧,触发Nrf2信号通路活动加强,长期Nrf2信号通路活动的亢奋,引起Nrf2信号通路的超限抑制,使Nrf2、HO-1表达的下降,降低机体的抗氧化应激能力,同时机体抗氧化应激水平的下降,可导致骨骼肌细胞凋亡加快,表现为Bax表达升高,Bcl-2水平下降。
3.3 刺梨果粉缓解过度训练大鼠骨骼肌氧化应激损伤的分析
刺梨果是一种天然的抗氧化剂,具有调节机体免疫功能、延缓衰老、抗动脉粥样硬化和抗肿瘤等功能[35]。有研究证实刺梨在抗氧化应激方面具有较好的作用。本研究中不同浓度的刺梨果粉在6周递增负荷跑台运动大鼠身上呈现出不同的抗氧化能力,在骨骼肌组织微结构病理损伤方面,L-HT组、H-HT组骨骼肌组织微结构仅出现较少的炎症反应,且HHT组的炎症反应更不明显,说明刺梨果粉在预防过度训练导致的骨骼肌氧化应激损伤和炎症产生方面具有一定的防护作用;在抗氧化应激方面,L-HT组、H-HT组匀浆中SOD活性、GSH浓度表达水平升高,MDA含量下降,且H-HT组效果好于L-HT组,说明补充刺梨果粉可以显著提升机体对抗活性氧的能力,减少脂质过氧化,且抗氧化应激能力与刺梨果粉剂量之间存在量效关系,这与张晓玲等[36]对大强度运动大鼠连续补充刺梨,可有效保护胰脏免受四氧嘧啶氧化损伤,预防糖尿病皮肤损伤的发生发展;陈庆等[37]给予大强度运动小鼠刺梨提取物补剂,能显著增强小鼠抗过氧化、抗疲劳和抗肿瘤能力;以及杨江涛等[38]刺梨多糖可剂量依赖性地提高衰老小鼠体内抗氧化能力等研究具有一致性。其原因可能与刺梨富含VC、VE、类胡萝卜素、SOD和刺梨多糖等营养素有关,机体在长时间大强度应激下,代谢率升高、耗氧量急剧增加,氧供明显不足,容易引起机体出现超氧化应激反应,为减少运动氧化应激损伤,大量的外源性抗氧化剂被利用,与自身抗氧化系统形成了级联协作机制,共同发挥抗氧化作用,淬灭ROS或自由基,减少脂质过氧化反应,减轻损伤,起到防护作用。
3.4 刺梨果粉对过度训练大鼠骨骼肌Nrf2信号通路相关蛋白和细胞凋亡蛋白表达的影响分析
刺梨在机体Nrf2信号通路和骨骼肌细胞凋亡方面的研究较少,本研究显示,补充不同浓度的刺梨果粉对6周递增负荷跑台运动大鼠Nrf2信号通路相关蛋白和骨骼肌细胞凋亡蛋白的影响不同,LHT组、H-HT组Nrf2、HO-1和Bcl-2表达水平升高以及Bcl-2/Bax比值增加,Bax表达水平下降,且HHT组中的Nrf2、HO-1和Bcl-2表达水平以及Bcl-2/Bax比值升高的更明显,说明了6周的刺梨果粉补充可上调Nrf2信号通路相关蛋白Nrf2、HO-1蛋白的表达,减少应激状态下的细胞凋亡水平,提升机体的抗氧化能力,同时剂量与效果之间存在量效关系。其原因可能与刺梨果中的有机成分(黄酮、多酚)有关,有研究显示刺梨黄酮[39]可下调心肌细胞Bax水平的表达,减少心肌细胞凋亡;黄酮可上调梗阻性肾病大鼠肾脏Nrf2与HO-1蛋白表达水平,减轻肾脏氧化应激损伤[40];多酚可上调糖尿病肾病小鼠肾组织中Nrf2、HO-1蛋白表达水平,减少肾脏的氧化应激[41]。本实验中刺梨在基于Nrf2信号通路发生抗氧化作用,减少骨骼肌细胞凋亡,缓解氧化应激损伤中存在级联效应,即过度训练的超氧化应激,导致体内活性氧增多、积累,活性氧可直接与Keap1结构域(IVR、BTB、DGR)中的IVR结合,催化IVR结构域中的半胱氨酸[32];其次刺梨中的酚类成分——酚羟基[41]也可以直接修饰IVR结构域中的半胱氨酸残基,共同促使IVR与BTB和Keap1形成的二聚体发生联动,引起DGR变构,导致Nrf2与Keap1亲和力下降、分离,Nrf2进入核内,对目标基因转录活性激活,诱导HO-1表达增加,发挥抗氧化应激作用。同时Nrf2还通过与Bcl-2基因启动子反向链上的核苷酸-3的抗氧化反应元件结合[31],上调Bcl-2和下调Bax的表达,减少细胞凋亡,预防和缓解氧化应激的发生发展。
4 结论
本实验证实了过度训练可引起大鼠骨骼肌产生过氧化反应,加剧细胞凋亡,引起骨骼肌损伤。6周不同浓度的刺梨果粉补充可提升过度训练大鼠SOD活性和GSH的浓度水平,以及上调Nrf2、HO-1和Bcl-2蛋白的表达,提升抗氧化能力,减少细胞凋亡,缓解骨骼肌运动氧化应激损伤,且抗氧化应激能力与刺梨果粉补充剂量之间存在正相关,这可能与刺梨介导Nrf2信号通路发挥抗氧化反应的级联机制有关,后期可进一步探讨刺梨介导的Nrf2信号通路途径,以期为刺梨作为药品和功能性食品的进一步开发提供理论参考依据。
