QuEChERS前处理结合超高效液相色谱-串联质谱法同时检测茶叶中14种农药残留
2022-06-11朱颖洁曹燕卿董方霆
朱颖洁,曹燕卿,毛 劼,张 康,董方霆,何 昆,王 娜
(国家生物医学分析中心,北京 100850)
我国是茶叶的发源地,也是茶叶生产和消费量最大的国家。由于茶树生长喜温暖潮湿环境、种植单一化、缺乏生物多样性的特点,较易发生病虫害,其规模化种植过程中离不开农药的使用,农药残留问题难以避免[1-2]。国家允许在茶叶上使用一些高效低毒的农药,在GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》中规定了106项茶叶农药残留限量标准[3]。然而,由于部分商家追求利益盲目施加农药和化肥催生、茶农使用农药不科学等原因,食品安全监督检查中茶叶农残超标的情况时有发生,甚至屡有禁用高毒农药的检出,严重危害消费者安全与市场信心[4-5]。
近年来,农药残留分析方法向着快速、简单、灵敏、低成本、易普及的方向发展。液相色谱-串联质谱法和气相色谱-串联质谱法是最常用的农药多残留检测分析手段,具有高灵敏度、高通量、定量准确等优点[6-9]。由于茶叶样品基质复杂,含有大量的茶多酚、生物碱、色素和有机酸等物质,检测过程中会产生较强的基质效应,必须通过前处理净化以减弱对目标农药检测的影响[10-11]。茶叶农药残留检测中传统的样品前处理技术如固相萃取[12-13]、液液萃取[14]、基质固相分散萃取[15]等常需要多次净化步骤,操作较为繁琐和耗时。2003年美国农业部Anastasiadis等发布的QuEChERS法[16],是液液萃取法与基质分散固相萃取法相结合形成的一种前处理方法,通常使用乙腈或含1%乙酸的乙腈提取,加入无水硫酸镁(MgSO4)、氯化钠(NaCl)除水,配合使用N-丙基乙二胺(PSA)、石墨化炭黑(GCB)和十八烷基硅烷(C18)等进一步净化,对不同种类的农药均有较好的回收率,具有操作简单、快速高效、成本低廉的优点[17],在果蔬[18-20]、食用菌[21]、中药材[22]等植物源食品的多农残检测中得到了广泛的应用。本研究的主要目的是开发一种基于QuEChERS前处理技术结合UPLC-MS/MS,同时检测茶叶中14种常见农药残留的高灵敏、快速检测方法,考察提取液组分、QuEChERS净化柱等对回收率的影响,确定了最优条件,并将方法应用于30种市售茶叶样品检测,以期为高效和准确地评价茶叶的质量安全提供参考。
1 材料与方法
1.1 材料与仪器
14种农药标准品(啶虫脒、涕灭威、克百威、内吸磷、灭线磷、吡虫啉、茚虫威、甲胺磷、灭多威、氧化乐果、甲基对硫磷、硫环磷、丙溴磷、噻虫嗪)(100 mg/L) 天津阿尔塔科技有限公司,于-20 ℃冰箱保存;30种茶叶包括不同种类绿茶(狮峰龙井、竹叶青、采花毛尖、西湖龙井、太平猴魁茶、桐城小花、绿杨春、清明茶高山绿)、红茶(武夷山红茶、祁门红茶、生态野生红茶、古树红茶、金骏眉)、白茶(牡丹王白茶、政和白茶、安吉白茶)、乌龙茶(铁观音、大红袍、老枞水仙、马头岩肉桂)、花茶(茉莉花茶、菊花茶、蒲公英玫瑰茶、玫瑰花茶)、普洱茶、青稞茶、刺五加茶等 购于当地超市和茶叶专卖店,西湖龙井和古树红茶按照《GB 23200.121-2021》所示LC-MS/MS方法检测未检出本研究涉及的14种农药,分别作为空白绿茶和红茶基质进行相关研究;QuEChERS盐包(含有6 g MgSO4,1.5 g乙酸钠) 北京绿绵科技有限公司;尼龙微孔滤膜(型号SHIMEN DISC,孔径0.22 μm) 日本SHIMADZU公司;乙腈、甲醇、甲酸 色谱纯,美国Fisher公司;甲酸铵、乙酸 分析纯,德国Merk公司;4种QuEChERS净化柱及其使用方法如表1所示。
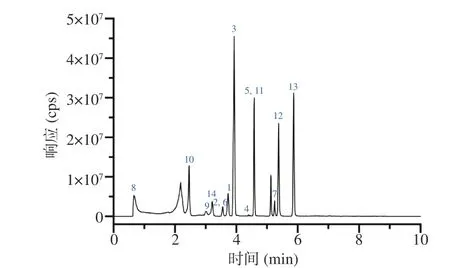
图 1 14种农药的总离子流图Fig.1 Total ion chromatogram (TIC) of 14 pesticides
Q-Trap 6500质谱仪 美国AB Sciex公司;LC-30AD液相色谱仪 日本SHIMADZU公司;Centrifuge 5810R低温高速离心机 德国Eppendorf公司;QL-901涡旋仪 美国KYLIN-BELL LAB公司;破壁粉碎机 中国天喜公司。
1.2 实验方法
1.2.1 样品前处理 提取:称取1 g粉碎好的茶叶样品于50 mL离心管中,加入10 mL超纯水,涡旋振荡5 min,加入10 mL 1%乙酸-乙腈溶液,涡旋振荡30 s,加入QuEChERS盐包,涡旋振荡5 min,以9000 r/min离心5 min,得上清提取液。
净化:经过上述得到的上清液分别使用4种QuEChERS净化柱进行下一步净化处理,具体方法见表1。
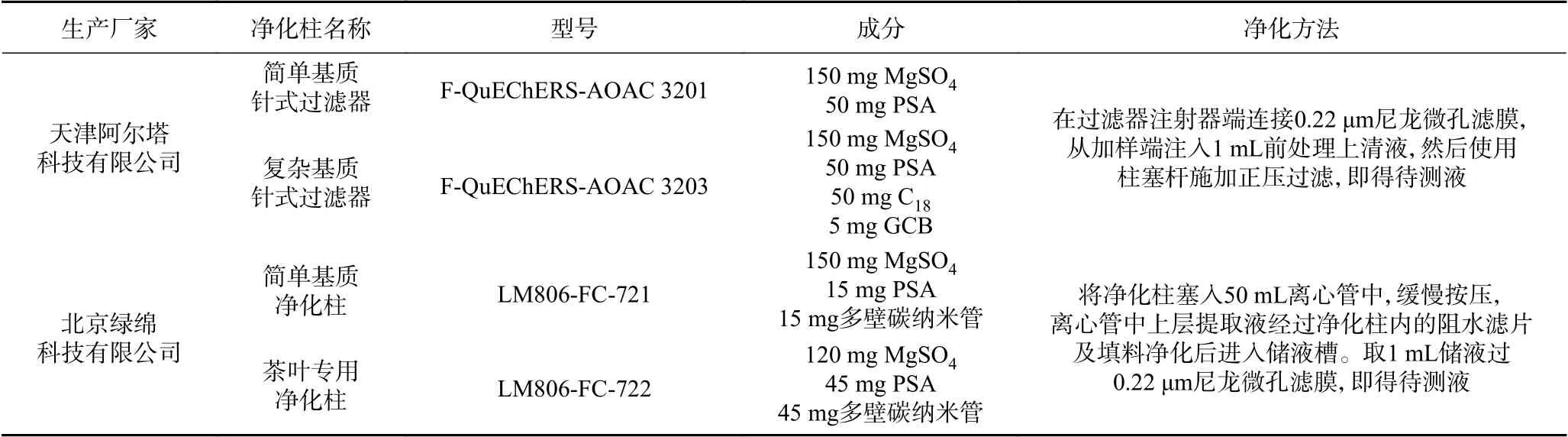
表1 4种QuEChERS净化柱型号、成分及使用方法Table 1 Model, component and usage of four kinds of QuEChERS purification columns
1.2.2 溶液配制 混合标准溶液:取14种农药标准品溶液(100 mg/L)各100 μL于10 mL容量瓶,加入乙腈定容,得到浓度为1 mg/L的混合标准溶液,于-20 ℃冰箱保存。
空白基质溶液:称取1 g(精确至0.001 g)空白绿茶/红茶样品,按照1.2.1节进行提取和净化,得到相应的空白绿茶/红茶基质溶液,将该溶液置于-20 ℃冰箱中保存,备用。
基质混合标准溶液1:用空白基质溶液将混合标准溶液稀释得到0.001、0.005、0.01、0.02、0.05、0.1、0.5、1、2、5、10 μg/L等系列质量浓度的基质混合标准工作溶液,用于确定方法检出限和定量限。
基质混合标准溶液2:用空白基质溶液将混合标准溶液逐级稀释得到质量浓度为1、5、10、20、50、100 μg/L的系列基质混合标准工作溶液,用于做标准工作曲线,即基质匹配校准曲线。
1.2.3 色谱条件 色谱柱:SHIMAZU Shim-pack Velox Biphenyl C18色谱柱(3 mm×50 mm,2.7 μm)。分别考察乙腈-水、甲醇-水、0.1%甲酸水溶液-甲醇、0.1%甲酸水溶液-甲醇(含2 mmol/L甲酸铵)、0.1%甲酸水溶液-甲醇(含5 mmol/L甲酸铵)四种流动相对14种农药检测结果的影响。流动相洗脱程序:0~0.01 min,5% B;0.01~1.0 min,5%~40% B;1.0~3.0 min,40%~85% B;3.0~4.5 min,85%~95% B;4.5~8.0 min,95% B;8.01~10 min,95%~5% B。进样体积设置为5 μL;流速设置为0.3 mL/min;色谱柱柱温35 ℃。
1.2.4 质谱条件 离子源:ESI离子源;将14种农药混合标准溶液通过针泵进样方式进行质谱方法调谐,在ESI+和ESI-模式下进行扫描,优化各化合物的质谱条件;检测方式:多反应监测模式(multiple reaction monitoring,MRM);离子源电压:5500 V;离子源温度:500 °C;气帘气:35 psi;雾化气:65 psi;辅助加热气:55 psi。
1.2.5 方法学考察
1.2.5.1 基质效应 茶叶的基质较复杂,可能存在基质抑制或基质增强效应。分别用厂家1复杂基质净化柱处理所得的空白绿茶基质和1%乙酸-乙腈提取溶剂配制浓度为50 μg/L的14种混合农药标准溶液,重复测定3次,考察14种农药在绿茶中的基质效应。
基质效应(Matrix effect,ME)按下式计算:
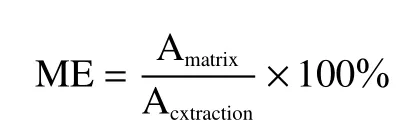
式中:ME表示基质效应,%;Amatrix表示基质混合标准溶液中目标分析物的峰面积(A,peak area);Aextraction表示提取溶剂混合标准溶液中目标分析物的峰面积。
1.2.5.2 方法的线性范围、检出限、定量限 采用基质匹配标准溶液建立标准曲线。按照1.2节描述配制质量浓度为1、5、10、20、50、100 μg/L的系列基质混合标准工作液,以各个农药的峰面积为纵坐标,相应的浓度为横坐标,获得目标物农药的线性回归方程,分别以信噪比(S/N)为3和10时对应的空白样品添加浓度为检出限(Limit of detection, LOD)和定量限(Limit of quantification, LOQ)。
1.2.5.3 回收率和精密度 分别在空白绿茶和红茶样品中添加低、中、高浓度(100、500、800 μg/kg)农药进行加标回收率试验,各浓度平行试验6次,计算平均回收率及测定结果的相对标准偏差(RSD)。
1.2.5.4 实际茶样品检测 利用本文方法对市售的30种茶叶进行检测,分析其中14种目标农药的残留浓度。
1.3 数据处理
分别利用Analyst 1.7和Sciex OS 1.7.0软件进行数据采集及处理,Origin 9.0进行数据分析。
2 结果与分析
2.1 色谱、质谱条件优化
使用SHIMAZU Shim-pack Velox Biphenyl C18色谱柱(3 mm×50 mm,2.7 μm),设定流速为0.3 mL/min,分别考察了以乙腈-水、甲醇-水、0.1%甲酸水溶液-甲醇、0.1%甲酸水溶液-甲醇(含2 mmol/L甲酸铵)、0.1%甲酸水溶液-甲醇(含5 mmol/L甲酸铵)为流动相对14种农药检测结果的影响,梯度洗脱程序见1.2.3。结果表明,选用0.1%甲酸水溶液-甲醇(2 mmol/L甲酸铵)为流动相时,14种农药的响应值和峰形最好。14种农药的总离子流图见图1。
将14种农药的0.1 mg/L混合标准溶液通过针泵进样方式进行质谱方法调谐,在ESI+和ESI-模式下进行扫描。结果显示,14种农药的母离子均为[M+H]+模式。手动调谐优化14种农药母离子和子离子,选取两组灵敏度最佳的离子对作为定量离子对和定性离子对,获得最佳的碰撞电压和碰撞能量,最终得到MRM模式下14种农药优化的质谱采集参数如表2所示。
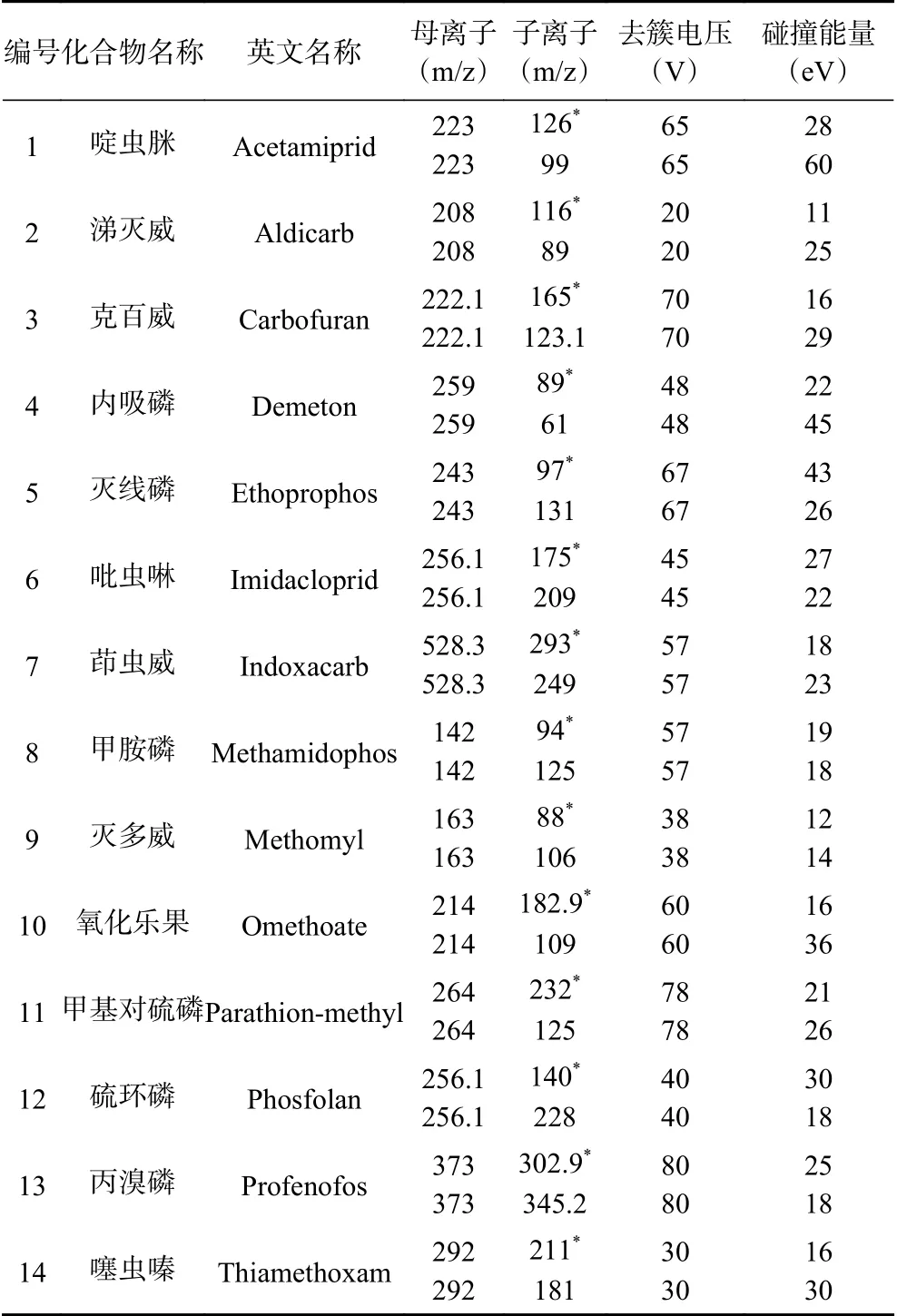
表2 14种农药的质谱参数Table 2 MS parameters of the 14 pesticides
2.2 提取方法选择
QuEChERS样品前处理主要由提取和净化两部分组成。在提取阶段,常用的提取溶剂有乙腈、丙酮、乙酸乙酯、甲醇、正己烷等。乙腈因最适宜于提取各种极性的农药残留,同时不会萃取出很多油性物质(如蜡、油性色素、脂肪等),且仅需加入盐便可实现与水相的分离,是目前使用最广泛的提取溶剂。研究表明,在乙腈中加入1%乙酸,并在盐析过程中加入MgSO4和缓冲盐CH3COONa可对绝大多数农药残留得到较高的回收率[23]。另外,对于含水量低的样品,通过先向样品中添加一定量的水,可弱化待分析物与样品基质之间的相互作用,使待分析物更易在萃取/分配过程中被充分提取[24]。
本研究首先向茶叶样品中加入适量水充分浸润,再分别使用乙腈及含1%乙酸的乙腈作为提取溶剂,震荡均匀后加入含6 g MgSO4和1.5 g CH3COONa的盐包,进行提取效果的比较,结果表明(图2),采用1%乙酸-乙腈作为提取溶剂时,其农药回收率高于乙腈作为提取溶剂,因此,本文选择1%乙酸-乙腈作为提取溶剂。
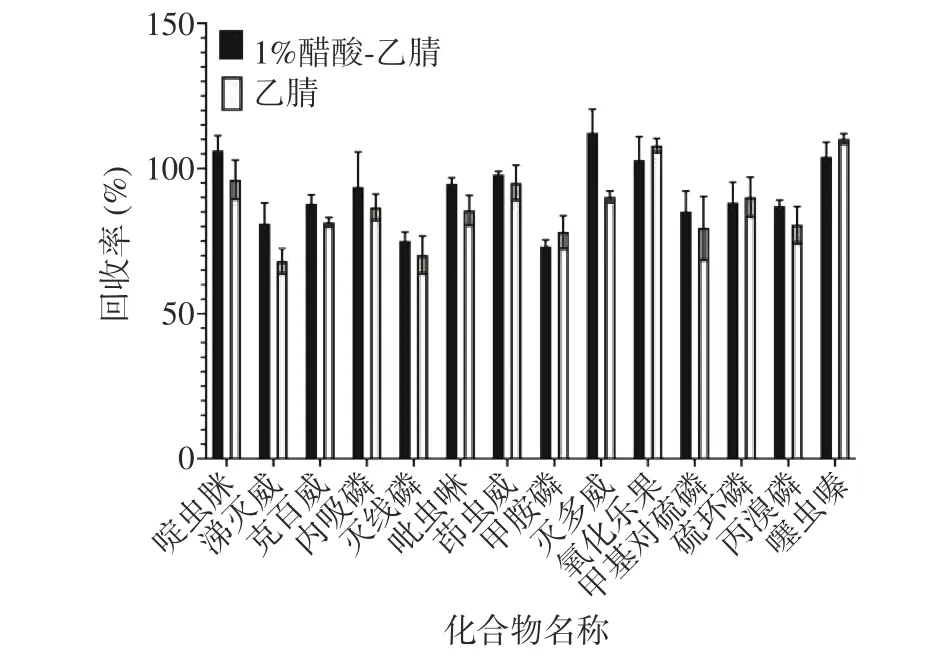
图 2 不同提取液对目标化合物回收率的影响Fig.2 Effect of different extracts on target compound recovery
2.3 净化方式优化
茶叶样品基质复杂,其中的茶多酚、咖啡因、色素、有机酸等物质易和待测目标物共提取,干扰检测的准确性和灵敏度[6]。常见的净化剂有无水MgSO4、PSA、GCB和C18等。无水MgSO4能除去提取液的少量水分,PSA可有效去除脂肪酸、有机酸、一些极性色素和糖类,GCB能有效去除具有平面结构的甾醇和色素类杂质,C18吸附剂对油脂的去除效果十分明显[25]。另外,一些新型净化材料如多壁碳纳米管(MWCNTs)和石墨烯等因被证实能有效去除基质中色素类、糖类、氨基酸等干扰物,并在一定程度上改善GCB对部分平面结构化合物的吸附问题,也逐渐得到应用[26-27]。传统的净化方法是向提取液中加入一定量吸附剂,充分震荡使吸附剂与样品充分反应,最后离心去除吸附剂。为了使操作更加快速高效,本文使用将净化剂固相化的QuEChERS净化柱对提取液进行净化,省去震荡、涡旋和离心等步骤从而缩短了样品前处理时间。
本文考察了在空白绿茶和红茶样品中添加800 μg/kg目标化合物,采用两个厂家四种商品化QuEChERS净化柱(成分及含量见表1)对茶叶提取液净化效果和农药回收率的影响。如图3所示,由茶叶提取液经不同净化柱净化后的颜色深浅可初步判断,复杂基质净化柱对于色素杂质的净化效果好于简单基质净化柱,这是因为复杂基质净化柱中的GCB或MWCNTs对色素有很好的吸附作用。根据图4可知,对于绿茶样品,厂家1简单基质净化柱对14种农药的回收率(56.3%~91.1%)整体低于厂家1复杂基质净化柱(73.4%~112.4%),且色谱图中杂峰较明显(见图5),可见含有GCB(5 mg)的复杂基质净化柱能有效吸附色素等杂质,降低提取液中高浓度杂质对目标分析物检测的影响;绿茶样品经厂家2简单基质净化柱处理后对14种农药回收率(42.7%~79.3%)和经厂家2茶叶专用柱净化后对14种农药回收率(52.7%~71.2%)整体低于厂家1净化柱,说明厂家2两种净化柱中较高含量的MWCNTs(分别为15和45 mg)对目标化合物产生了一定吸附从而导致回收率降低。对于红茶样品,采用四种净化柱处理后14种农药回收率整体高于绿茶样品,且净化后样品颜色比绿茶浅,说明绿茶和红茶在茶多酚、生物碱、色素等成分上的差异会影响净化效果和检测结果,在实际检测中应根据样品具体情况进行优化。

图 3 绿茶和红茶经不同净化柱处理后茶叶提取液的颜色对比Fig.3 Comparison of green tea and black tea extracts using different purification columns
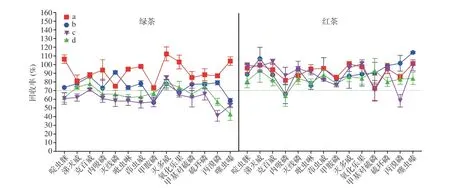
图 4 不同净化柱对目标化合物回收率的影响Fig.4 Effect of different purification columns on the target compound recovery
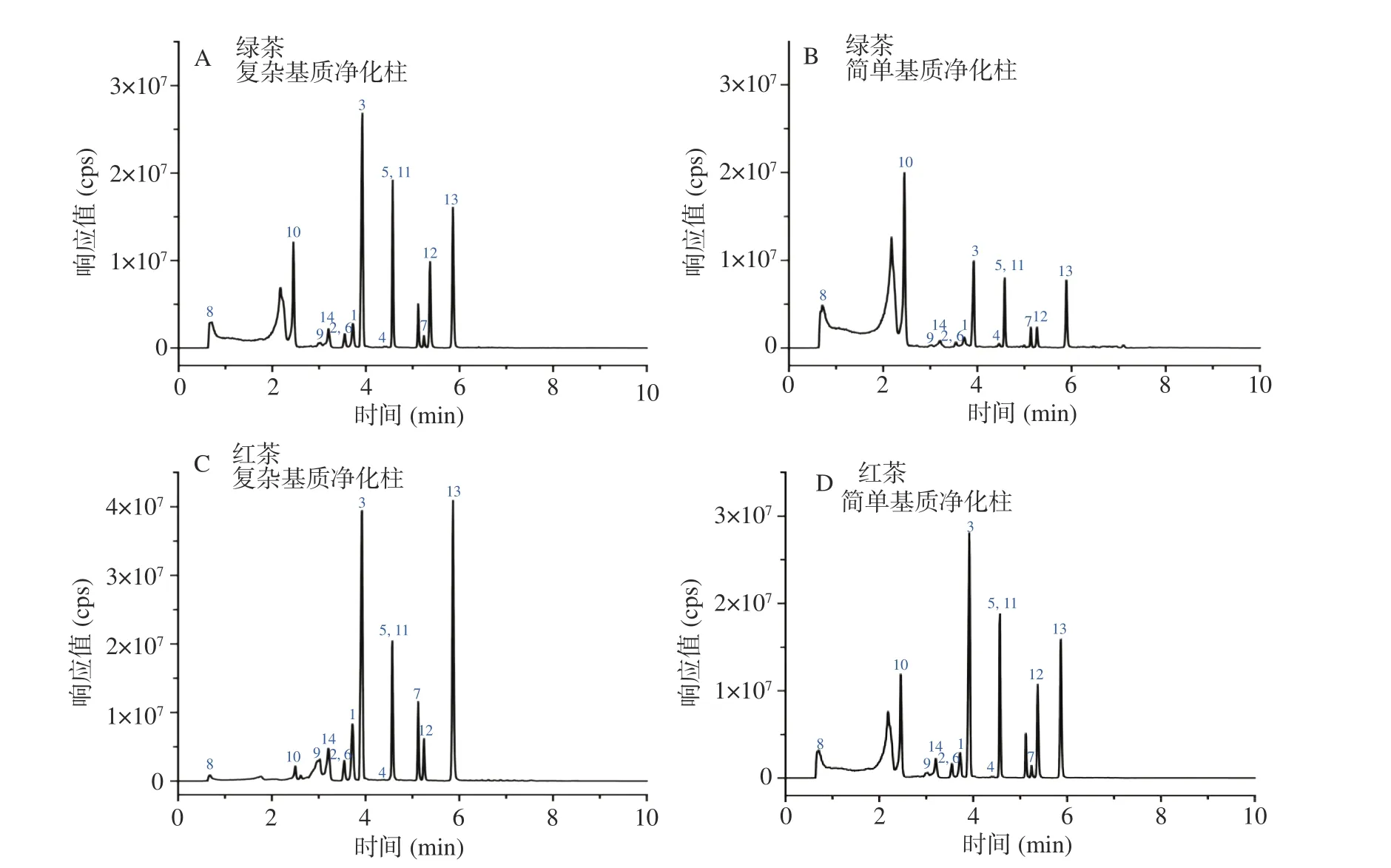
图 5 总离子流色谱图Fig.5 Total ion chromatograms (TIC)
综合考虑,本文使用净化效果和回收率都较好的厂家1复杂基质净化柱,进一步考察方法的基质效应、线性关系、回收率等,并对实际样品进行检测。
2.4 基质效应
茶叶中的茶多酚、生物碱、色素等易和目标物分析物共提取,难以通过净化全部去除,从而对目标分析物的离子化效率产生影响,即产生基质效应(Matrix effect,简称ME)[28-29]。我们分别用厂家1复杂基质净化柱处理所得的空白绿茶基质和1%乙酸-乙腈提取溶剂配制浓度为50 μg/L的14种混合农药标准溶液,重复测定3次,考察14种农药在绿茶中的基质效应。由表3可以看出,绿茶基质对14种农药的基质效应不同,10种农药ME>105%,为基质增强;2种农药ME<85%,为基质抑制;2种农药ME在85%~105%之间,表示无基质效应。因此,对茶叶农残检测,采用空白基质配制标准曲线进行定量分析以减弱基质效应的影响,提高定量结果的准确性。
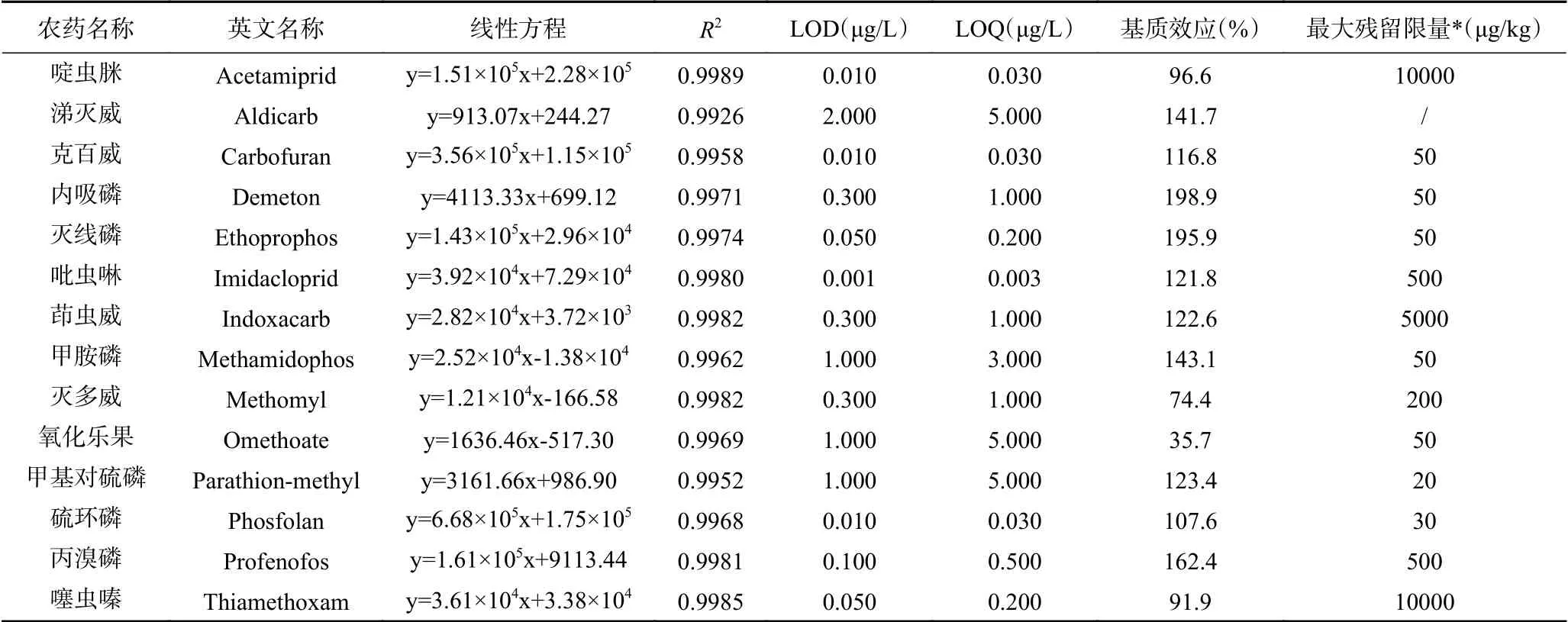
表3 14种农药的线性方程、决定系数、检出限、定量限、基质效应和最大残留限量Table 3 Linear equations, coefficient of determination (R2), LODs, LOQs, matrix effects and the maximum residue limits of 14 pesticides
2.5 线性关系、检出限、定量限
由表3可知,14种农药在相应的线性范围内线性关系良好,R2>0.99。以信噪比(S/N)为3和10时对应的空白样品添加浓度为检出限(Limit of detection,LOD)和定量限(Limit of quantification, LOQ),14种农药LOD在0.001~2.000 μg/L之间,LOQ为0.003~5.000 μg/L。根据GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》,除涕灭威在茶叶中的最大残留量未做规定,其余13种农药的检出限和定量限均远低于规定的最大残留量,说明本文方法满足实际检测需求。
2.6 回收率和精密度
如表4所示,在向空白绿茶和红茶样品中添加低、中、高浓度(100、500、800 μg/kg)三个浓度水平下,方法的平均回收率为71.2%~117.4%,RSD为1.1%~14.2%,说明该方法对绿茶和红茶中14种农药残留检测的准确度和精密度良好,能够满足茶叶样品多农药残留分析的要求。
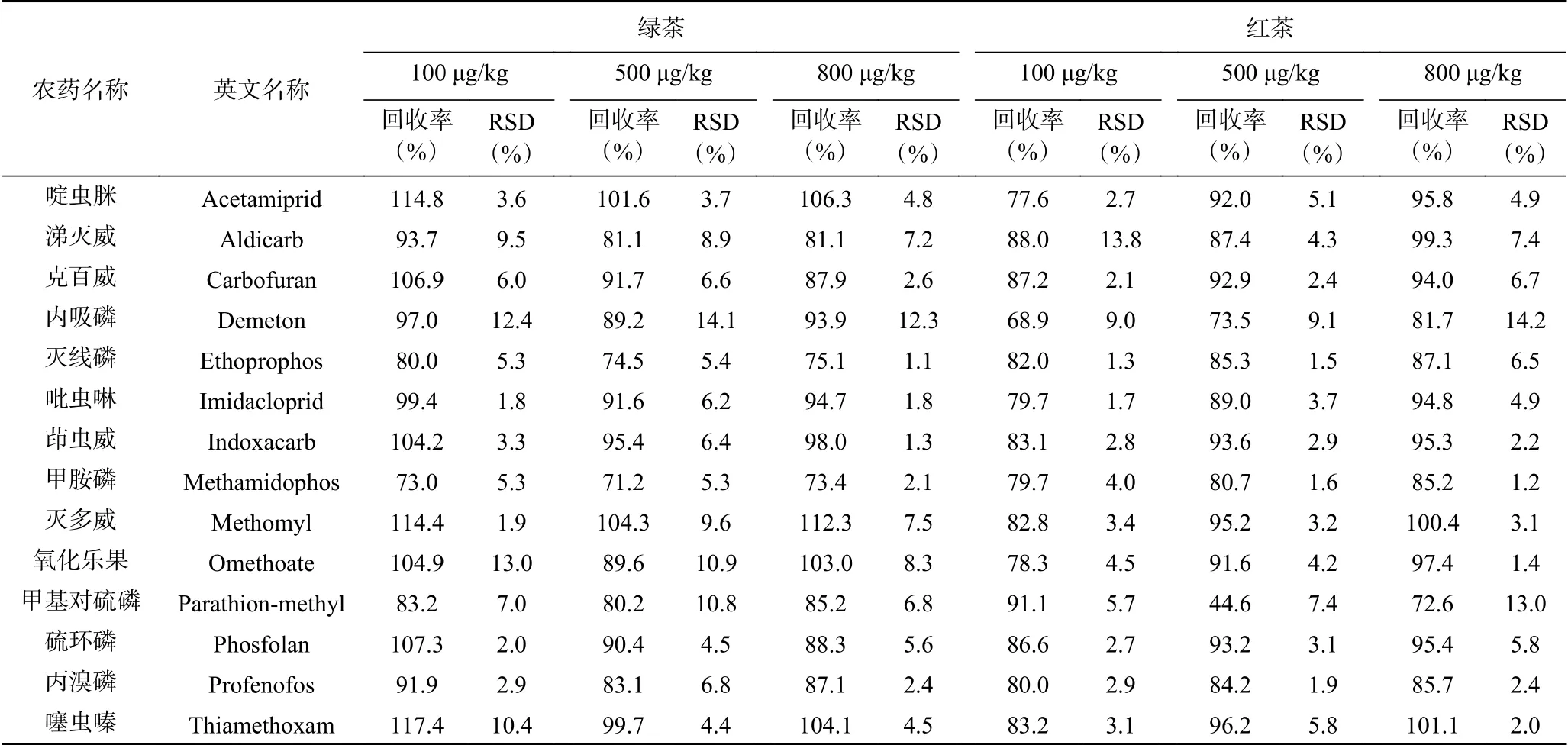
表4 14种农药在绿茶和红茶中的加标回收率和相对标准偏差(n=6)Table 4 Recoveries and RSDs of the 14 pesticides spiked in green tea and black tea (n=6)
2.7 实际样品检测
利用本文方法对市售的30种茶叶进行检测,如表5所示,有6种茶叶检出目标农药,其中5种茶叶检出啶虫脒,残留量为2.4~14.1 μg/kg;2种茶叶检出克百威,残留量分别为1.9、23.0 μg/kg;2种茶叶检出吡虫啉,残留量分别为1.9、33.7 μg/kg;1种茶叶检出茚虫威,残留量为3.0 μg/kg;1种茶叶检出噻虫嗪,残留量为2.4 μg/kg。上述茶叶中农药残留均未超过国家标准GB 2763-2021规定的最大残留限量值。

表5 6种检出目标农药的茶叶中农药残留浓度(μg/kg)Table 5 Concentration of targeted pesticides detected in six tea samples
3 结论
本文采用QuEChERS前处理方法结合UPLCMS/MS技术,建立了茶叶中啶虫脒、涕灭威、克百威、内吸磷、灭线磷、吡虫啉、茚虫威、甲胺磷、灭多威、氧化乐果、甲基对硫磷、硫环磷、丙溴磷、噻虫嗪等14种农药残留的快速检测方法。通过优化提取液组分、QuEChERS净化柱种类等,14种农药的LOQ可达到0.003~5.000 μg/L,在3个添加水平下的回收率为71.2%~117.4%,能够满足茶叶农药残留限量指标的快速检测要求。对30种市售茶叶样品进行检测,其中6种茶叶检出目标农药,测得农药残留浓度均未超过国家限量标准。本文方法具有操作简便快捷、净化效果好、灵敏度和准确率高等优点,为高效和准确地评价茶叶的质量安全提供了新的参考。
