骨桥蛋白基因沉默对子宫内膜异位症患者在位内膜细胞侵袭性的影响
2022-06-11白治苗刘玉锋郭玉琳
白治苗,刘玉锋,郭玉琳,赵 乐
(1.榆林市第二医院妇科,陕西 榆林 719053;2.榆林市第二医院神经外科,陕西 榆林 719053)
子宫内膜异位症(Endometriosis,EMS)是具有生物活性的子宫内膜出现在宫腔以外任何部位,好发于育龄期女性,以25~45岁为甚,生育少且晚的妇女发病概率明显低于生育多者。研究[1-4]发现EMS是引发20%~90%患者出现慢性盆腔疼痛、痛经,25%~35%患者不孕以及5%~15%妇科手术的根本原因。每个人对EMS的易患性受遗传、体内性激素及环境因素的共同影响。当前EMS的明确病因及机制尚无定论,但被统一接受的是1921年Sampon提出的经血逆流学说[5-6],但是该学说的具体分子机制及细胞因子通路仍不明确。因EMS患者子宫内膜组织可侵袭、转移到人体内任何器官,影响相应器官功能,出现相应症状,对女性健康危害较大[7-9]。EMS在病理诊断上是良性的,但病理和发病机制却类似于恶性肿瘤,如黏附、侵袭及远处转移等生物学能力。当前对EMS的诊治手段有限。研究[10-11]发现,核因子(Nuclear factor,NF)-κB、骨桥蛋白(Osteopontin,OPN)、基质金属蛋白酶(Matrix metalloproteinase,MMP)-9在EMS患者中高表达,且呈正相关。针对大鼠EMS模型的实现[12]亦证实上述因子高表达,且与子宫内膜异位黏附、侵袭性明显相关。有研究[13]在对大鼠EMS模型行OPN基因敲除后发现病灶较前明显缩小,但是对于OPN如何发挥作用并未给出明确的结果。研究[14]发现OPN与其受体结合后激发NF-κB及其相关通路因子,致使该因子从NF-κB-IkBs复合物中分离,从胞质进入胞核后具有活性,与其他因子发生结合后可参与相关基因的有关细胞凋亡及转录调控。所以,OPN可能是导致EMS发生,子宫内膜远处黏附、侵袭的关键因子。鉴于此,本研究通过沉默OPN基因观察EMS患者在位内膜细胞侵袭性的变化。
1 材料与方法
1.1 实验材料 本实验所获取的子宫内膜组织来源于从2019年1月至2020年1月因“单侧或双侧卵巢巧克力囊肿”于我院行腹腔镜下卵巢囊肿剥除术的患者20例。在手术中刮取子宫内膜组织,且根据末次月经计算均处于月经分泌期(前期实验发现分泌期OPN的表达高于增殖期)。
1.2 主要试剂 OPN多克隆抗体(批号:716-456-142,稀释浓度1∶100,美国Abcam公司);DAB显色试剂盒(批号:180704,北京中杉生物工程公司);PV-6001试剂盒(北京中杉生物工程公司);TRIzol、反转录试剂盒、荧光定量试剂(上海生工生物工程有限公司);RIPA裂解液(上海碧云天生物技术有限公司);特异小RNA(siRNA)片段(上海吉玛生物制药有限公司);细胞培养小室(密理博中国有限公司);RT-PCR反转录试剂盒(美国Invitrogen公司)。
1.3 实验方法
1.3.1 原代细胞培养及鉴定:将手术中刮取的内膜组织于低温条件下带入细胞间,用PBS溶液冲洗数次后放置于培养皿中,剪刀剪碎至1 mm×1 mm×1 mm大小的组织块,倒入10 ml离心管中,加入5 ml 0.03% Ⅳ胶原酶,在37 ℃条件下反复消化3次,每次8 min。于离心器中以500 r/min离心30 s。反复离心后结合显微镜下观察,获得子宫内膜腺上皮细胞,添加细胞培养液,打匀后分至80~100 mm培养皿中,放入培养箱中培养。每日更换细胞培养液,直至达到90%融合。免疫细胞化学鉴定:待细胞融合至90%,用0.25%胰酶将其消化,用一次性吸管将细胞悬液滴至预先放有盖玻片的6孔板中,将6孔板放置于5% CO2细胞培养箱进行细胞爬片。于第 7 天用无水乙醇固定细胞约 10 min。滴加一抗(鼠抗人细胞角蛋白多克隆抗体和鼠抗人波形蛋白抗体稀释浓度均为1∶100)4 ℃孵育过夜。滴加二抗(PV6000),DAB 显色。细胞质被染成棕黄色视为阳性。
1.3.2 OPN siRNA干预:当细胞融合度为90%时行siRNA干预。用500 μl无血清培养基稀释10 μl Trans Lipid HL(北京全式金公司),500 μl无血清培养基稀释10 μl OPN siRNA,静置5 min后将稀释好的OPN siRNA与Trans Lipid HL轻柔混合,室温静置20 min后将混合物加入含5 ml无血清培养液的60 mm培养皿中作为干预组,将不加混合物的培养皿(加入等量培养液)作为未干预组。放入培养箱中培养4~6 h后更换培养液,继续培养24 h。 OPN siRNA序列:正义链为5’-GGUCAAAAUCUAAGAAGUUTT-3’,反义链为5’-AACUUCUUAGAUUUUGACCTC-3’。 未干预组无意义链siRNA序列:正义链为5’-UUCUCCGAACGUGUCACGUTT-3’,反义链为5’-ACGUG-
ACACGUUCGGAGAATT-3’。
1.3.3 RT-PCR检测mRNA表达:提取原代细胞中RNA并设计引物。OPN正向引物序列为5’-ACAGCCGTGGGAAGGACAGTTA-3’,反向引物序列为5’- CCTGACTATCAATCACATCGGAATG-3’。β-actin正向引物序列为5’-AGCGAGCATCCCCCAAAGTT-3’。按照北京中杉公司cDNA合成试剂盒进行反转录获得cDNA,取4~5 μl反应产物行琼脂糖凝胶电泳。OPN的相对表达量采用2-△△CT计算。
1.3.4 Western blot检测蛋白表达:提取细胞中蛋白,采用凯基蛋白提取试剂盒检测蛋白表达(根据说明书,OPN按1∶100稀释)。制备SDS分离胶、浓缩胶,插入相应的梳子,加入干预前后蛋白样品及标准蛋白标志物,电泳分离蛋白质后,转印蛋白于硝酸纤维素膜。载有蛋白的硝酸纤维素膜经5% 脱脂牛奶封闭后,加入OPN及β-actin等一抗4 ℃过夜,经TBST换洗5 min×5次后,加相应二抗孵育2 h,进行增强型ECL显影,于Bio-Rad成像仪中曝光成像并测定各蛋白条带光密度值,计算相应的光密度比值。
1.3.5 穿膜实验:制备细胞悬液,当培养于60 mm培养皿中腺上皮细胞及OPN siRNA干预24 h后的原代细胞融合大约80%~90%时,采用胰酶消化,用细胞培养液将其制成原代细胞悬液,计数后将细胞悬液加入小室(ECM550,购置于Chemicon公司)中,把侵袭小室的膜置于载玻片上,盖上盖玻片,行苏木素染色后于显微镜下行细胞计数和拍照,每张分别选取16个固定位置的视野,计数细胞数量并比较OPN siRNA干预前后腺上皮细胞穿膜数目的变化。

2 结 果
2.1 EMS患者腺上皮细胞鉴定 见图1。培养原代EMS患者子宫内膜腺上皮细胞,镜下观察发现最初几天腺上皮细胞成团生长,呈铺路石样,后向周围扩散,直至融合。通过腺上皮细胞和间叶细胞独有的标志物广谱角蛋白、波形蛋白,结果发现绝大多数细胞pan-CK染色阳性,而VIMITEN染色阴性,说明培养出来的团块状细胞为子宫内膜腺上皮细胞。

A:pan-CK染色阳性,细胞质内出现棕黄色颗粒(免疫组化染色,×400);B:VIMITEN染色阴性,细胞质及核内均未见明显的棕黄色颗粒(免疫组化染色,×400);C:原代细胞培养第2天,细胞成团生长(免疫组化染色,×100)
2.2 两组细胞OPN蛋白和mRNA表达比较 见表1。与未干预组比较,干预组腺上皮细胞OPN蛋白和mRNA表达明显下降(均P<0.05)。
2.3 两组细胞侵袭性比较 见图2。与未干预组比较,干预组穿膜细胞数明显降低(P<0.05)。
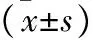
表1 两组细胞OPN蛋白和mRNA表达比较
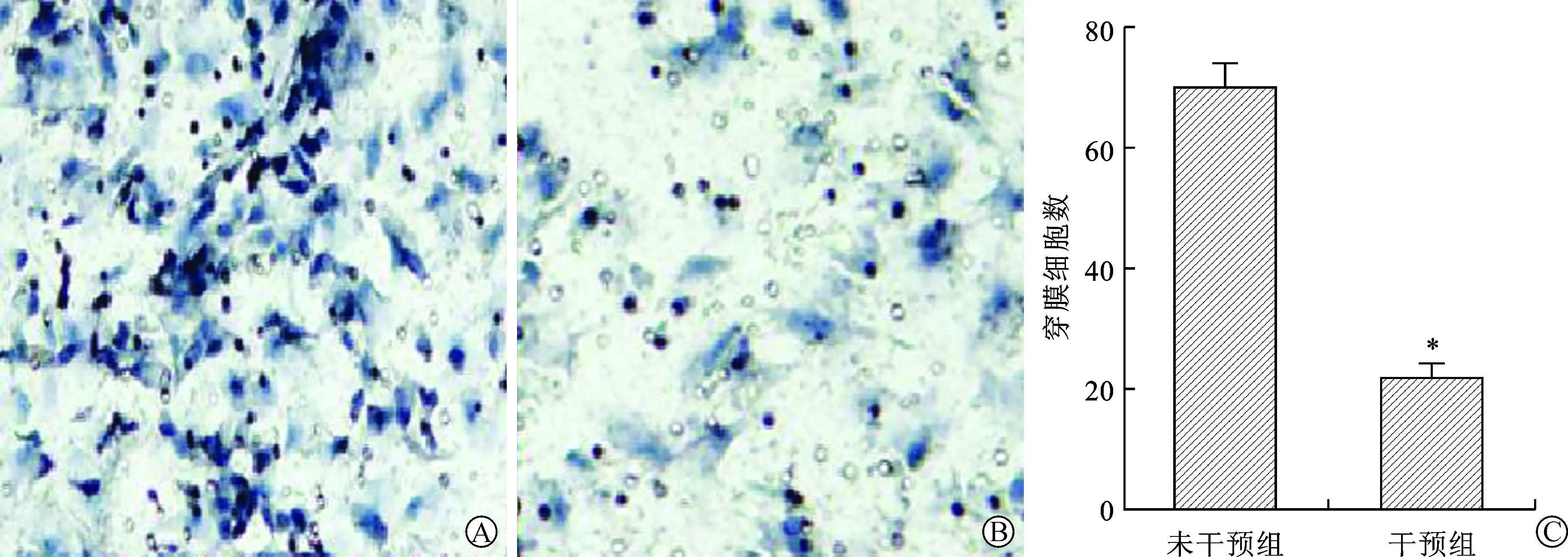
A、B:干预组(A)和未干预组(B)穿膜实验结果(苏木素染色,×200);C:与未干预组比较,*P<0.05
3 讨 论
EMS虽然是常见良性疾病,但有类似恶性肿瘤的黏附、转移特点,是导致女性经期疼痛、慢性盆腔痛、继发性不孕等症状的重要原因[15-16]。目前EMS治疗手段局限,术中全部病灶清除困难,术后仍有慢性盆腔痛,需要药物巩固治疗。
OPN是1979年Senger等于骨基质中发现的,研究[17]发现其与正常细胞的恶性变密切相关,其本质是带负电荷的钙结合的分泌型磷酸化糖蛋白,组织结构中富含精氨酸-谷氨酸-天冬氨酸序列。OPN在人体胚胎、妊娠子宫蜕膜、肾和许多恶性肿瘤细胞等中有较高的表达[18]。肿瘤机制学研究中发现OPN与恶性肿瘤的形成紧密相关。分子学研究[19]发现OPN通过与自身受体avβ3结合后激活依赖MAPK/PI3K通路的NF-κB通路,激发细胞中尿激酶型纤溶酶原激活物(uPA)和MMPs等相关因子的分泌,引导细胞侵袭过程、细胞胞质中MMPs降解和重塑、细胞迁移及宿主免疫细胞逃逸和新生血管形成,发挥抑制细胞凋亡、促进肿瘤血管生成及肿瘤细胞转移等作用,从而诱导肿瘤的发生。
目前已经有学者通过实验证实OPN在乳腺癌、胃癌以及妇科宫颈癌等恶性肿瘤中呈高表达,由此引发猜想,该因子是否与恶性肿瘤细胞于正常组织处黏附、侵袭及远处转移的生物学特性有关。许多研究发现OPN在EMS患者内膜组织整个月经周期中波动性表达,并且其表达明显高于正常内膜组织,于月经周期分泌期的表达明显高于增殖期,充分说明OPN是与孕卵着床密切相关的一种窗口期黏附因子,并受孕激素的调控,与该EMS的临床药物治疗机制相吻合。本实验组前期实验[20]已经证实以上说法。有研究通过诱导形成大鼠异位病灶,敲除OPN基因后发现大鼠EMS病灶明显缩小,显示OPN与EMS病灶大小、数目及体积密切相关。
本研究通过原代细胞培养,分离并培养出纯度较高的子宫内膜腺上皮细胞,排除了间质细胞的扰乱。经过其独有的角化蛋白、间质细胞波形蛋白证实其为子宫内膜腺上皮细胞。与未干预组比较,干预组腺上皮细胞OPN蛋白及mRNA表达均明显下降,穿膜细胞数目明显减少。由此我们得出,OPN可能是引起EMS的关键因子。结合既往研究分析, OPN与其受体结合后可能促进相关因子的释放,进而介导了一系列的细胞反应,导致EMS的发生。
综上所述,OPN基因沉默后子宫内膜腺上皮细胞OPN蛋白及mRNA表达下降,穿膜数量减少,侵袭性降低。本研究为临床医生从机制学出发对EMS进行有效靶向药物干预、指导临床用药和术后随访提供了可靠的依据,拟于后期研究中进行质粒导入联合药物干预增强OPN的表达,再次检测细胞黏附能力及侵袭性的变化,以进一步证实我们的推测。本研究存在的不足之处为样本量较少,原代细胞培养繁琐,后期会加大样本量,尝试细胞传代,以增加数据的可靠性。
