斑菲素蛋白2在食管鳞状细胞癌组织中的表达及临床意义
2022-06-11林晓溪张俊毅
林晓溪,张俊毅
(1.锦州医科大学赤峰学院培养基地,内蒙古 赤峰 024099;2.赤峰市医院肿瘤内科,内蒙古 赤峰 024099;3.赤峰学院附属医院病理科,内蒙古 赤峰 024099;4.赤峰学院临床病理研究所,内蒙古 赤峰 024099)
食管鳞状细胞癌(Esophageal squamous cell carcinoma,ESCC)为常见的食管癌类型,患者生存率较低,预后不良[1]。近年尽管手术、放化疗等技术得到提升,但ESCC治疗效果并未得到明显改善,除部分可利用消化内镜切除的食管早期病变之外,大多数ESCC患者5年生存率仍处于较低水平,预后不佳[2]。因此,采取行之有效的方式准确预测ESCC患者预后对临床进一步治疗及随访意义重大。TNM分期是评估ESCC患者预后的重要方式,但TNM分期对于不能进行手术的患者仍存在局限性,部分患者无法明确分期,且对于仅能获得小标本的患者更是如此[3-4]。斑菲素蛋白2(Plakophilin 2,PKP2)属于细胞黏附分子连环蛋白catenin家族成员之一,主要定位于桥粒,参与稳定细胞黏附连接作用,对维持细胞桥粒功能具有重要意义[5]。PKP2不仅对信号传导及细胞连接具有一定作用,而且参与肿瘤的发生、发展[6]。目前关于PKP2用于评价恶性肿瘤及预后的研究较少,而将其在ESCC中的表达意义也未见报道。基于此,本研究分析PKP2在ESCC中的表达意义,以探究该指标用于预测ESCC患者预后的临床价值。
1 资料与方法
1.1 一般资料 选择赤峰学院附属医院2010年1月至2015年12月收治的115例ESCC患者的组织标本和20例癌旁正常食管组织标本。另选取15例冰冻新鲜食管癌标本及癌旁正常食管上皮标本提取RNA用来检测PKP2的表达。115例ESCC患者中,男性87例,女性28例;中位年龄57岁;肿瘤pTNM分期[7]中,Ⅰ期14例,Ⅱ期45例,Ⅲ期56例,Ⅳ期0例;分化程度[8]中,高分化20例,中分化84例,低分化11例;淋巴结转移50例;27例肿瘤最长径>3 cm,88例≤3 cm;食管上段7例,中段50例,下段58例。患者术后随访资料完整。病例纳入标准:经病理学检查证实为ESCC;患者资料完整,包括本研究所需资料;术前未接受其他抗肿瘤治疗;无其他良恶性肿瘤。排除标准:因严重术后并发症或其他原因导致的病死患者;术前发生全身转移者;既往存在其他恶性肿瘤病史;合并肝功能衰竭、肾功能衰竭等其他重要脏器疾病者;合并血液系统疾病者;伴免疫系统疾病者等。
1.2 试剂与仪器 鼠抗人单克隆抗体PKP2(批号:20090816、20110626、20130507,美国Santa Cruz公司);免疫组化试剂盒(PV-9000,上海欣奥盛);DAB 酶底物显色试剂盒(福州迈新生物公司);图像采集分析系统、石蜡切片机(德国Leica公司)。
1.3 检测方法
1.3.1 制备组织芯片:组织标本用10%的中性福尔马林溶液固定,由经验丰富的病理科医师对癌组织及癌旁组织取材,常规脱水,浸蜡包埋。制备组织芯片前进行HE染色,选择蜡块上具有代表性区域,用组织点样仪在蜡块上取孔,获得组织条(直径约为1.5 mm),再使用蜡块模打孔仪制作组织芯片蜡块。切片4 μm厚的组织芯片,捞片置于阳离子防脱载玻片上,制成组织芯片,并由病理科医师判读确认取点正确。
1.3.2 免疫组织化学染色:采用二步法免疫组织化学染色法。检测开始前,将组织芯片的切片置于恒温箱中烤片,脱蜡水洗,进行微波抗原修复(95 ℃)。切片与一抗孵育过夜。冲洗后进行DAB显色,复染。结果判定:在光镜下进行观察,计400个细胞。①染色强度:0分为阴性,弱阳性、中度、强阳性分别记为1、2、3分。②阳性细胞数:0分为无;1分为0%~25%;2分为25%~50%;3分为50%~75%;4分为75%以上。染色强度与阳性细胞数评分乘积为最终得分,低于2分为阴性表达,反之为阳性表达。
1.3.3 PKP2 mRNA相对表达量检测:以β-actin为内参,采用RT-PCR方法检测PKP2 mRNA相对表达量。测量3次,取平均值。

2 结 果
2.1 癌旁组织与ESCC组织免疫组化染色结果比较 见图1。20例癌旁组织中,PKP2阳性信号主要定位在细胞质,且表达微弱,依据评分标准被评为阴性。115例ESCC组织中,PKP2阳性信号主要定位在细胞质,且阳性细胞数与染色强度显著增加,其中54例患者呈阳性表达,占比46.96%(54/115),较癌旁正常食管上皮表达(0/20)显著增高(χ2=15.652,P<0.001)。
2.2 PKP2表达与临床病理参数间的关系 见表1。阳性表达组淋巴结转移、TNM高分期占比较阴性表达组高(均P<0.05)。两组其他项目比较,差异无统计学意义(均P>0.05)。
2.3 不同PKP2表达患者生存情况分析 见图2。54例PKP2阳性表达患者随访结束后,死亡44例,病死率为81.48%。61例PKP2阴性表达患者随访结束后,死亡30例,病死率为49.18%。PKP2阳性表达组患者病死率高于阴性表达组(χ2=11.88,P=0.001)。生存分析发现,PKP2阳性表达患者的总生存时间为(24.173±2.045)个月,短于阴性表达组的(38.472±2.769)个月(t=31.157,P<0.001)。

图1 正常食管组织及ESCC组织中PKP2免疫组化染色结果(×200)
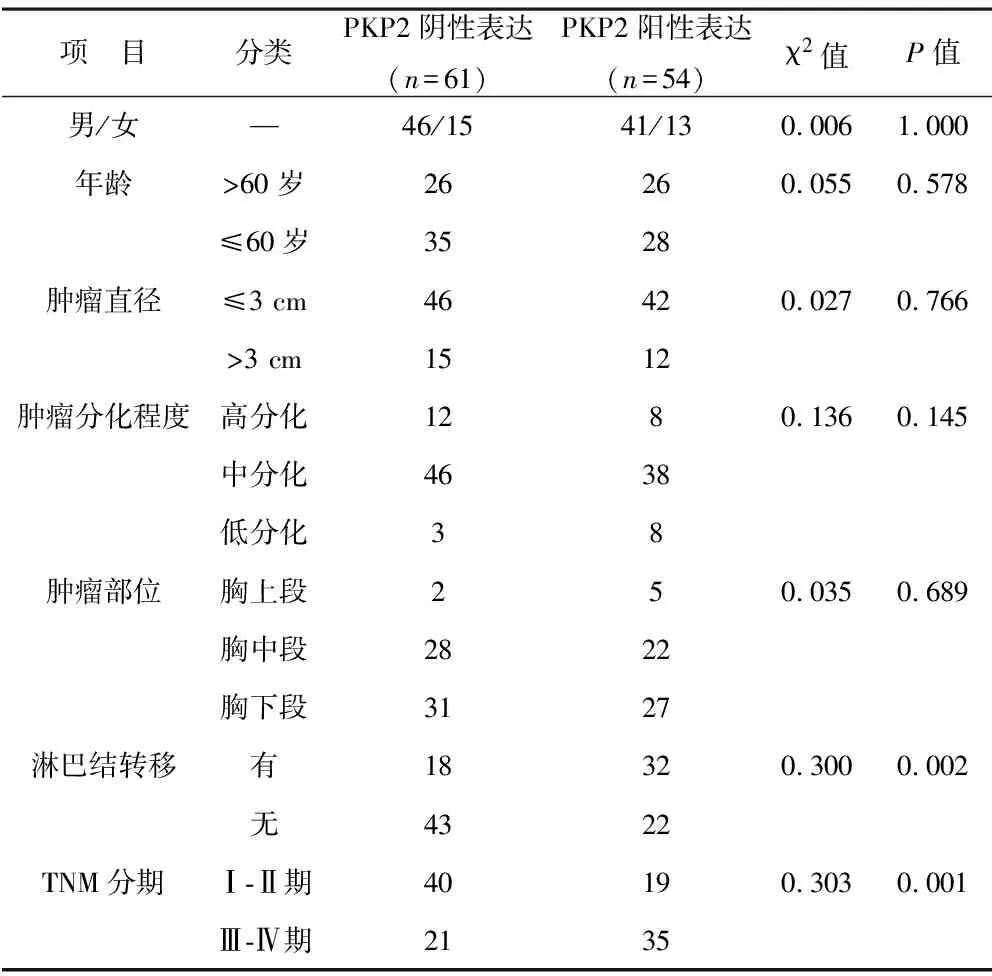
表1 PKP2表达与临床病理参数间的关系(例)

图2 不同PKP2表达患者Kaplan-Meier生存分析曲线
2.4 癌旁组织与ESCC组织PKP2 mRNA表达比较 见图3。癌旁组织中PKP2 mRNA平均灰度值为0.25±0.07,而ESCC组织PKP2 mRNA平均灰度值为0.86±0.03,ESCC组织中PKP2 mRNA平均灰度值高于癌旁组织(t=65.638,P<0.05)。
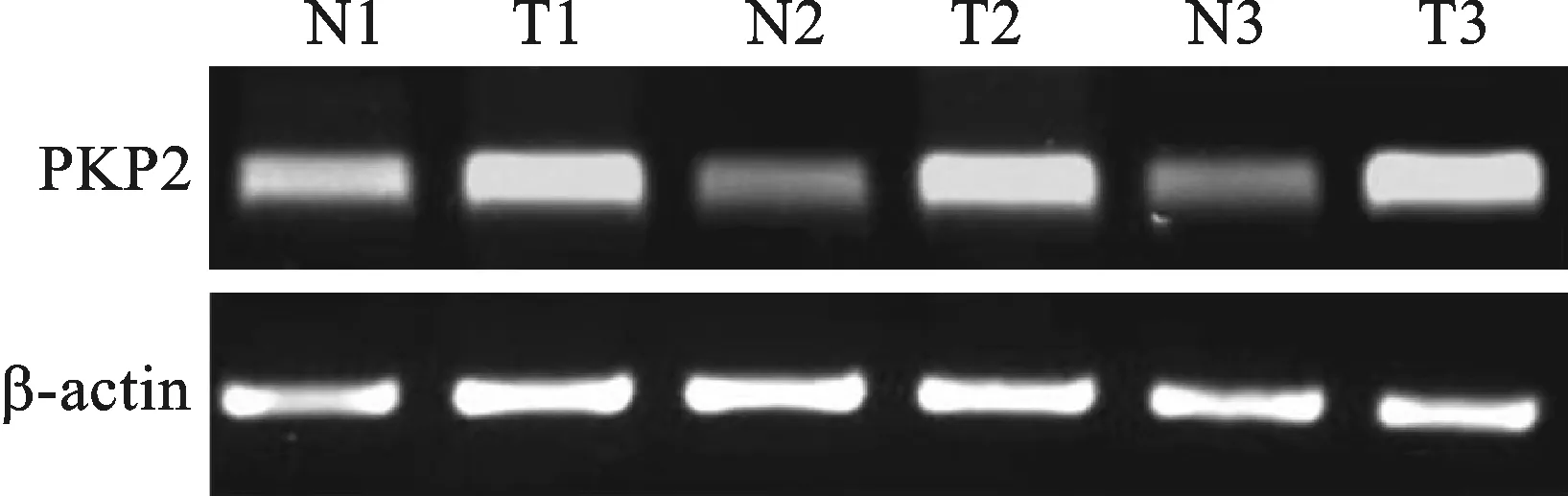
图3 三对癌旁组织(N)和ESCC组织(T)中
2.5 PKP2预测价值分析 将表1中初次经卡方检验差异有统计学意义的临床病理参数(淋巴结转移和TNM分期)作为状态变量,将PKP2表达作为检验变量,绘制ROC曲线进行分析,结果显示PKP2高表达用于预测淋巴结转移、TNM分期的AUC分别为0.785(95%CI:0.648~0.801,P<0.001)和0.763(95%CI:0.629~0.797,P<0.001),因此具有一定预测价值。
3 讨 论
ESCC是常见的食管癌类型,若得不到及时、有效的诊治,肿瘤细胞不断扩散,将增加远处转移风险,导致患者病死[9-10]。目前外科手术仍是ESCC首选治疗方式,可有效切除病灶,改善患者临床症状。但研究[11]发现,ESCC患者术后5年生存率并无显著提高。因此,寻求科学有效的可预测ESCC患者预后的指标成为临床研究重难点。既往研究表示,年龄、病理分期、肿瘤分化程度、肿瘤部位等因素与ESCC患者的预后有密切联系,但近年发现年龄、疾病分期等相似患者的预后也有差异[12-13]。这可能与基因、多步骤等参与肿瘤发生及发展有关[14]。
PKP蛋白主要包括PKP1、PKP2、PKP3,所有p120ctn家族成员分子结构中均含45个氨基酸,主要定位在桥粒[15]。PKP蛋白与p120ctn参与稳定细胞黏附连接作用相似,在维持细胞桥粒中起到重要作用。此外,研究显示该家族很多成员在肿瘤发生及发展中起到重要作用。研究[16-17]报道,PKP3在非小细胞肺癌中呈高表达,与患者预后具有密切联系,且对该蛋白进行干扰后肿瘤细胞的生长也受到明显抑制。另有研究[18]发现,PKP3蛋白中mRNA增高对早期诊断胃肠道肿瘤有一定提示作用。研究[19]显示,在头颈部鳞癌中PKP1 mRNA过表达,且与PKP结构相似的p120ctn异常表达也与恶性肿瘤发生及发展有关。而PKP2作为p120ctn家族成员之一,推测其可能与肿瘤进展存在一定联系,但目前关于其与ESCC患者的预后关系研究更少。
本研究结果显示,与癌旁组织比较,PKP2在ESCC组织中表达更高,且阳性表达组患者TNM高分期占比、淋巴结转移率高于阴性表达者,提示PKP2在ESCC中发挥促癌基因作用,其表达水平升高可能参与并推动肿瘤的发生及发展。另外,研究结果也提示PKP2表达增高是由其基因在癌组织中高表达所致。生存分析发现,PKP2阳性表达组患者的总生存时间短于阴性表达者,提示PKP2阳性表达可能与ESCC患者生存时间有关。分析原因可能为:PKP2作为PKP蛋白家族成员,在上皮细胞中广泛表达,通过诱导表皮生长因子受体磷酸化并促进其活化介导肿瘤细胞生长信号,激活下游信号途径,从而刺激ESCC肿瘤细胞异常增殖,促进肿瘤的进展。PKP2也是一种桥粒结构成分,可以作为多功能支架进行黏附和信号传递,其高表达可通过调节局部黏附动力学和整合素蛋白表达支持肿瘤细胞的侵袭及转移,促进肿瘤进展,从而影响ESCC患者的预后。Fujita等[20]研究证实,PKP2表达与食管癌患者生存时间有关,本研究结果与之相符。ROC曲线分析结果显示,PKP2阳性表达可能预示ESCC患者淋巴结转移、TNM高分期风险,此时临床需结合该特征进行早期预测、诊断并干预,以最大限度地提高患者生存率。
综上所述,ESCC患者PKP2较癌旁组织表达增高,用于预测ESCC患者生存情况、TNM分期及淋巴结是否转移等有一定应用价值。但PKP2具体作用机制尚未明确,尚无较多循证学依据可作为理论支持;且本研究受纳入样本量及随访时间等限制,结果可能存在一定偏倚,研究仍有局限,对于PKP2表达是否能够作为ESCC预后预测因子还需今后进一步研究证实。
