和厚朴酚对缺氧心肌细胞的保护作用及机制研究
2022-06-11郭艳杰刘乃溶于心悦王梦柳
郭艳杰,刘乃溶,于心悦,王梦柳,王 博
(1.西安国际医学中心医院心脏内科,陕西 西安 710100;2.西安国际医学中心医院医教部,陕西 西安 710100;3.空军军医大学西京医院心脏内科,陕西 西安 710032)
心肌梗死(Myocardial infarction,MI)是冠状动脉疾病的复杂表型之一,是多种遗传和环境因素相互作用的结果[1]。尽管医学技术的进步已经使得MI后患者病死率下降,但近年来MI后心力衰竭的发生率和患病率仍然在不断增加。MI后5年病死率仍高达为30%~70%[2]。MI后的心脏保护研究策略仍然迫切。和厚朴酚(Honokiol,HK)是从广玉兰球果中提取的天然双酚类化合物,在中药中得到了广泛的应用。HK对卵巢、肾脏、大脑、心脏等显示出确切的保护作用[3-4]。然而,HK对缺氧的心肌细胞是否具有保护作用及其机制尚不清楚。研究[5-6]报道,去乙酰化酶沉默信息调节因子3(Silence information regulator 3,SIRT3)在各种心血管疾病的发病机制中发挥关键作用,包括缺血性心脏病、心肌肥厚、心力衰竭、糖尿病心肌病、心脏脂毒性、药物诱导的心脏毒性和MI。据报道[7],MI时SIRT3表达水平会显著降低。动物模型中SIRT3基因敲除会增加缺血引起的梗死面积,加重缺血再灌注引起的心肌损伤[8]。SIRT3下调也扰乱了正常心脏功能。SIRT3已经被证明能去乙酰化并激活主要的超氧化物自由基清除剂(Manganese superoxide dismutase,SOD2),从而减少活性氧的产生和对氧化应激诱导的细胞损伤的保护反应[9]。除此之外,一些研究还关注SIRT3表达对细胞凋亡的影响,虽然具体机制存在争议,但是SIRT3显然是心肌细胞凋亡的有效抑制剂。HK是使用非常广泛的SIRT3激活剂之一,能够增加SIRT3表达和去乙酰化活性,预防心脏病[10]。因此,本研究探究HK对缺氧心肌细胞的保护作用及机制。
1 材料与方法
1.1 实验动物 出生1~2 d的SD大鼠仔鼠60只,不分雌雄,体重5~7 g,购买于空军军医大学实验动物中心。本研究经西安国际医学中心动物福利伦理委员会审核并批准。
1.2 主要试剂 HK(货号:H111271)购自上海阿拉丁生化科技公司;CCK-8试剂盒(货号:C008-3)购自上海七海复泰生物科技有限公司;乳酸脱氢酶(LDH)检测试剂盒(货号:A020-2-2)购自南京建成生物工程研究所;TUNEL试剂盒(货号:11684795910)购自美国Roche公司;胶原酶Ⅰ和DAPI购自美国Sigma公司;胎牛血清和F12培养基购买自赛默飞世尔科技(中国)有限公司;SIRT3短发夹RNA(ShRNA,597位点)慢病毒及其对照病毒Scramble购自上海基因制药有限公司;Bax(货号:50599-2-Ig)、Bcl-2(货号:26593-1-AP)、GAPDH(货号:60004-1-Ig)、SOD2(货号:24127-1-AP)、SIRT3(货号:10099-1-AP)购自武汉三鹰生物技术有限公司;Ac-SOD2(货号:ab137037)购买自美国Abcam公司。
1.3 实验方法
1.3.1 乳鼠原代心肌细胞提取及培养:取新生SD大鼠仔鼠心脏,切成小块。将碎片组织在含有1%胶原酶Ⅰ的磷酸盐缓冲盐水(PBS)溶液中消化。以每毫升5×105个细胞的密度接种,培养基为含10%胎牛血清、0.1 mmol/L溴脱氧尿苷(BrdU)、青霉素(100 U/ml)和链霉素(100 U/ml)的DME/F-12培养基,CO2含量5%,37 ℃培养48 h后开始使用。
1.3.2 模型建立及分组:用Hanks平衡盐溶液代替正常培养基,并将心肌细胞置于Napco中8000 WJ缺氧培养箱(5% CO2和95% N2)中8 h。HK处理组在缺氧的同时加入HK,最终浓度为10 μmol/L。在HK对心肌细胞保护作用实验中,原代心肌细胞分为Nor+DMSO组(常氧组)、Nor+HK组(对照+HK组)、Hypo+DMSO组(缺氧组)以及Hypo+HK组(缺氧+HK组)。在验证SIRT3是HK保护缺氧心肌细胞关键信号分子的实验中,原代心肌细胞分为Hypo+Scramble+DMSO组(缺氧+对照病毒组)、Hypo+Scramble+HK组(缺氧+对照病毒+HK组)、Hypo+ShRNA+DMSO组(缺氧+SIRT3干扰慢病毒组)以及Hypo+ShRNA+HK组(缺氧+SIRT3干扰慢病毒+HK组)。
1.3.3 细胞活力检测:将细胞与5 mg/ml CCK-8在CO2培养箱中培养1 h。去掉培养基后在460 nm波长和630 nm参考波长下,通过酶标仪测量每个孔的吸光度。光密度(OD)作为细胞存活率的指标。
1.3.4 TUNEL染色:心肌细胞培养和处理后弃去原有培养基,PBS清洗后用4%多聚甲醛固定,按照试剂盒说明书进行TUNEL染色,使用Image J软件计算凋亡细胞百分比。
1.3.5 慢病毒转染:在含有5 μg/ml聚凝胺的培养基中,用SIRT3 ShRNA慢病毒或阴性对照以100倍感染率转染原代心肌细胞。慢病毒携带绿色荧光蛋白(GFP)编码基因,倒置显微镜下观察呈现绿色的细胞,确认感染效率。
1.3.6 蛋白质免疫印记:心肌细胞用经过37 °C水浴的PBS漂洗后,加入RIPA裂解液,将细胞刮下并裂解,离心后得到蛋白样品。蛋白样品浓度用BCA法进行检测定量。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离、提取和定量蛋白质并将其转移到PVDF上。用含5%脱脂奶粉和0.1%吐温-20的封闭液室温下封闭PVDF膜2 h。随后将PVDF膜与适当的一抗抗体在4 °C下孵育过夜。室温条件下用相应的辣根过氧化物酶结合二抗孵育PVDF膜。添加增强化学发光(ECL)试剂,用Chemi DocTMXRS进行成像,使用与成像仪配套的Image Lab 5.0软件对蛋白条带进行相对定量分析。

2 结 果
2.1 各组心肌细胞活力及LDH释放比较 见图1。缺氧后心肌细胞活力下降了37.46%,给予HK后缺氧心肌细胞活力升高(均P<0.01)。缺氧处理后,心肌细胞LDH释放由(12.02±2.34)%上升至(42.35±2.89)%,但给予HK之后LDH释放量下降至(28.45±3.12)%。
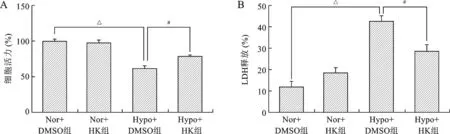
注:与Hypo+DMSO组比较,#P<0.01,△P<0.001
2.2 各组心肌细胞凋亡率比较 见图2。缺氧后心肌细胞凋亡率增加,经过HK处理后心肌细胞凋亡率从(37.88±2.94)%下降到(20.51±3.87)%(均P<0.05)。

注:A图为各组心肌细胞TUNEL染色结果(×40);B图中,与Hypo+DMSO组比较,*P<0.05,△P<0.001
2.3 各组心肌细胞凋亡分子表达比较 见图3。缺氧处理后,心肌细胞Caspase-3活性提高了2.57倍,而HK处理后缺氧心肌细胞Caspase-3活性下降了26.96%(均P<0.05)。同样,缺氧后Bcl-2/Bax比值下降了65.98%,而HK处理使得该比值上升了1.05倍(均P<0.05)。缺氧后Ac-SOD2/ SOD2比值升高了86.32%,而HK处理使得该比值下降了26.33%(均P<0.05)。SIRT3在缺氧后表达量下降,而HK使得SIRT3表达量升高了1.73倍(均P<0.05)。
2.4 SIRT3分子干扰后各组心肌细胞活力比较 见图4。SIRT3分子被干扰后,HK处理后的缺氧心肌细胞活力与未处理的缺氧心肌细胞活力比较差异无统计学意义[(94.01±2.51)%与(98.36±3.76)%,P>0.05]。SIRT3分子被干扰后,HK处理后的缺氧心肌细胞活力与未处理的缺氧LDH释放比较差异无统计学意义[(48.57±6.07)%与(52.37±5.55)%,P>0.05]。
2.5 SIRT3分子干扰后各组心肌细胞凋亡率比较 见图5。SIRT3分子干扰后,缺氧后心肌细胞凋亡率为(50.35±3.96)%,HK处理后心肌细胞凋亡率为(46.84±2.97)%,但两者比较差异无统计学意义(P>0.05)。
2.6 SIRT3分子干扰后各组心肌细胞凋亡分子表达比较 见图6。SIRT3分子干扰后,经过HK处理的缺氧心肌细胞中Caspase-3活性与未处理的缺氧心肌细胞中Caspase-3活性比较差异无统计学意义(P>0.05)。同样,HK处理也不能改变缺氧心肌细胞中Bcl-2/Bax比值(P>0.05)。SIRT3分子干扰后缺氧心肌细胞中Ac-SOD2/SOD2相对比值为1.150±0.089,而HK处理后该相对比值为0.987±0.075,两者比较差异无统计学意义(P>0.05)。

注:与Hypo+DMSO组比较,*P<0.05,#P<0.01,△P<0.001

注:与Hypo+Scramble+DMSO组比较,*P<0.05,△P<0.001,ns表示差异无统计学意义
3 讨 论
广玉兰植物属于木兰属,在我国、日本和亚洲其他地区被用作中药。HK提取自广玉兰植物,是一种多效木脂素,具有辛辣和芳香气味。HK具有广泛的治疗作用,如抗抑郁、抗菌、抗肿瘤、抗血栓、抗痉挛和神经保护等作用。HK已被证实对神经退行性疾病、糖尿病、心血管疾病和癌症等氧化应激和炎症所致疾病有效[3]。心血管疾病方面,已经有研究报道,HK能够减少氧化应激减轻1型糖尿病心肌缺血再灌注损伤;通过增强自噬流和减少胞内活性氧产生改善心肌缺血/再灌注损伤[10-11]。此外,研究还表明HK通过降低氧化压力改善美洲锥虫病引起的心功能紊乱;改善糖尿病小鼠线粒体底物利用和细胞脂肪酸代谢;通过抑制组蛋白脱乙酰基酶6(HDAC6)介导的胱硫氨酸γ-裂解酶降解,改善血管紧张素Ⅱ诱导的高血压和内皮功能障碍;通过激活线粒体SIRT3阻止和逆转压力超负荷引起的心肌肥厚;通过SIRT3保护线粒体,从而保护小鼠心脏免受阿霉素诱导的心肌病[12-16]。

注:A图为各组心肌细胞TUNEL染色结果(×40);B图中,与Hypo+Scramble+DMSO组比较,#P<0.01,ns表示差异无统计学意义

注:与Hypo+Scramble+DMSO组比较,*P<0.05,△P<0.001,ns表示差异无统计学意义
尽管目前HK在心血管疾病方面已经有了诸多报道,但是目前尚未有关于HK对缺氧心肌细胞保护的报道。本研究证实,HK具有抗心肌细胞缺氧损伤的作用:给予HK后,缺氧原代心肌细胞的细胞活力升高,LDH释放增加,细胞凋亡率下降,Caspase-3活性降低,Bcl-2/Bax比值上升。进一步的研究表明,HK降低了SOD2的乙酰化水平,提高了SIRT3的表达水平。
Sirtuins是烟酰胺腺嘌呤二核苷酸(NAD+)依赖的Ⅲ类组蛋白脱乙酰酶家族[17]。Sirtuins家族在哺乳动物中存在7个成员,也就是SIRT1至SIRT7。这些Sirtuins分布在不同的亚细胞位置,即细胞质(SIRT1/2)、线粒体(SIRT3/4/5)和细胞核(SIRT1/2/6/7)[18]。Sirtuins调节许多细胞过程,包括昼夜节律、代谢、基因转录、细胞周期和凋亡[19-20]。越来越多的证据表明,SIRT3在心血管疾病的发展中起着关键作用[21-23]。在人类和小鼠中,SIRT3在肾脏、心脏、大脑、棕色脂肪组织和肝脏等高度代谢的组织和器官中高度表达[24]。SIRT3具有多种酶活性,包括脱乙酰基酶、腺苷二磷酸核糖基酶、五二糖和去琥珀酸基酶[24]。SIRT3活性的多样性反映在其参与调节各种生物过程,包括ATP生成、分解代谢和活性氧解毒[25]。此外,研究[26]表明,SIRT3在调节细胞死亡、血管生成、自噬和代谢稳态中发挥重要作用。SIRT3与许多严重疾病有关,包括肝细胞癌、糖尿病和特发性肺纤维化[27-28]。HK是从木兰树皮中提取的天然木脂素,是使用最广泛的SIRT3激活剂之一。HK增加SIRT3表达和去乙酰化活性,预防心脏病[10]。许多其他天然产物(如虎杖苷、白藜芦醇和大黄素)已被证明能够正向调节SIRT3的表达和活性。此外,褪黑素对心脏病的保护作用归因于其激活SIRT3的能力,镉降低了SIRT3蛋白的表达和活性,褪黑素则逆转了镉介导的SIRT3活性下降,但是不影响SIRT3的表达。本研究发现,HK能够提高缺氧心肌细胞的活力,减轻心肌细胞的损伤;减少缺氧后心肌细胞的凋亡;抑制缺氧心肌细胞凋亡相关分子的表达。而心肌细胞中SIRT3分子被干扰后,缺氧组与治疗组之间的心肌细胞活力、心肌细胞损伤、心肌细胞凋亡和胞内凋亡相关分子的表达比较差异均无统计学意义,这表明HK是通过SIRT3信号通路发挥对缺氧心肌细胞的保护作用。
综上所述,厚朴酚通过SIRT3发挥抗心肌细胞缺氧损伤作用:给予HK后,缺氧原代心肌细胞活力升高,LDH释放增加,细胞凋亡率下降,Caspase-3活性下降,Bcl-2/Bax比值上升;慢病毒干扰SIRT3表达以后,再给予HK与未给予HK相比,在细胞活力、LDH释放、凋亡率、Caspase-3活性、Bcl-2/Bax比值及SOD2乙酰化水平等方面比较差异均无统计学意义。本研究发现了HK潜在的应用价值,可能为临床治疗MI及保护梗死后心脏提供了潜在的新药物,但是实现临床转化还需要开展更多的动物、临床及机制研究。
