10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷的合成研究*
2022-06-10吴绵园李淑辉白雪峰吕宏飞
吴绵园,徐 虹,杨 杰,李淑辉,白雪峰, 吕宏飞
(黑龙江省科学院 石油化学研究院,黑龙江 哈尔滨 150040)
引 言
近年来,继有机荧光材料和有机磷光材料之后的第三代有机发光材料——热活化延迟荧光材料(Thermally activated delayed fluorescence, TADF)取得了快速的发展[1~3]。该类材料一般具有较小的单线态—三线态能级差,在环境热等条件下,三线态激子可以通过反系间穿越转变为单线态激子,进而辐射发光。与传统的荧光和磷光材料相比,TADF 材料可以充分利用电激发下形成的单线态激子和三线态激子,器件的内量子效率可以达到100%,并且还具有更高的发光效率[4~6]。大部分TADF 分子是给体和受体单元以一定方式连接在一起而形成的纯有机推拉电子体系,分子结构简单,基团选择范围广[7,8]。
含硅杂环有机给体单元在TADF 材料的研发过程中备受瞩目。这是由于硅原子引入到有机光电材料可以显著改变化合物的电子结构和状态,使得化合物具有较低的LUMO 能级;另一方面,含硅杂环化合物具有较多的修饰位点、较好的溶解性和成膜性,合成上不需要苛刻的反应条件,将它与受体单元组合,可以保留各自的优点,得到具有较好性能的TADF 材料[9~12]。其中以10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷为给体单元构筑的TADF材料,在应用上取得了较高的器件性能,具有一定的商业化应用前景[13,14]。因此,对给体单元10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷的合成研究具有重要意义。
本文以2-溴苯胺和1-溴-2-碘苯为原料,通过Buchwald-Hartwig 偶联、氨基保护、有机锂试剂脱卤素关环和氨基保护基的脱除,最终合成给体单元10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷(4),合成路线如图1 所示。
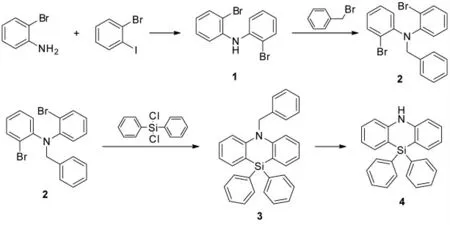
图1 10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷的合成路线Fig.1 The synthesis route for 10,10-diphenyl-5,10-dihydrodibenzo[1,4]azasiline
1 实验部分
1.1 主要原料与试剂
1-溴-2-碘苯,99%,北京偶合科技有限公司;2-溴苯胺,98%,南京盈丰生物技术有限公司;二苯基二氯硅烷,98%,阿拉丁试剂(上海)有限公司;四丁基溴化铵,99%,天津市科密欧化学试剂有限公司;正丁基锂正己烷溶液,2.5M,上虞华伦化工有限公司;三(二亚苄基丙酮)二钯(Pd2DBA3)、Pearlman’s 催化剂(20%Pd(OH)2/C)、10%钯碳催化剂,浙江省冶金研究院有限公司;1,1’-双(二苯基膦)二茂铁(DPPF)、10%三叔丁基膦甲苯溶液、4,5-双(二苯基膦)-9,9-二甲基氧杂蒽(XantPhos)、2-(二叔丁基膦)联苯(JohnPhos)、1,1’-联萘-2,2’-双二苯膦(BINAP),北京偶合科技有限公司;叔丁醇钠、叔丁醇钾、甲醇钠、硝酸铈铵(CAN)、2,3-二氯-5,6-二氰对苯醌(DDQ)、苄基溴、4-甲氧基溴苄、2,4-二甲氧基溴苄、三苯基甲基溴,萨恩化学技术(上海)有限公司;甲苯、四氢呋喃、乙醇、乙醚、二氯甲烷、三氯甲烷等试剂均来自国药集团化学试剂有限公司。甲苯、乙醚和四氢呋喃在使用前经金属钠处理后蒸馏。
1.2 仪器与设备
微型高压反应釜:SLM-50,北京世纪森朗实验仪器有限公司;液相色谱仪:Waters E2695,美国沃特世公司;核磁共振仪:Avance 300,德国布鲁克公司。
1.3 合成步骤
1.3.1 双(2-溴苯基)胺(1)的制备
氮气气氛下,250mL 三口瓶中加入2- 溴苯胺(8.60g,50.0mmol)、1-溴-2-碘苯(15.56g,55.0mmol)、叔丁醇钠(7.21g,75.0mmol)、Pd2DBA3(0.27g,0.25mmol)、DPPF(0.64g,1.0mmol)和甲苯100mL,升温至回流反应。HPLC 监控反应进程,反应10h 时,2-溴苯胺完全反应。反应液冷却至室温后,加入10%(wt)氯化铵水溶液50mL,分除水层。水层用甲苯萃取,合并有机层,无水硫酸镁干燥,过滤,减压浓缩得红棕色油状物。以正己烷为洗脱剂,通过柱层析法分离纯化,得白色固体15.13g,收率92.5%。1H NMR(300MHz,CDCl3):δ(ppm)7.44(dd,J=8.0,1.4Hz,2H),7.16(dd,J=8.2,1.6Hz,2H),7.11-7.00(m,2H),6.74-6.61(m,2H),6.42(s,1H)。
1.3.2 N,N-双(2-溴苯基)苄胺(2)的制备
氮气气氛下,250mL 三口瓶中加入1(9.81g,30.0mmol)、氢氧化钾(3.70g, 66.0mmol)、四丁基溴化铵(0.97g,3.0mmol)和四氢呋喃60mL,保持30℃,搅拌4h,反应液呈浅黄色糊状。苄基溴(6.16g,36.0mmol)溶于30mL 四氢呋喃中,缓慢滴加至反应体系,加入完毕后,升温至回流反应。HPLC 监控反应进程,反应4h 时,原料完全反应。减压脱除四氢呋喃,残余物用三氯甲烷溶解,水洗,饱和氯化钠水溶液洗涤,无水硫酸镁干燥,过滤,脱除溶剂得粉红色固体。混合溶剂(V三氯甲烷∶V正己烷=1∶3)溶解后,冷却至-20℃结晶,得白色固体10.89g,收率87.0%。1HNMR(300MHz,DMSO):δ(ppm)7.61(dd,J=7.9,1.4Hz,2H),7.53(d,J=7.2Hz,2H),7.26(t,J=7.1Hz,4H),7.15(dd,J=8.3,6.3 Hz,1H),7.09-6.93(m,4H),4.79(s,2H)。
1.3.3 N- 苄基-10,10- 二苯基-5,10- 二氢二苯并[1,4]氮硅杂环己烷(3)的制备
在氮气气氛下,250mL 三口瓶中加入(2)(8.34g,20.0mmol)和乙醚100mL,降温至-10℃,体系呈白色悬浊液。保持-10℃,滴加2.5M n-BuLi 正己烷溶液(18.4mL,46.0mmol),滴加时间0.5h,滴加完毕后,保温1.0h。体系状态由白色悬浊液经桔黄色清液,最终变为黄色黏稠液。将二苯基二氯硅烷(5.82g,23.0mmol)溶于30mL 乙醚中,保持-10℃,滴加至反应体系,滴加时间1.0h,加入完毕后,保温1.0h,而后缓慢升至室温,搅拌过夜,HPLC 监测原料完全反应。体系状态有黄色黏稠液变为白色悬浊液。减压脱除乙醚,残余物用二氯甲烷溶解,水洗,饱和氯化钠水溶液洗涤,无水硫酸镁干燥,过滤,脱除溶剂得粗品。混合溶剂(V四氢呋喃∶V乙醇=1∶3)溶解后,冷却至0℃结晶,得白色固体6.86g,收率78.0%。1H NMR(300MHz,CDCl3):δ(ppm)7.58-7.55(m,4H),7.53-7.50(m,2H),7.41-7.35(m,5H),7.33-7.25(m, 6H),7.23-7.20(m,2H),7.00-6.95(m,4H),5.21(s,2H)。
1.3.4 10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷(4)的制备
在氢气气氛下,50mL 微型高压反应釜加入(3)(4.40g,10.0mmol)、Pearlman’s 催 化 剂(0.44g,10%(w/w))、二氯甲烷30mL 和无水乙醇30mL,保持氢气压力0.50MPa,升温至30℃反应。HPLC 监控反应进程,反应10h 时,原料完全反应。滤除Pearlman’s 催化剂后,减压脱除溶剂得粗品。乙醇重结晶得白色固体2.68g,收率76.6%。1H NMR(300MHz,DMSO):δ(ppm)9.44(s,1H),7.50-7.43(m,6H),7.42-7.32(m,8H), 7.10(d, J=8.0Hz, 2H), 6.88(td, J=7.3, 0.9Hz,2H);13C NMR(75MHz,DMSO):δ(ppm)146.96,135.70,135.30,130.78,129.42,128.01,119.10,115.76,111.58。
2 结果与讨论
2.1 Buchwald-Hartwig 偶联反应
2.1.1 催化体系的选择
在Buchwald-Hartwig 偶联反应中,最核心的部分就是钯催化剂和配体组成的催化体系。合适的催化体系可以有效降低偶联反应过程中的活化能,提高反应速率;另外,可以有效抑制副反应的发生,提高反应的选择性。
Buchwald-Hartwig 偶联反应中,二价钯不能直接催化卤代芳烃和胺的偶联,需在还原剂作用下使二价钯转化为零价钯,然后零价钯还原卤代芳烃发生偶合反应。因此,在偶联反应中多采用零价钯催化剂,其中Pd2DBA3的效果最好。配体对偶联反应有着重要作用,适量添加配体可以有效提高反应活性;当没有配体时,有些反应根本无法进行或反应收率低。目前用于C-N 偶联反应的配体主要有P(t-Bu)3、XantPhos、JohnPhos、BINAP、DPPF 等。本文考察了不同催化体系对偶联反应的影响。

表1 催化体系对Buchwald-Hartwig 偶联反应的影响Table 1 The effect of catalytic system on the Buchwald-Hartwig coupling reaction
由表1 可知,在其他影响因素相同的条件下,不同催化体系对Buchwald-Hartwig 偶联反应的转化率、选择性具有较大影响;选择Pd2DBA3/DPPF 为催化体系时,反应选择性好,转化率高,收率可达92.5%。
2.1.2 碱对反应的影响
碱的参与是脱质子历程顺利进行的必要条件,是影响催化反应的重要因素之一。碱不仅影响反应速率,控制其形状和大小,还能有效改善反应效果。在Buchwald-Hartwig 偶联反应中,常用的碱为叔丁醇钠、叔丁醇钾、甲醇钠、氢氧化钾等。
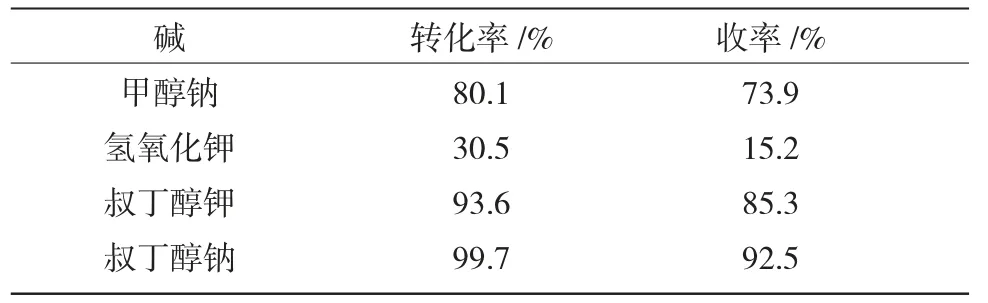
表2 碱对Buchwald-Hartwig 偶联反应的影响Table 2 The effect of base on the Buchwald-Hartwig coupling reaction
由表2 可知,在其他影响因素相同的条件下,碱的选择对反应的收率影响很大,叔丁醇钠反应效果最好,主要是由于碱性的强弱和溶解性的差异对反应产生影响。叔丁醇钠和叔丁醇钾的碱性和溶解性无明显差异,但是其形状和大小有些差异,对反应有所影响;甲醇钠的碱性较弱,反应效果不好;无机碱氢氧化钾效果更差,这可能是由于无机碱溶解性较差导致的。
2.2 氨基保护
根据本文所采用的10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷(4)合成路线,双(2-溴苯基)胺(1)在后续反应过程中,使用有机锂试剂拔出芳香环上的溴原子,仲胺基团在所设定的反应条件下不稳定,需对氨基进行保护。虽然,氨基保护剂有烷氧羰基保护、酰基保护、烷基保护等多种类型,但是在有机锂试剂的存在下,只有烷基类保护基团可以保持稳定,因此在反应过程中采用烷基类保护基。
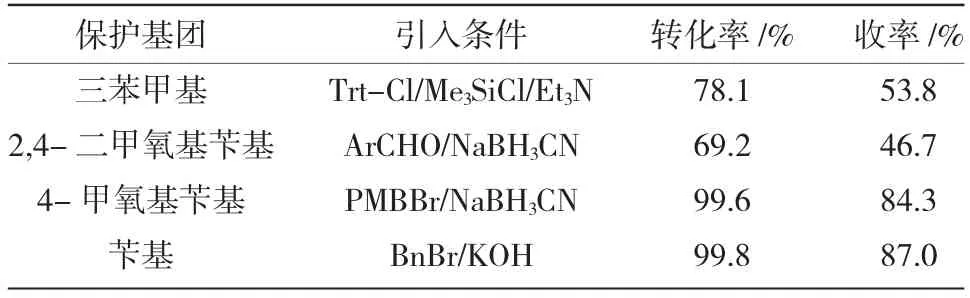
表3 不同保护基团对氨基保护的影响Table 3 The influence of different protecting groups on the amino protection
在引入条件、选择性、收率、生产成本等因素同下,综合对比三苯甲基、2,4-二甲氧基苄基、4-甲氧基苄基、苄基等烷基保护基本文在合成过程中选择使用苄基保护氨基。
2.3 氮硅杂环己烷的合成
N,N-双(2-溴苯基)苄胺(2)与正丁基锂中的锂发生交换反应,生成相应的有机锂化合物,再与二苯基二氯硅烷关环,生成N-苄基-10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷(3)。令人意外的是,整个反应过程在乙醚、四氢呋喃中得到明显不同的反应结果。

表4 溶剂对硅杂吖啶环合成反应的影响Table 4 The effect of solvent on the synthesis of phenazasiline
由表4 可知,在其他影响因素相同的条件下,不同溶剂的反应转化率基本相同,但反应收率具有较大差异。这可能是由于正丁基锂的反应活性不同所导致的。在有机锂化合物中,由于锂原子的原子半径小,碳锂键具有较强的极化作用,导致有机锂化合物易缔合,在溶液中一般以多分子的聚集体形式存在。在乙醚溶剂中,正丁基锂以四聚体的形式存在,反应活性较弱;四氢呋喃溶剂中,正丁基锂以二聚体的形式存在,反应活性较强。由于四氢呋喃溶剂中的正丁基锂反应活性较强,并且N,N-双(2-溴苯基)苄胺(2)具有邻位导向基团(二芳胺基团),可以发生邻位金属化反应,生成多种邻位金属化副产物,从而导致目标产物收率较低;而乙醚溶剂中,正丁基锂活性较弱,不能发生邻位金属化反应,反应选择性好,收率高。
2.4 氨基脱保护
苄基作为有机胺的常用保护基团,在有机合成工作中具有广泛应用。因此,对于N-苄基脱保护工艺研究比较成熟,主要包括催化氢解、催化氢转移氢解、氧化脱苄、酸解脱苄等方法。
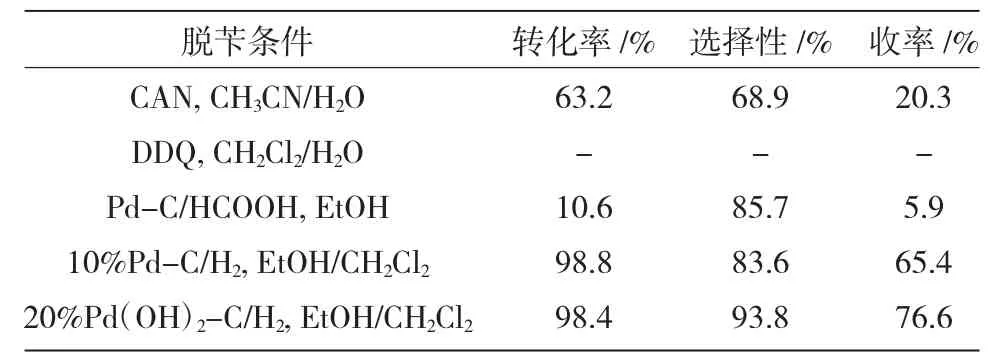
表5 不同脱苄条件对氨基脱保护的影响Table 5 The influence of debenzylation conditions on the amino deprotection
由表5 可知,N- 苄基-10,10- 二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷(3)在不同的脱苄工艺条件下,原料转化率、反应选择性具有较大差异。当采用Pearlman’s 催化剂(20%Pd(OH)2/C)催化氢解脱除苄基时,原料转化率高、反应选择性好,以较高收率制备10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷(4)。
3 结 论
以2-溴苯胺和1-溴-2-碘苯为原料,经过Buchwald-Hartwig 偶联、氨基保护、有机锂试剂脱卤素关环和氨基保护基的脱除反应,合成了10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷(4)。另外,考察了反应过程中的影响因素,确定了较佳的工艺条件,使得合成总收率达48.1%。本文设计的合成工艺路线简单易行,反应条件温和,产品收率高、纯度好,为10,10-二苯基-5,10-二氢二苯并[1,4]氮硅杂环己烷(4)的工业化生产奠定了基础。
