珠江口沉积物有机质特征、来源及其对碳存储的意义
2022-06-10商博文吴云超江志坚刘松林黄小平
商博文, 吴云超 , 江志坚, 刘松林, 黄小平
1. 中国科学院热带海洋生物资源与生态重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301;
2. 南方海洋科学与工程广东省实验室(广州), 广东 广州 510348;
3. 中国科学院大学, 北京 100049
河口作为连接河流、陆地与海洋之间的重要生态系统(Gu et al, 2017), 每年可向海洋输送(3.6~8)×108t 有机碳(organic carbon, OC)(Bauer et al,2011), 被认为是全球碳循环和碳收支的重要组成部分(Wang et al, 2015; Zhao et al, 2021)。沉积物是有机质赋存的主要形式, 全球河口—陆架沉积物中存储的有机碳约占海洋沉积环境的 90%(Hedges et al,1995; Hutchings et al, 2020)。因此, 河口是有机质存储的重要区域, 影响着区域初级生产力和全球生物地球化学循环(Zhang et al, 2009; Blair et al, 2012;Moyer et al, 2013; Lian et al, 2018)。不同来源的有机质的化学性质存在差异, 其在河口的迁移转化过程也不同(Raymond et al, 2001; 刘广州 等, 2020;Zhou et al, 2021), 河口盐度、沉积物粒径等环境因素也会影响有机质的迁移转化过程(王华新 等,2011)。研究河口沉积有机质(sediment organic matter,SOM)来源、分布及其影响因素, 对认知其生物地球化学循环过程至关重要。
近年来, 国内外学者对河口SOM 特征、来源及其影响因素开展了一系列研究, Ogawa 等(2021)发现菲律宾Batan 湾河口SOM 主要来源于植物碎屑、底栖生物和浮游植物; Gireeshkumar 等(2013)发现印度Cochin 河口SOM 主要来源于陆源输入, 底栖生物对SOM 的贡献很小; Zhang 等(2020)运用稳定同位素示踪技术研究了长江口表层SOM 来源, 陆源输入是长江口表层SOM 的主要来源, 且河流冲淡水是影响其空间分布的主要因素。Chen 等(2017)运用三维荧光光谱技术研究沉积物可溶性有机质(sediment dissolved organic matter, SDOM), 发现从淡水到入海口沉积物荧光指数(fluorescence index,FI)和自生源指数(biological index, BIX)会随之升高,荧光溶解性有机质随之降低; Li 等(2020)研究了大沽河口SDOM 的组分特征, 发现河流下游的SDOM的腐殖化程度高于河口, 说明陆海不同来源有机质会引起SDOM 组分差异; 程远月 等(2008)研究了厦门湾沉积物间隙水溶解性有机物的荧光特性, 在表层沉积物中观测到类腐殖质和类色氨酸两类荧光,其相对含量和分布受河口区红树林生态系统、水产养殖以及人工疏浚等因素影响。然而, 以上研究均未在SDOM 组分特征的基础上对有机碳可存储性做进一步分析研究。此外, 有机质进入沉积物之后, 其降解转化受诸多因素的影响, 如粒径、沉积物氧化还原电位(Eh)、氧化态铁等(Lalonde et al, 2012; 韩永强 等, 2020; Wu et al, 2020)。有机质含量与粒径存在显著相关性, 粒径越小对有机质的富集能力越强(Yao et al, 2015); 吴金浩 等(2012)报道SOM 含量与Eh 呈负相关, 沉积有机质含量越高, 还原细菌数越多, 高价化合物被细菌还原, 导致沉积物Eh 越低,还原性越强; 但目前氧化态铁对有机质的影响还存在争议, 如Lalonde 等(2012)报道海洋沉积物中20%以上的有机碳是通过与氧化态铁结合的方式存储于沉积物中; Shields 等(2016)运用Muiti-G 模型发现在河口三角洲沉积物中氧化态铁与有机碳结合能有效促进有机碳的存储; 而Chen 等(2020)研究认为铁可以介导有机碳的分解, 并不能从本质上保护有机碳。因此, 氧化态铁对有机质保存能力如何?进而对其存储的影响还需进一步探究。
本研究选取珠江口作为研究对象, 通过测定总有机碳(total organic carbon, TOC)含量、总氮(total nitrogen, TN)含量和沉积物可溶性有机质三维荧光光谱(excitation emission matrix spectroscopy,EEMs)等参数, 研究珠江口沉积有机质在不同区域的分布特征和关键影响因素; 利用碳稳定同位素(δ13C)指标, 估算各区域不同来源有机质的贡献比。在此基础上, 结合SDOM 荧光特性探讨各区域有机碳存储性特征, 可为认知河口沉积物碳循环过程提供基础资料, 并为该区域的生态环境保护提供依据。
1 材料与方法
1.1 样品采集及预处理
于2020 年8 月和2021 年1 月对珠江口进行取样, 共布置20 个站位(图1), 并根据Ogawa 等(2021)对河口聚类分区的方法, 将研究区域划分为口内区(S1、S2、S3、S6)、混合区(S4、S5、S7、S8、S9、S10、S11、S12)和口外区(S13、S14、S15、S16、S17、S18、S19、S20)。使用箱式重力采泥器采集表层沉积物样品(0~5cm)(2020 年8 月末在S1 站位获取样品), 使用塑料药匙, 在沉积物表层中心区域采集样品, 在采样过程中样品避免与箱式重力采样器或金属材质物品接触, 采样完后将样品迅速装入聚乙烯密封袋中, 防止沾污样品, 并置于-20℃条件下保存。将获取的沉积物样品带回实验室立即进行处理和分析。
1.2 分析方法
1.2.1 环境参数
使用氧化还原测定仪(Mettler-Toledo Eh meter)现场测定沉积物Eh; 使用温盐深仪(RBRconcento3)现场测定底层海水盐度(Sal); 采用溶解氧(dissolved oxygen, DO)探头(SBE-43)测定底层水DO; 沉积物Fe2+和Fe3+采用邻菲罗啉比色法进行测定(Yin et al, 2017); 沉积物粒径(Mz)采用Mastersizer 2000 型激光粒度分析仪测试。
1.2.2 TOC 和TN 测定
将沉积物样品置于冷冻干燥机(Coolsafe 55-4)中干燥至恒重, 挑出杂质, 使用研磨仪(旭鑫科技ST-B200)研磨至均质, 后过100 目筛。取少量过筛样品用0.5mol·L-1HCl 进行酸化, 并置于酸缸熏蒸24h 以确保去除样品中的无机碳。熏蒸完毕后, 用超纯水洗涤样品至中性, 置于60℃烘箱干燥至恒重。沉积物TOC 和TN 含量采用元素分析仪(Flash EA 3000 Thermo Scientific, Milan Italy)进行测定, 测定前使用国家标准物质(GBW07360(GSD-17)), 作为参照标准, 制作标准曲线, 并且在测试过程中每10个测试样品添加一个标样, 以确保样品结果准确(TOC 和TN 的分析误差分别为±0.02%和±0.005%)。
1.2.3δ13C 同位素分析
沉积物δ13C 样品前处理过程同1.2.2。称取25mg酸化后的沉积物样品, 使用锡舟包裹好, 用同位素比质谱仪(Delta V Advantage, Thermo Fisher Scientific, MA, USA)进行测定, 以标准物质(B2155-114859,δ13C = -26.98‰)为参照标准, 样品测量误差均小于0.15 ‰。其δ13C 数值计算如下公式所示:
式中,Rsample代表样品实测13C/12C 值;Rstandard代表标准样品13C/12C 值。
1.2.4 沉积物可溶性有机质EEMs 分析
沉积物可溶性有机质提取步骤如下: 取5g 冷冻干燥后的沉积物样品于离心管中(取样回来后立即开展实验), 按水土比10:1 加入Milli-Q 超纯水, 超声振动30min, 然后置于摇床以转速200r·min-1振动24h, 最后以3000r·min-1离心10min。取上清液过0.7μm 玻璃纤维滤膜(Whatman GF/F), 所获滤液用于后续光谱分析。沉积物可溶性有机质EEMs 采用三维荧光分光光度计(Hitachi F-4700)进行测定, 荧光光谱设定参数如下: 积分时间设置为1s, 扫描波长范围为λEx(240~450nm),λEm(250~500nm); Ex 步长为1nm, Em 步长为1nm, 扫描速度为12000nm·min-1,样品测试前以Milli-Q 超纯水作为空白对照, 样品光谱信号减空白对照样品光谱信号后, 将所得光谱信号结果进行水拉曼归一化处理后(Murphy et al,2010), 参考郭卫东 等(2018)计算内过滤影响, 根据紫外254nm 的吸光值, 小于0.3 时, 可以不考虑内过滤效应的影响; 大于0.3 时进行稀释后测定EEMs。并在计算荧光强度时, 对校正后的EEMs 乘以对应稀释倍数。SDOM 组分(类蛋白质(B 和T 峰)和类腐殖质(A、C 和M 峰)和荧光指数, 包括有机质荧光指数(FI)、新鲜度指数(β:α)、生物源指数(BIX)和腐殖化指数(humic index, HIX)等, 计算分析参考Coble(2007)。
1.3 统计分析
使用OriginPro 2018C、Canoco 5、Surfer 13 和Excel 2018 软件进行数据处理和图形绘制, 采用IBM SPSS Statistic 23 统计软件进行显著性差异性检验, 显著性水平P= 0.05; SDOM 组分区域积分和荧光指数用drEEM 0.6.0 工具箱经Matlab2020a 处理得出; 利用MixSIAR 稳定同位素混合模型估算沉积有机质贡献率。
2 结果与分析
2.1 沉积有机质分布特征
2.1.1 沉积物TOC、TN 含量和环境参数变化
珠江口沉积物主要环境因素的冬夏季结果如表1 所示。底层水盐度变化范围为8.7‰~34.4‰, 口内区平均值为(17.6±6.0)‰, 混合区平均值为(27.3±5.3)‰, 口外区平均值为(33.5±0.8)‰, 由于未检测夏季S1 站位盐度, 故表1 中口内区底层水盐度值偏高。口内区至口外区沉积物Eh 平均值分别为-181±44、-165±29 和-143±27mV, 呈递增趋势。珠江口沉积物组成以粉砂和黏土为主, 沉积物平均粒径为6.5±0.8μm, 口内区平均值为7.2±0.3μm, 混合区平均值为 6.7±0.5μm, 口外区平均值为 5.9 ±0.7μm。
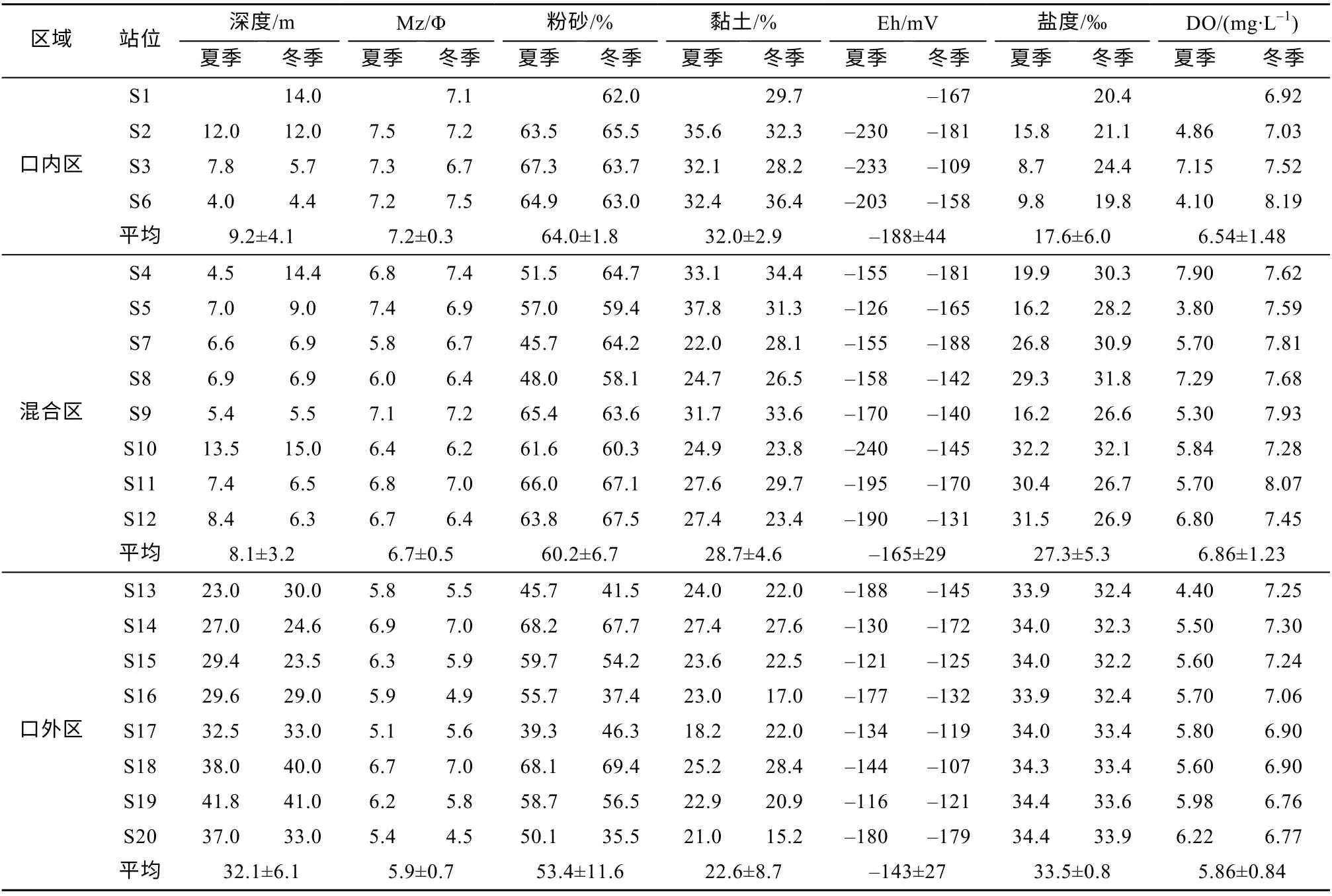
表1 珠江口沉积物和底层水的环境参数Tab. 1 Environmental parameters of sediment and bottom water in the PRE
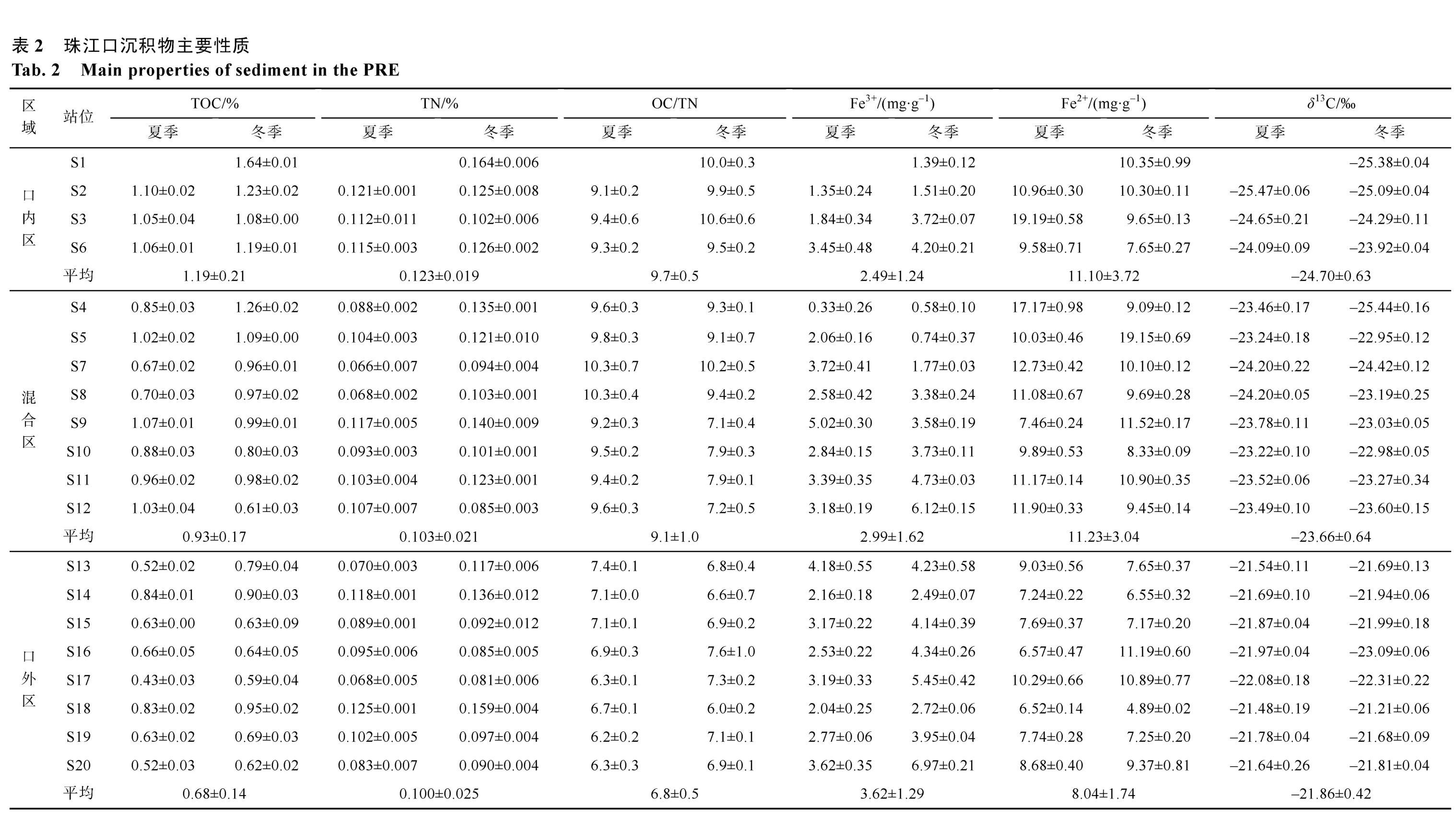
沉积有机质主要化学参数如表2 所示。TOC 含量变化范围为 0.4 1%~1.6 4%, 平均值为(0.87±0.25)%, 口内区平均值为(1.19±0.21)%, 混合区平均值为(0.9 3±0.1 7)%, 口外区平均值为(0.68±0.14)%。TN 含量变化范围为0.06%~0.17%, 平均值为(0.11±0.02)%, 口内区平均值为(0.12±0.02)%,混合区平均值为(0.10±0.02)%, 口外区平均值为(0.10±0.03)%。OC/TN 变化范围为5.8~10.9, 平均值为8.3±1.4, 口内区平均值为9.7±0.5, 混合区平均值为9.1±1.0, 口外区平均值为6.8±0.5。沉积物Fe3+变化范围为 0.46~5.29mg·g-1, 口内区平均值为2.49±1.24mg·g-1, 混合区平均值为2.99±1.62mg·g-1,口外区平均值为3.62±1.29mg·g-1; Fe2+变化范围为4.87~19.88mg·g-1, 口 内 区 平 均 值 为11.10±3.72mg·g-1, 混合区平均值为 11.23±3.04mg·g-1, 口外区平均值为8.04±1.74mg·g-1。
?
2.1.2 沉积有机质(TOC、TN)的分布特征
珠江口沉积物TOC、TN 和OC/TN 空间分布见图2。空间分布特征显示, 珠江口沉积物TOC 和TN具有相似的分布特征, 即从口内向口外逐渐递减,西部高于东部的趋势。沉积物TOC 的空间分布特征总体表现为口内区>混合区>口外区的特点, 混合区和口外区沉积物TN 变化不明显, 但均低于口内区。三个区域间沉积物 TOC 含量均存在显著差异(ANOVA,P<0.05); 沉积物TN 含量仅口内区和口外区存在显著差异(ANOVA,P<0.05)。OC/TN 的空间分布特征呈现口内区>混合区>口外区分布特征, 口外区沉积物OC/TN 与口内区、混合区相比较皆存在显著的差异(ANOVA,<0.05)。
2.2 环境因素对沉积有机质分布的影响
沉积物TOC、TN 与Eh、Fe2+、Fe3+、平均粒径、底层水盐度、DO 等主成分分析结果显示(图3), PCA主轴1 和主轴2 分别解释了数据承载量的51.31%和19.08%。PCA 结果指示口内区、混合区与口外区呈现明显不同的分布模式, 口内区、混合区和口外区各影响因子对有机质的影响作用存在明显的差异性;口内区Fe2+与TOC 矢量线相同, 呈正向影响; 沉积物粒度与TOC、TN 矢量线方向一致, 指示珠江口口内区沉积有机质主要受陆源的影响; 混合区沉积物TOC、TN 受多种因素的影响; 口外区沉积物TOC、TN 与Eh、Fe3+矢量线方向相反, 说明Eh、氧化态铁对口外区沉积有机质的分布有重要影响。
2.3 沉积物可溶性有机物荧光特征
珠江口SDOM 三维荧光呈现类腐殖质峰(A、C和M 峰)和类蛋白峰(B 和T 峰)两类峰, 根据珠江口沉积物可溶性有机质荧光强度分布特征(图4)及各区域沉积物可溶性有机质荧光强度和荧光参数(表3)可知, 类腐殖质峰(A、C 和M 峰)为口内区最高, 混合区次之, 口外区最低, 但是冬季混合区和口外区类腐殖质峰差别不显著。类蛋白峰(B 峰)在三个区域变化均不存在显著性差异; 夏季口内区与混合区、口内区与口外区类蛋白峰(T 峰)存在显著差异(ANOVA,P<0.05)。此外, 从口内区到口外区, 类蛋白质占比呈现逐渐增高的趋势。口内区与口外区沉积物可溶性有机质荧光指数(FI)存在显著差异(ANOVA,P<0.05), 口内区与混合区仅夏季存在显著差异(ANOVA,P<0.05)。口外区新鲜度指数(β:α)与口内区、混合区均存在显著差异(ANOVA,P<0.05), 且从口内区到口外区存在递增趋势。自生源指数(BIX)在各区域之间的差异性和变化趋势与β:α一样。腐殖化指数(HIX)在各区域间不存在显著差异, 但是从口内区到口外区存在递减趋势。珠江口沉积物可溶性有机质荧光强度和TOC、Fe3+相关性统计结果显示, TOC 与类腐殖质荧光强度(A、C 和M 峰)呈显著正相关(P<0.01)(表4); Fe3+与大部分SDOM 荧光组分均成负相关关系, 冬季Fe3+与类蛋白荧光强度(B 和T 峰)以及TOC 呈现显著负相关性(P<0.01), 而夏季相关性不显著。

表3 珠江口沉积物可溶性有机质荧光强度和荧光参数Tab. 3 Fluorescence intensity and spectral parameters of SDOM in the PRE
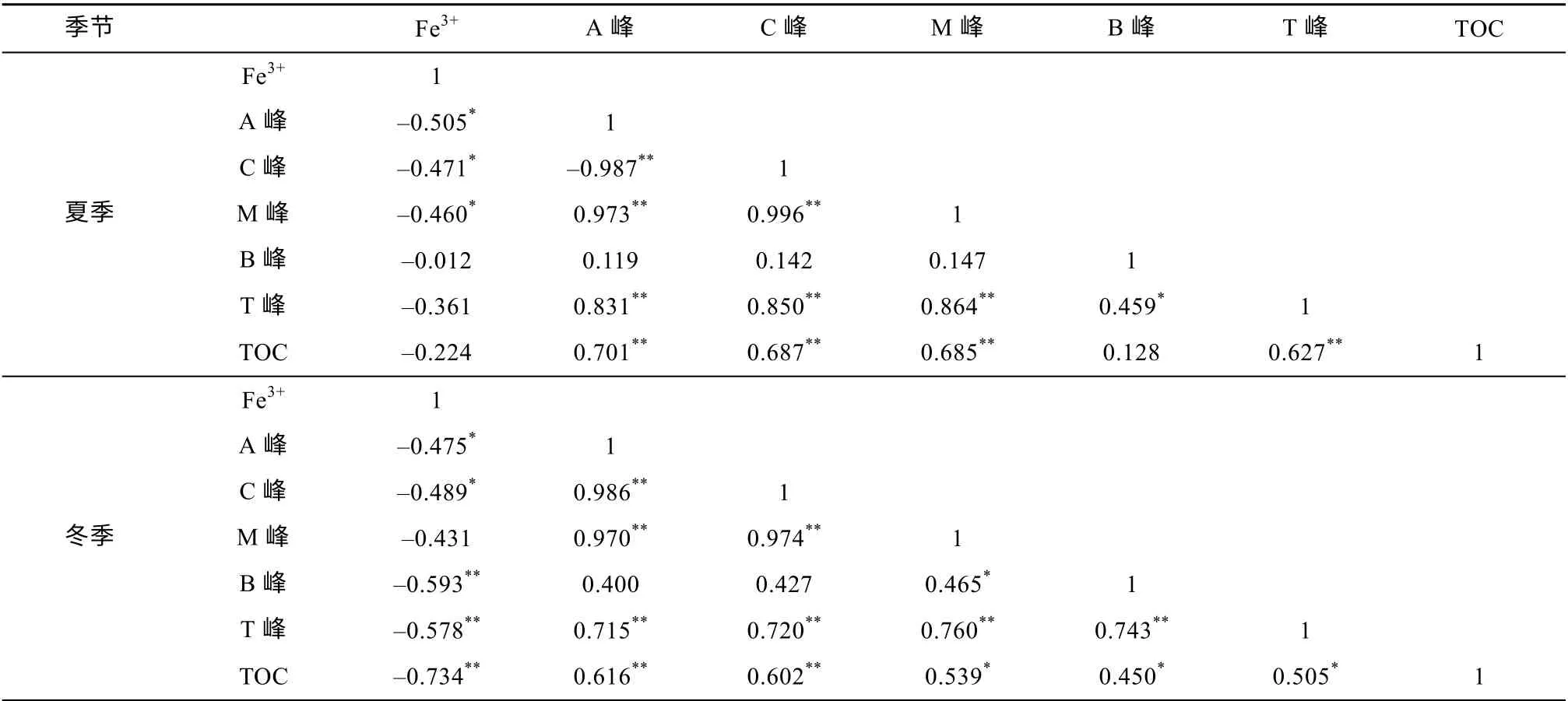
表4 珠江口沉积物Fe3+、可溶性有机质荧光强度和TOC 相关性Tab. 4 Correlations of sediment Fe3+ with SDOM fluorescence intensity and TOC in the PRE
2.4 不同区域沉积物有机质不同来源占比
珠江口沉积物δ13C 结果见表2。珠江口沉积物δ13C 变化范围为-25.60‰ ~ -21.17‰, 平均值为(-23.11±1.24)‰, 口内区平均值为(-24.70± 0.63)‰,混合区平均值为(-23.66±0.64)‰, 口外区平均值为(-21.86±0.42)‰。空间分布上呈现河口向外海方向呈现逐渐偏正的趋势(图5)。珠江口口内区与混合区、口内区与口外区、混合区与口外区沉积物δ13C值均存在显著差异(ANOVA,P<0.05)。
本文选取-27‰和-20.5‰分别作为研究区域陆源端元值和海源端元值(Hu et al, 2006), 运用MixSIAR 稳定同位素混合模型对口内区、混合区和口外区三个区域进行沉积有机质不同来源估算, 结果如图6 所示。口内区陆源和海源有机质贡献分别为80.4%和19.6%, 混合区陆源和海源有机质占比分别为64.1%和35.9%。相比于口内区, 混合区海源有机质贡献增多。口外区陆源和海源有机质来源贡献分别为36.2%和63.8%, 陆源有机质贡献低于海源有机质贡献, 但仍占有较高比重。
3 讨论
3.1 陆源输入对珠江口沉积物有机质的分布和来源的影响
综合来看, 珠江口沉积有机质含量较高的区域主要位于口内区和混合区, 且以陆源有机质为主(图6), 口内区和混合区域受人类活动和河流输入影响显著。研究区域属于珠三角经济建设的重要区域, 周边坐落众多高度工业化城市, 人口稠密(Wang et al, 2017; 贾淇文 等, 2021), 每年的污水排放量高达9×109m3(Peng et al, 2017), 通过河流排入河口, 进而输入南海。而研究区域的河流入海口主要位于口内区和混合区域, 所以大量有机质会随河流排入口内区和混合区域, 并在此沉积。主成分分析结果显示口内区沉积有机质与粒径相关性显著(图3), 由于珠江口泥沙主要来源于径流输入(江四义 等, 2008), 平均粒径呈现口内区>混合区>口外区(表1)。但是, 由于过去几十年人类大规模河道采砂活动, 导致珠江口沉积物明显细化(唐诚 等,2013), 以粒径<0.63mm 的黏土和粉砂为主(表 1),其占比呈现口内区>混合区>口外区。黏土和粉砂具有粒径小、表面积大的特点, 能为有机物提供良好的附着点(Gao et al, 2012), 研究区域沉积物粉砂和黏土与TOC(R2=0.54,P<0.01)、TN(R2=0.54,P<0.01)均呈现显著正相关性, 说明相比于口外区, 口内区和混合区粒径较小的黏土和粉砂能吸附更多的有机质, 这是口内区和混合区沉积物有机质含量较高的另一重要影响因素。
混合区介于口内区和口外区之间, 咸淡水激烈混合, 但结果发现混合区沉积物有机质仍主要受陆源输入的影响(图6)。其原因如下: (1)在混合区由于河流冲淡水与海水的密度存在差异, 存在分层现象, 形成明显的盐度峰面(Lai et al, 2015), 河流输入所携带的陆源有机质在自身重力和混合区盐度峰面阻碍下, 在混合区发生显著沉降现象, 致使混合区向口外区输送的陆源有机质量迅速降低;(2)采样过程中观察到混合区域水质浑浊, 虽然营养盐供应充足, 但由于透明度较低, 藻类受到光限制, 藻类源有机质贡献少, 藻类贡献的有机质仍远低于陆源有机质的贡献量; (3)虽然底层海水入侵会增加海源有机质的影响, 但据刘广州 等(2020)报道该片区域存在大约1/3~2/3 的海源有机质会被径流携带以动力输出的方式输送到口外区, 近1/4 的海源有机质在微生物反硝化作用、氧化作用等生化作用下消耗掉。所以, 混合区的沉积物有机质主要是受陆源输入的影响。相对于口内区和混合区, 口外区沉积有机质含量较低, 且以海源有机质为主,主要是初级生产者死亡后的残渣(韦海伦 等,2018)。但口外区仍受到径流输入的陆源有机质影响, 特别是外伶仃洋西侧区域, 受磨刀门陆源输入影响, 且在海水动力输送下, 能将外伶仃洋西侧区域陆源有机质输送至东侧(刘广州 等, 2020), 所以口外区陆源有机质仍占较高的比重(36.2%)。
3.2 沉积物Fe3+对有机质的保护作用
传统观点认为 Fe3+可通过形成胶结物促进有机质团聚体的形成, 从而对有机质形成物理保护,或者充当吸附剂的角色吸附有机质实现共沉淀,降低有机质的生物可利用性, 促进有机质的积累(Barral et al, 1998; Shields et al, 2016; 陶婧 等,2017)。本研究发现, 口内区和混合区Fe2+与口外区存在显著差异(ANOVAP<0.05), 表明口外区沉积物Fe2+被氧化成Fe3+的程度更高, 沉积物还原态铁减少, 氧化态铁增多。Fe2+不易与有机质相结合,而Fe3+易与有机质结合形成稳定化合物(Lalonde et al, 2012; Riedel et al, 2013), 口外区的铁氧化物-有机质复合体应该较多。但本研究PCA 结果显示珠江口SOM 含量与Fe3+呈负相关关系, 口外区SOM受Fe3+的影响明显(图3), 与传统观点不符。Chen等(2020)通过室内静态培养实验发现只有在静态好氧以及同时输入DOM 和Fe2+的条件下, 才能形成弱晶质铁氧化物-有机质复合体, Fe3+才能对SDOM起到保护作用。珠江口口外区底层水DO 浓度一般高于4mg·L-1, 且沉积物Eh 较口内高, 相较于口内,口外区处于相对不稳定的沉积环境, Fe2+与SDOM无法形成弱晶质铁氧化物-有机质复合体实现共沉淀, 无法抑制有机质的矿化, 减少有机质的降解。相反, 在非静态氧化环境中铁氧化物-有机质复合体容易被降解, 致使OC/Fe3+比值降低(Lalonde et al, 2012)。相关性结果(表4)也发现, Fe3+与大部分SDOM 荧光组分均呈负相关, 说明珠江口非静态环境下 Fe3+对有机质的保护较低, 特别是在口外区,海源有机质的增加, 沉积有机质不易于与Fe3+结合,更易被微生物作为碳源利用(Zeng et al, 2020), 导致Fe3+对有机质的保护性低于口内。此外, Linkhorst等(2017)也曾提出有机碳与铁结合是一个可逆过程,不稳定的海洋有机质能驱动微生物还原铁, 促进有机碳的释放; 同时, Fe2+的氧化可通过类芬顿反应(Fenton-like reaction)产生活性氧, 进一步促进有机质的分解(Chen et al, 2020), 增加了有机质降解的速率, 导致口外区沉积物Fe3+对有机质的保护作用较低。
其他近岸非稳态环境也存在类似的现象, 如陶婧 等(2017)曾报道南黄海沉积物中 Fe3+对有机碳的保存作用, 该区域沉积物在黄海海岸流、黄海暖流等复杂水动力条件下长距离反复沉积和再悬浮, 导致铁氧化物活性降低, 进而降低Fe3+对有机碳的吸附容量, 这时Fe3+对沉积物有机碳的保存作用较低。在河口三角洲同样具有不稳定的沉积动力环境(Zhao et al, 2018; 徐阳 等, 2021), 影响了氧化铁活性以及铁氧化物—有机质复合体的稳定性。此外, 海源有机质性质比较不稳定(韦海伦 等,2018), 并且在不利于 Fe3+与有机碳结合形成稳定复合物的非稳态环境下, 沉积物有机质易被快速降解, 从而导致口外区沉积物有机质含量下降。综上, Fe3+作为有机碳能否长期储存的关键因素, 其在口外区含量的增加, 并未对有机质起到保存作用, 反而由于口外的相对不稳定沉积环境, 加快了有机碳的循环过程(Lalonde et al, 2012)。
3.3 珠江口沉积物有机碳可存储性的指示特征
SDOM 荧光强度和荧光指数可表征环境中SDOM 的含量、迁移和转化过程(郭卫东 等, 2020)。通过其类蛋白组分和类腐殖质组分差异指示变化趋势, 荧光光谱指数指示SDOM 的腐殖化程度, 并以此判别有机质的可降解程度, 指示沉积物有机碳可存储性。从珠江口整体情况来看, SDOM 荧光组分, 特别是类腐殖质组分(A 峰、C 峰和M 峰)的荧光强度沿口内—口外逐渐降低, 说明陆源输入对珠江口SDOM 荧光组分有明显的影响。珠江口沉积物自生源指数(BIX)平均值为1.04, 与其他近岸河口——如长江口(Han et al, 2021)和韩国四大河流域(He et al, 2016)——相比较高, 说明自生的有机质比例较高(Helms et al, 2008), 且研究区域腐殖化指数(HIX)平均值为0.60, 与长江口(Han et al,2021)相比处于较低水平。以上结果说明珠江口沉积物有机质的可利用性相对其他河口较高, 不利于存储, 这与连忠廉 等(2019)通过沉积物有机碳浸提组分发现珠江口沉积物活性有机碳较高, 可存储性较低的结论一致。
分区来看, 口内区和混合区SDOM 荧光峰主要为类腐殖质峰(图4), 这与徐阳 等(2021)研究结果一致。从口内区至口外区类腐殖质荧光强度减小趋势明显, 口内区与口外区SDOM 类腐殖质峰均存在显著差异(ANOVA,P<0.05), HIX 指数从口内区到口外区依次降低, 且两区域间存在显著差异(ANOVA,P<0.05), 说明口内区受河流输入类腐殖质类组分的影响大于口外区, 其有机质的可存储性高于口外区; 口内区至口外区类蛋白荧光强度有所增加, 但各区域间类蛋白荧光峰差异不明显,由于海源有机质主要为类蛋白质组分, 容易降解,所以口内区至口外区有机质可降解性升高, 有机碳的可存储降低。BIX 和β:α指数显示口内区和混合区均低于口外区, 且存在显著差异(ANOVA,P<0.05), 说明口内区自生源有机质少, 部分陆源有机质在输入河流和排入河口的过程中已经开始分解和被利用, 最后到达口内区和混合区的陆源有机质性质较为稳定(张凌 等, 2010; Hou et al,2021); 口外区浮游植物死亡后易被分解, 新产生的有机质量较口内区和混合区多, 有机质的可降解性增加。并且陆源输入性质较为稳定的活性有机碳主要在西部区域沉积, 而微生物活性有机碳则主要在东南部口外处沉积, 口外易降解有机碳的增加, 更易被微生物分解(连忠廉 等, 2019)。综上, 珠江口沉积物中自生源、新生有机质较多, 整体上不利于有机碳的存储, 但口内区和混合区有机质存储性较口外区高。
4 结论
1) 珠江口沉积物TOC 和TN 空间变化相似,口内区和混合区域沉积有机质含量显著高于口外区; 口内区、混合区及口外区沉积有机质的影响因素存在明显的差异, 口内区和混合区沉积有机质主要受陆源输入的影响, 口外区主要受Fe3+的影响。
2) 受径流输入的影响, 珠江口沉积有机质总体以类腐殖质为主, 但口外类蛋白质含量占比相对较高; 混合区沉积有机质仍以陆源为主, 口外区虽以海源为主, 但陆源仍占较高比例(36.2%)。
3) 陆源输入导致口内沉积有机质腐殖化程度较口外高; 口外由于受海源有机质和铁氧化物—有机质复合体的影响, 沉积物有机碳可存储性较口内低。总体来看, 珠江口沉积物新生有机质较多,可快速被利用, 不利于有机碳存储。
