珠江口沉积物中重金属和石油污染对微生物群落结构的影响
2022-03-07李纯厚肖雅元谢雨芳
吴 鹏,刘 永,李纯厚*,肖雅元,王 腾,林 琳,谢雨芳
(1. 农业农村部南海渔业资源开发利用重点实验室,中国水产科学研究院南海水产研究所,广东 广州,510300;2. 国家海洋局南海环境监测中心,广东 广州,510300;3. 南方海洋科学与工程广东省实验室(广州),广东 广州,511458;4.广东省渔业生态环境重点实验室,广东 广州,510300)
引 言
珠江口是粤港澳大湾区的核心区域,也是我国最重要的河口之一。珠江口自然条件优越,水产资源十分丰富,对广东省的经济发展起着重要作用。近40 a随着珠江沿岸经济的迅速发展,珠江口海域不仅接纳了大量毗邻沿岸地区直接排放的污水,还接纳了各种大小径流携带和珠江口周边大规模的水产养殖业排放的污染物。此外,珠江口各类船只较多,航运繁忙,也是污染物的重要来源[1]。《2018年中国海洋生态环境状况报告》显示,珠江口生态系统近年来处于亚健康状态,水体呈富营养化[2]。目前多种持久性有机污染物和重金属在珠江口不同环境介质中也被检测到,而沉积物是持久性有机污染物和重金属主要的“汇”[3-6]。珠江口生态环境区域性差异明显,从珠江口上游的广州河段到下游的外伶仃海域的水环境状况、沉积物污染物含量、浮游生物和渔业资源等生物群落结构具有区域分布的特征[3, 7-10]。在珠江口淡水和海水相互混合作用下,珠江口上游到下游水环境梯度变化下沉积物微生物分布特征还有待进一步研究。
2004年,Wu等[11]利用末端限制性片段长度多态性分析方法(Terminal restriction fragment length polymorphism,T-RFLP)发现珠江口沉积物微生物有9个类群,并且主要以δ变形菌(Deltaproteobacteria)和厚壁菌门(Firmicutes)为主。而后,Sun等[12]基于16S rRNA基因的变形梯度凝胶电泳方法(Denaturing gradient gel electrophoresis,DGGE)发现珠江口沉积物优势菌群为α变形菌(Alphaproteobacteria),γ变形菌(Gammaproteobacteria),酸杆菌门(Acidobacteria)和放线细菌门(Actinobacteria)。随着分子生物学技术的发展,16S rRNA基因扩增子的高通量测序方法被认为能更加全面而快捷地反映微生物组成[13]。然而,目前缺乏利用该技术探讨珠江口沉积物微生物群落研究。微生物群落结构也受外界环境因素的影响,环境的异质性能形成微生物的区域-分类群单元[14]。针对珠江口沉积物环境,研究发现地理区域是影响珠江口厌氧氨氧化菌分布的关键因素,而季节性变化影响不大[15]。对于珠江口沉积物中的古菌,盐度、氨氮和有机碳则发现是主要影响因素[16]。然而,Sun等[12]采用16S rRNA-DGGE方法发现总磷、铵盐、pH和海水盐度是影响珠江口沉积物微生物分布的主要因素。因此,沉积物营养盐等环境因子可影响微生物组成。但是,珠江口沉积物中重金属和石油类污染广泛存在,并且这两类污染物含量在珠江口上游相对高于下游,重金属和石油类污染在珠江口也有明显的区域差异分布特征[17, 18]。然而,重金属和石油类等污染物对珠江口沉积物微生物变化的影响研究还少见报道。
本研究从珠江口上游到下游选取了梯度环境变化下的调查站位14个,采用16S rRNA基因扩增子的高通量测序方法阐述了珠江口区域环境特征差异下微生物群落分布特征,着重探讨了重金属和石油类等理化因子对沉积物微生物分布的影响。研究结果为了解珠江口沉积物微生物的区域分布特征和生态功能提供基础数据和理论基础。
1 材料与方法
1.1 样品采集
2015年8月从珠江口上游到下游布设了14个研究站点(图1),采集了表层(0~5 cm)沉积物样品。每个站点采集沉积物样品3份,混匀后分装成2份,于-20℃保存,分别用于沉积物理化因子和微生物群落分析。根据底层海水盐度和站位区域位置,以S1—S4为珠江口上游区域(盐度小于2‰),以S5—S9为珠江口中游区域(盐度介于2‰和10‰),而珠江口下游区域以S10—S14站(盐度大于12‰)。

图1 珠江口沉积物采样站位
1.2 沉积物理化因子分析
参照海洋监测规范第5部分:沉积物分析方法(GB17378.5-2007)[19],有机碳(TOC)含量采用重铬酸钾氧化-还原容量法测定;石油类(Oil)含量采用紫外分光光度法测定;重金属总汞(Hg)和砷(As)含量采用原子荧光法测定,铜(Cu)、铅(Pb)、镉(Cd)、锌(Zn)和总铬(Cr)含量采用火焰原子吸收分光光度法测定;沉积物pH通过PHS-3C型精密pH计现场测定。
1.3 宏基因组DNA提取与PCR扩增
取1.0 g采集的沉积物按照PowerSoil®DNA Isolation Kit试剂盒(MOBIO,USA)操作方法提取沉积物宏基因组DNA。以提取的沉积物宏基因组DNA为模板,采用微生物16S rRNA基因V4~V5区的特异性引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和907R(5'-CCGTCAATTCCTTTGAGTTT-3')进行PCR扩增[20]。PCR扩增产物经建库检测,将合格的文库在Illumina HiSeq2500 PE250平台进行高通量测序(北京诺禾致源生物信息科技有限公司)。
1.4 高通量测序数据分析
样品下机测序序列截去Barcode和引物序列后,使用FLASH(V1.2.7)对样品中的Reads进行拼接,得到Raw Tags[21]。拼接得到的Raw Tags经过严格的过滤处理[22]得到高质量的Tags数据(Clean Tags)。Clean Tags按照QIIME(V1.7.0)对Tags的质量控制要求[23],进一步进行如下操作:a)Tags截取:将Raw Tags从连续低质量值(默认质量阈值为≤19)碱基数达到设定长度(默认长度值为3)的第一个低质量碱基位点截断;b)Tags长度过滤:Tags经过截取后得到的Tags数据集,进一步过滤掉其中连续高质量碱基长度小于Tags长度75%的Tags。经过以上处理的Tags通过UCHIME Algorithm(http://www.drive5.com/usearch/manual/uchime_algo.html)与数据库(Gold database,http://drive5.com/uchime/uchime_download.html)去除其中的嵌合体序,得到Effective Tags。Effective Tags利用Uparse(V7.0.1001)在97%水平上进行操作分类单元(Operational taxonomic unit,OTU)聚类分析[24]。选取代表性OTUs序列,用RDP Classifier方法[25]与SILVA数据库[26]进行物种系统进化注释分析。样品数据均一化处理后,使用QIIME软件(V1.7.0)计算样品的香农指数(Shannon),辛普森指数(Simpson),Chao1指数和覆盖度(Coverage)[23]。
1.5 数据分析
根据所有样品的OTU序列,将相同分类的OTUs信息合并处理后构建系统发育树,并通过R软件GUniFrac包来计算样本间的Unweighted Unifrac距离,再结合OTU的丰度信息,进行主坐标分析(Principal coordinate analysis,PCoA)探讨珠江口沉积物微生物组成差异。根据珠江口沉积物各属微生物的相对丰度,选取相对丰度高的前30属的微生物通过STAMP软件绘制热图,而微生物在珠江口三个区域中的组成差异通过One-way ANOVA和Tukey-Kramer方法检验。通过R软件采用典范对应分析(Canonical correlation analysis,CCA)珠江口沉积物微生物组成与沉积物理化因子的关系。所有检验中,差异显著为p≤0.05,差异极为显著为p≤0.01。
2 结果与讨论
2.1 珠江口沉积物理化因子状况
沉积物pH值在S1站点最低为7.21,而S14站点的pH值最高为8.39,表现为珠江口从上游到下游呈现逐渐递增的趋势(表1)。相反,TOC含量在珠江口上游含量相对较高,其中S1站点的有机碳含量最高为1.10%,而靠近外海区域的S13站点有机碳含量最低为0.56%(表1)。珠江口沉积物中总汞、砷、铜、铅、镉、锌和总铬等七类重金属平均含量分别为0.104,22.1,61.1,46.2,0.35,158和21.7 mg/kg;其分布规律总体表现为珠江口上游重金属含量相对较高,而靠近外海区域中的重金属含量较低。与刘解答等[18]的历史调查相比较,本次调查的重金属含量略低,但重金属含量的区域变化一致,从珠江口上游到下游逐渐降低。珠江口沉积物石油类含量的变化范围为25.9~541.0 mg/kg,平均值为183.8 mg/kg;珠江口上游S1—S4站点的石油类含量(379.0~541.0 mg/kg)相对高于下游的S10—S14站点(41.6~115.0 mg/kg)(表1)。吴玲玲等[17]调查发现2006年、2009年、2010年和2011年珠江口沉积物石油类平均含量分别为127.2,318.0,134.1和118.5 mg/kg。与以往调查结果相比较,本次调查珠江口沉积物中的石油类含量有一定程度的升高,但其分布规律基本一致,珠江口上游站点的石油类含量要高于珠江口下游。以往研究表明石油类和重金属的污染水平受珠江口陆源输入的影响比较大[17-18]。
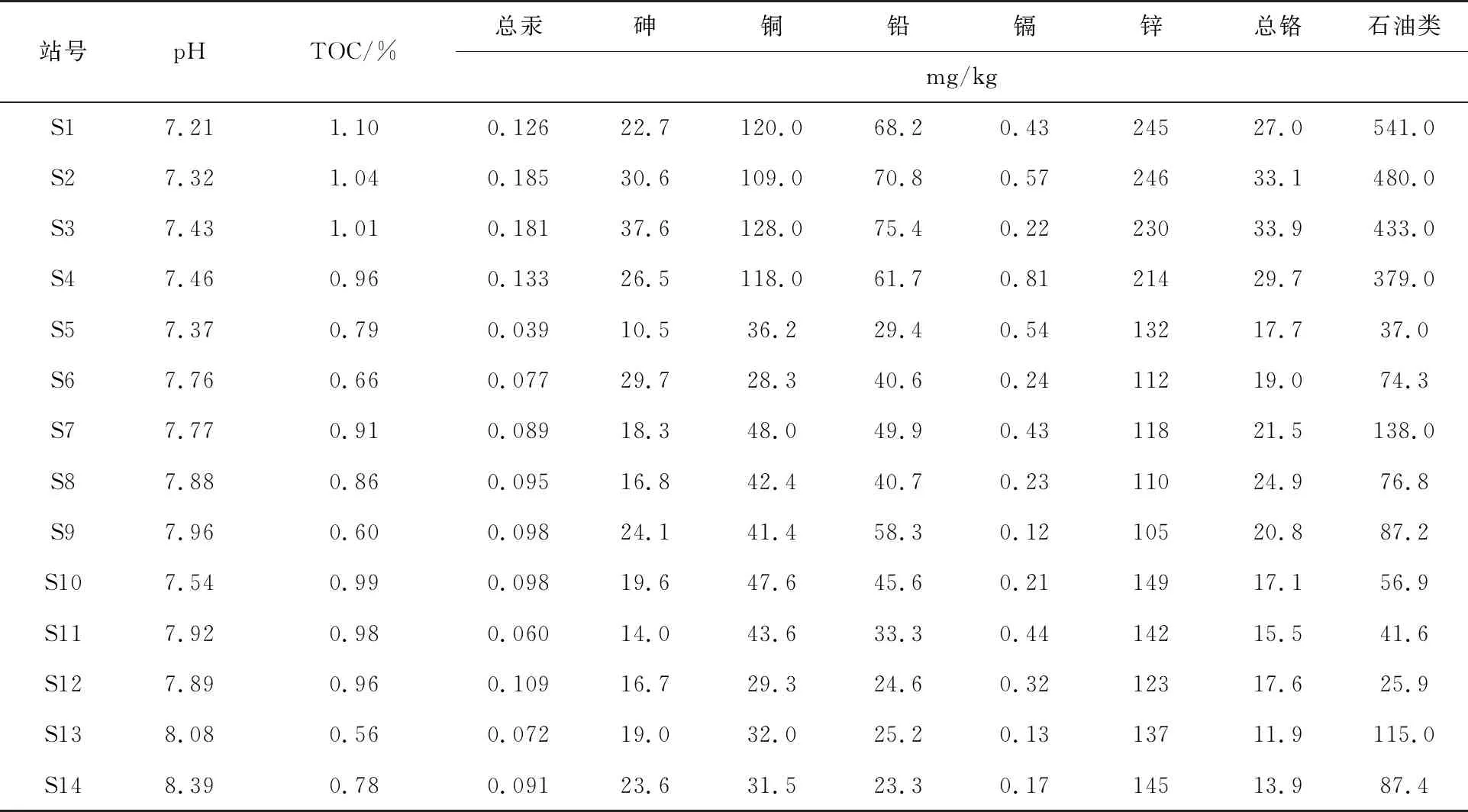
表1 珠江口沉积物理化因子状况
2.2 珠江口沉积物微生物群落组成
珠江口沉积物的14个样品中获得Effective reads范围在52565到66691之间,其中S10站点最少,而S3站点获得数量最多。在97%的相似性水平上,各站点获得的OTUs数量变化在4181到6787之间,其中S12站点最少,而S3站点最多(表2)。每个样品保留45092条Effective reads,在97%的相似性水平上对OTUs数据进行均一化处理后进行Alpha多样性指数分析,发现各样品Shannon指数介于9.22和10.58之间,Chao1介于4128和7346之间,而Simpson指数基本在0.99以上。珠江口中游的Shannon指数平均值(10.20)相对高于上游(10.08)和下游(10.05)的区域。各站点样品的Chao1指数基本和OTU数目相当,结合各样品的Coverage均达到95%以上,表明本研究的高通量测序数据能全面反映珠江口沉积物微生物种类(表2)。

表2 珠江口沉积物微生物的测序信息和多样性分析
基于微生物门分类水平分析发现珠江口沉积物微生物均以变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)两类为主,该两类群相对丰度之和均占总丰度的50%以上。绿弯菌门相对丰度在S1站点和S7站点要高于变形菌门,而其余站点的变形菌门相对丰度要高于绿弯菌门。浮霉菌门(Planctomycetes)和拟杆菌门(Bacteroidetes)类群在各站点中的相对丰度也较高,分布范围分别为2.8%~8.5%和1.5%~7.4%。另外,有些微生物类群在特定站点所占比例也较高,S2站点中蓝细菌门(Cyanobacteria)相对丰度较高为15.3%,S7站点中泉古菌门(Crenarchaeota)相对丰度为11.0%(图2)。分析变形菌门类群中各纲微生物组成发现,沉积物中以δ变形菌(Deltaproteobacteria)的相对丰度较高,其次为γ变形菌(Gammaproteobacteria),但β变形菌(Betaproteobacteria)相对丰度在珠江口上游的S2—S4站点要明显高于其余站位(图2)。本研究采用的高通量测序方法反映的珠江口沉积物微生物群落结构,与已报到的DGGE的测序方法结果有所不同。16S rRNA-DGGE方法发现珠江口沉积物微生物种类以酸杆菌门(Acidobacteria)和变形菌门占优势,而变形菌门类群中以γ变形菌和α变形菌为主,δ变形菌未检出[12]。珠江口水体和沉积物中微生物群落也具有较大差别,尽管均采用高通量测序方法。Mai等[10]发现珠江口水体生物膜上的微生物以变形菌门类群为主(56.6%),其中又以α变形菌和γ变形菌为主;随着海水盐度的增加,水体环境中α变形菌相对丰度增加,而γ变形菌减少。然而,本研究发现随着海水盐度的增加沉积物环境中γ变形菌相对丰度增加,而δ变形菌减少。
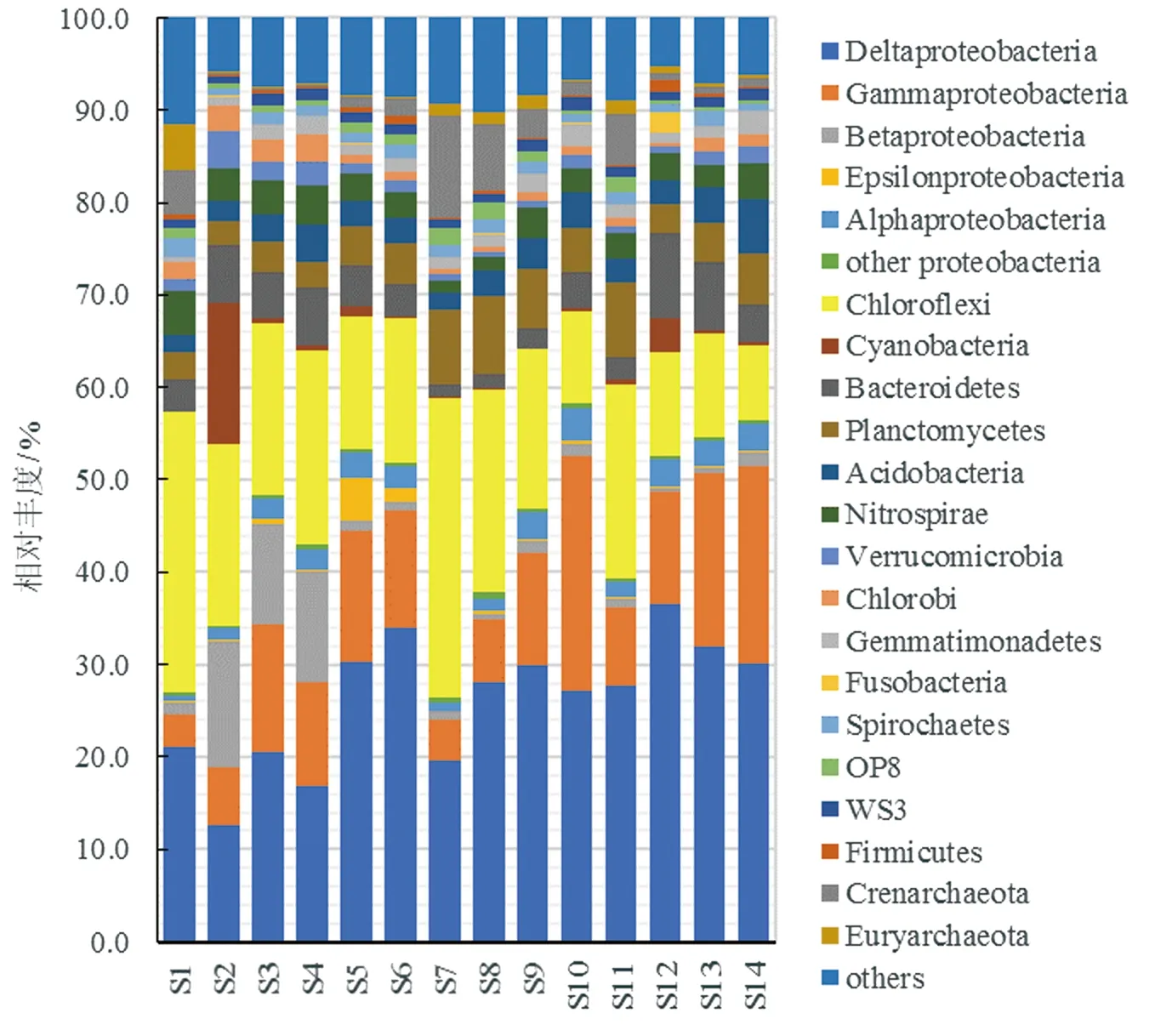
图2 门和PROTEOBACTERIA纲分类水平下珠江口沉积物微生物类群相对丰度组成变化
Unweighted Unifrac PCoA分析发现位于珠江口上游S1—S4站点的沉积物微生物群落主要聚为一类,位于珠江口中游的S5—S9站点的沉积物微生物群落聚为另一类,其余位于珠江口下游站点的沉积物微生物聚为第三类,PCoA分析可以发现珠江口沉积物微生物群落分布具有明显的区域性(图3)。珠江口沉积物微生物具有区域性分布的特征,这与水环境状况、沉积物污染物含量、浮游生物和渔业资源等生物群落结构在珠江口分布呈现区域性差异的特征相类似[3, 7-10]。因此,有必要加强珠江口沉积物微生物组成的区域比较研究。
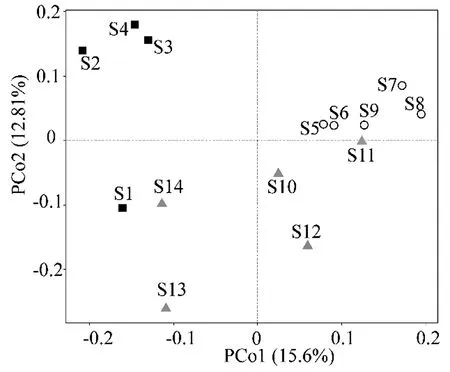
图3 Unweighted Unifrac PCoA分析珠江口沉积物微生物群落
将珠江口沉积物微生物分为三组(上游、中游和下游),选取相对丰度高的前30属微生物进行分析,发现三个区域中硝化螺旋菌(Nitrospira)、脱硫球菌(Desulfococcus)、厌氧粘细菌(Anaeromyxobacter)、厌氧绳菌(Anaerolinea)、4-29和LCP-26组成差异极为显著(p<0.01),而CandidatusPortiera、BD2-6、脱氯单胞菌(Dechloromonas)、GOUTA19、HTCC、Nitrosopumilus和硫杆菌(Thiobacillus)微生物组成差异有显著性(p<0.05)。此外,珠江口上游沉积物中硝化螺旋菌、厌氧绳菌、4-29和厌氧粘细菌相对丰度较高,而珠江口中游沉积物中LCP-26相对丰度较高,珠江口下游以脱硫球菌相对丰度较高。硝化螺旋菌是硝化作用/反硝化作用过程中的关键菌群,厌氧粘细菌在沉积物Fe和S循环中发挥重要作用,在厌氧条件下厌氧绳菌能降解大量的碳水化合物[27-28]。脱硫球菌是硫酸盐还原菌的重要类群,并介导有机污染物的降解[29-30]。可见,珠江口沉积物微生物在沉积物营养物质循环和污染物降解等方面发挥重要作用。

图4 珠江口沉积物中前30属微生物组成
2.3 珠江口沉积物状况对微生物群落的影响
典范对应分析发现沉积物中Cd和TOC含量对沉积物微生物影响不明显(p≥0.05),珠江口上游沉积物微生物受重金属(Zn、Hg、Cr、Pb和As等)和石油类含量的影响较大(p<0.05),而珠江口中游和下游受pH的影响尤为明显(p<0.05)(图5)。Sun等[12]也发现pH是影响珠江口沉积物微生物分布的重要因素之一。pH可直接影响微生物组成,或者通过影响沉积物中重金属溶解性、有机碳含量和电导率等理化因子从而间接影响微生物组成[12, 31, 32]。珠江口上游沉积物微生物受重金属和石油类的影响较大,可能由于沉积物环境中重金属和石油类污染程度相对较高,造成参与相应污染物代谢的微生物种类增多有关。笔者曾发现多环芳烃污染在珠江口上游相对较高,导致相应的微生物代谢功能基因也增高[34]。进一步分析珠江口沉积物中微生物代谢基因的分布情况,可更好地阐述重金属和石油类污染物对微生物群落结果的影响。
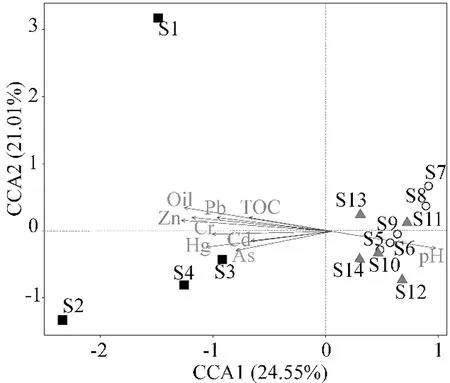
图5 珠江口沉积物微生物与沉积物理化因子的变化关系
3 结论
(1)珠江口上游沉积物重金属和石油类污染相对较高。珠江口上游沉积物重金属(总汞、砷、铜、铅、镉、锌和总铬)含量要高于珠江口下游和中游,石油类含量在珠江口的分布规律与重金属分布趋势相一致;石油类和重金属的污染水平受陆源输入的影响比较大。
(2)珠江口沉积物微生物多样性丰富。珠江口沉积物中微生物Effective reads变化范围为52565~66691,而Shannon指数为9.22~10.58;珠江口沉积物微生物以变形菌门和绿弯菌门两类为主,其次为浮霉菌门和拟杆菌门;在变形菌门类群中,沉积物以δ变形菌相对丰度最高,γ变形菌次之;沉积物中存在大量的微生物参与营养物质循环和污染物降解等过程。
(3)珠江口沉积物微生物区域分布具有差异性。珠江口中游沉积物微生物Shannon指数相对高于珠江口其余两区域;珠江口上游的β变形菌相对丰度要高于珠江口下游区域,而γ变形菌相对丰度反之;珠江口上游沉积物中硝化螺旋菌属、厌氧绳菌属、4-29和厌氧粘细菌属相对丰度较高,而珠江口中游沉积物中LCP-26相对丰度较高,珠江口下游以脱硫球菌属相对丰度较高。
(4)珠江口上游沉积物微生物群落受重金属(锌、总汞、总铬、铅和砷)和石油类的影响较大,而下游的微生物受pH影响更明显。
