深圳大鹏湾一次球形棕囊藻藻华的发生过程及成因分析
2022-06-10刘悦李丽翟晓辉周娟叶鹏浩黄盛东
刘悦, 李丽, 翟晓辉, 周娟, 叶鹏浩, 黄盛东
深圳市海洋发展研究促进中心, 广东 深圳 518029
棕囊藻(Phaeocystis)为全球广布的有害藻华物种, 该藻华的发生显著影响了海洋生态系统结构和功能以及碳硫等生源要素的生物地化循环和全球气候变化(Lancelot et al, 1998; Schoemann et al, 2005)。目前已经鉴定的7 种棕囊藻物种中, 南极棕囊藻(P.antarctica)、波切棕囊藻(P. pouchetii)和球形棕囊藻(P. globosa)可分别在南北两极和温热带海区引发大规模藻华(Schoemann et al, 2005)。这3 个物种均具有异型生活史,有单细胞和囊体两种生活史阶段。其中单细胞仅有几个微米, 而囊体一般达到几百微米(Rousseau et al, 2007)。囊体外被为多糖组成的黏液质, 囊体细胞包裹于多糖黏胶结构中。由于较大的粒径和坚韧的外被结构,囊体减少了被浮游动物摄食的几率(Nejstgaard et al, 2007) ,并且降低了细菌和病毒对囊体细胞的感染和降解(Brussaard et al,2007) ,这样就有效降低了死亡率从而提高了生物量的积累。囊体的形成是棕囊藻藻华发生并产生危害的主要原因(Hamm, 2000; Verity et al, 2007)。
球形棕囊藻为我国沿海常见有害藻华物种(Wang et al, 2021b)。球形棕囊藻藻华在我国首次报道于1997 年10 月的柘林湾, 藻华周期持续6 个月,覆盖面积达3000km2, 造成大量养殖鱼类死亡, 导致直接经济损失超过 3000 多万元(陈菊芳 等,1999)。自1997 年开始, 球形棕囊藻藻华陆续在福建、广东、广西、海南、河北及天津等6 省市沿海暴发(沈萍萍 等, 2018)。我国球形棕囊藻藻华特点显著, 可形成直径长达3cm 的囊体,是世界所有海区发现的最大的球形棕囊藻囊体(Wang et al, 2021b)。巨大的囊体体积可能不仅显著影响海区浮游动物摄食以及微生物分解, 继而影响当地生态系统结构和功能, 也可给滨海核电冷源安全带来严重隐患。因此, 球形棕囊藻藻华发生规律及其机制的研究对于减轻灾害损失和开展防治工作具有十分重要的意义。然而, 球形棕囊藻在我国南部沿海频繁发生的机制迄今尚不清楚。
2021 年1 月下旬, 深圳大鹏湾南澳码头附近海域发生球形棕囊藻藻华。我们追踪了本次藻华的生消过程, 系统分析了藻华发生和消退期间环境因子和生物因素的连续变化, 力图探索球形棕囊藻藻华发生的特征和关键调控因素, 为进一步理解球形棕囊藻藻华发生机制提供理论参考, 同时为球形棕囊藻藻华的治理和预警提供科学依据。
1 材料和方法
1.1 调查时间和站位
2021 年1 月下旬, 发现大鹏湾有外表呈现棕黄色且直径约1cm 的巨型棕球形棕囊藻囊体, 分布在湾中心以及沿岸区域, 水体表底均有分布。为了研究藻华发生的动态规律, 于1 月20 日至2 月1 日在大鹏湾南澳码头设置一个站位(114°28′40.36"E,22°32′25.59"N), 每日高潮时对球形棕囊藻藻华进行连续跟踪监测。调查期间, 东北风盛行, 水体混合均匀。球形棕囊藻囊体从湾中心向岸向漂移, 并堆积在沙滩上。
1.2 采样分析方法
利用容积为 8L 采水器进行表层水采样。用500μm 筛绢过滤水样, 对截留在筛绢上的球形棕囊藻囊体进行计数,并在显微镜下对囊体直径及囊体内细胞数量计数, 同时取1L 过滤后的水样, 加入浓度为4%的Lugol’s 溶液进行固定, 在显微镜下计数球形棕囊藻囊体数目、囊体直径、囊体内细胞数量及其他浮游植物细胞数量, 具体参照Wang等(2011)中的方法。温度、盐度、pH 和溶解氧(dissolved oxygen, DO)值采用手持YSI 现场测定。营养盐样品的采集和保存按照《海洋监测规范-海水分析》(GB17378.4-2007) (中华人民共和国国家质量监督检验检疫总局 等, 2008)中规定的相关方法进行。取500mL 水进行过滤, 加入90%丙酮黑暗萃取24h, 采用分光光度法分析叶绿素a浓度。
1.3 数据分析
使用统计软件R语言(3.4.3) 对环境因子进行主成分分析, 对球形棕囊藻囊体丰度和环境因子进行灰关联分析。
2 结果
2.1 浮游植物优势物种演替
调查期间, 浮游植物优势物种出现硅藻(中肋骨条藻)—定鞭藻(球形棕囊藻)—甲藻(红色赤潮藻)的演替现象(图1)。1 月20 日, 调查站位浮游植物主要以硅藻为主, 中肋骨条藻为绝对优势物种, 细胞丰度达到1.8×105cells·L-1。随后中肋骨条藻丰度迅速下降,而球形棕囊藻在1 月21 日出现, 随后细胞浓度逐渐提高, 于1 月27 日达到最高的2.9×107cells·L-1。与此同时, 红色赤潮藻逐渐成为调查区域优势物种: 1 月28 日其细胞丰度达到4.7×106cells·L-1, 随后细胞丰度降低, 但是一直维持在106cells·L-1左右(图1a)。调查期间, 海区叶绿素a浓度先提高, 然后缓慢地降低。但是自1 月22 日之后, 海区叶绿素a浓度始终高于30μg·L-1(图1b)。
球形棕囊藻囊体自1 月21 日出现, 当天囊体数量仅有3colonies·L-1。之后囊体数量显著提高, 于1月25 日达到69colonies·L-1。囊体数量自1 月26 日开始下降, 2 月1 日完全消失(图2a)。调查期间, 并没有发现任何小于 5mm 的囊体, 囊体直径范围0.6~1.2cm, 囊体平均直径接近1cm(图2b)。藻华发生期间, 囊体直径未见显著变化。
2.2 环境因素
调查期间, 海水温度范围在16.03~16.91℃之间,并未有显著变化(图3a)。盐度同样显示出现类似规律, 盐度始终维持在31‰ 左右(图3b)。pH 则出现波动; 由1 月21 日的7.61 上升至1 月27 日的8.08,随后pH 稍有下降。溶解氧浓度则在1 月27 日迅速降低至9.04mg·L-1(图3d)。
调查期间, 营养盐浓度变化显著: 硝酸盐、磷酸盐、铵盐和亚硝酸盐均出现下降趋势, 而硅酸盐则表现为先下降后升高的趋势。硝酸盐和铵盐变化趋势类似, 二者均持续下降。硝酸盐浓度从1 月20 日的9.00μmol·L-1持续下降到2 月1 日的2.63μmol·L-1( 图 4a) , 而铵盐从 12.07μmol·L-1下降到3.36μmol·L-1。磷酸盐则从1 月20 日的0.29μmol·L-1迅速降至1 月22 日的0.06μmol·L-1, 随后浓度始终维持在0.10μmol·L-1以下(图4c)。硅酸盐浓度始终较高, 1 月 22 日出现最低浓度, 但是依然高于6.00μmol·L-1。
2.3 环境因子主成分分析
对调查期间的环境因子进行主成分分析, 结果如图5 所示。主成分两轴分别解释了环境因子承载量的47.80%和15.04%, 第一主成分主要解释的环境变量为铵盐、硝酸盐、磷酸盐、pH 和亚硝酸盐; 第二主成分主要解释的环境变量为温度、硅酸盐、盐度。由图5 可以看出, 球形棕囊藻藻华早期(硅藻藻华期)主要表现为高氮磷营养盐和高溶解氧, 球形棕囊藻藻华消亡期(甲藻藻华期)主要表现为低氮磷、高硅酸盐和pH。
2.4 球形棕囊藻藻华与环境因子的关系
调查期间球形棕囊藻囊体丰度与环境因子的灰色关联度分析结果见表1。可以看出, 影响球形棕囊藻囊体丰度的环境因子由大到小的排序依次是铵盐、硝酸盐、溶解氧、盐度、pH、温度、硅酸盐、磷酸盐、亚硝酸盐。
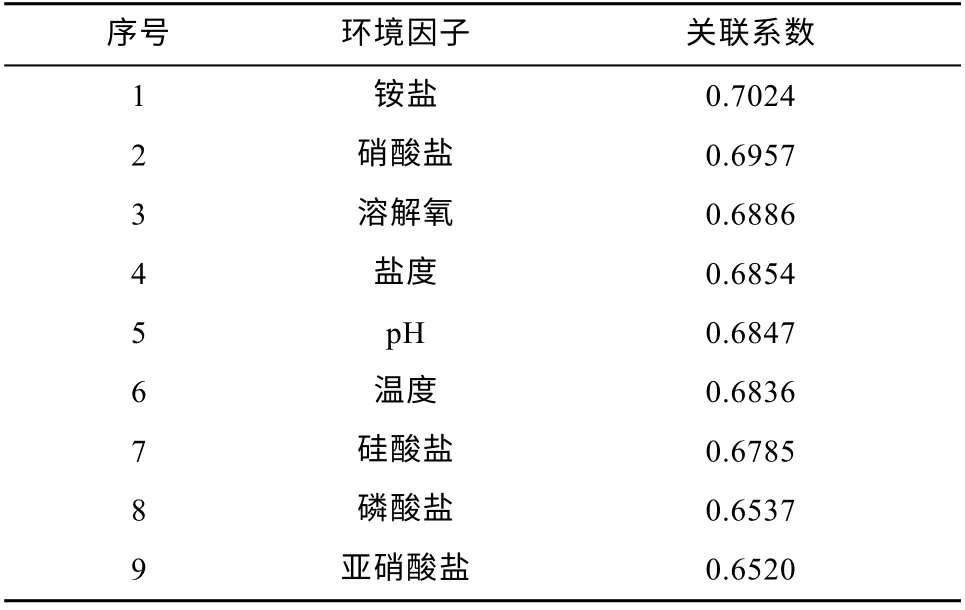
表1 球形棕囊藻囊体丰度与环境因子关联度Tab. 1 The value of grey association degree between Phaeocystis globosa colony density and each environmental factor
3 讨论
3.1 球形棕囊藻藻华的影响因素
球形棕囊藻的异型生活史中包含单细胞和胶质囊体两种生活形态, 而囊体的形成是球形棕囊藻形成藻华的主要原因(Hamm, 2000; Verity et al, 2007)。研究表明, 温度、盐度、光照、营养盐、生物竞争、物理充气及扰动等多种因素都对囊体的形成起着重要作用(沈萍萍 等, 2018; Wang et al, 2021b)。
3.1.1 影响球形棕囊藻藻华的理化因素
氮作为浮游植物细胞内蛋白质、核酸、磷脂和叶绿素等的基本元素, 在浮游植物生命活动中占有非常重要的地位。Riegman 等(1992)认为, 自然环境中棕囊藻可能会随着水体中氮源的增加而暴发藻华,表明氮源对棕囊藻的重要性。灰关联分析结果表明,铵盐是影响球形棕囊藻藻华的重要因素, 这与Hai等 (2010)的结果基本一致。调查期间, 铵盐含量在3.07~12.07μmol·L-1之间, 略高于Hai 等 (2010)报道的浓度。如表1 所示, 硝酸盐对棕囊藻藻华的形成也起着重要作用。很多研究证实了硝酸盐在球形棕囊藻藻华中的重要性。例如, Wang 等(2011)认为, 硝酸盐是球形棕囊藻囊体形成的基础。在欧洲北海,硝酸盐是球形棕囊藻藻华发生时最丰富的氮源(Tungaraza et al, 2003)。吕旭宁 (2020)发现, 北部湾球形棕囊藻囊体形成和藻华维持需要大量硝酸盐。
室内实验发现, 球形棕囊藻能够在盐度较宽的范围内(23‰~33‰)形成囊体(田晶晶, 2010), 调查期间大鹏湾盐度始终维持在31‰左右, 表明盐度可能为囊体的形成提供了适宜的条件。相关分析结果表明, 盐度与球形棕囊藻囊体丰度有关, 这与贺成 等(2019)的调查结果基本一致。适宜的温度条件是影响球形棕囊藻藻华发生与消亡的重要因素。在我国南海, 球形棕囊藻藻华发生的温度范围在15~27℃之间(Wang et al, 2021a)。研究表明, 适宜的外界环境温度, 能够加速球形棕囊藻细胞的分裂, 使得单细胞快速形成囊体, 而细胞囊体再经过一定的生长周期, 再转化成新的囊体(Rousseau et al, 1994; 田晶晶, 2010), 而温度升高不利于囊体的形成(Wang et al, 2010) 。 调查期间, 温度始终保持在16.03~16.91℃之间。
光照对球形棕囊藻的生长及囊体的形成具有重要的作用, 高光照能显著促进球形棕囊藻的生长,在高光条件下单细胞和群体的数量均较高(Wang et al, 2021b)。在欧洲北海, 当水柱光照强度超过25~35μmol·m-2·s-1时才形成球形棕囊藻藻华(Peperzak et al, 1998; Blauw et al, 2010)。室内实验也发现, 当光照强度低于50μmol·m-2·s-1时, 球形棕囊藻囊体无法形成, 而当光照高至500μmol·m-2·s-1时,则能形成 400colonies·mL-1数量的囊体(王艳 等,2013)。遗憾的是, 本文缺少光照的现场数据, 今后有必要加强光照对球形棕囊藻藻华的影响研究。
除了营养盐、温度、盐度、光照外, 水动力条件也是藻类生长的重要影响因素。研究表明, 适宜的水体扰动会通过影响藻细胞周围营养盐边界层厚度, 从而促进藻细胞的增长与聚集(Yin, 2002; 李冬梅 等, 2010)。水体扰动能够促进棕囊藻细胞增殖, 并延长藻细胞的生长时间(李冬梅 等, 2010; 蔡卓平 等, 2011)。大鹏湾是广东沿海的半封闭海湾, 其水体性质主要受季风的影响(Yin, 2003)。冬季东北季风盛行, 在季风和向岸流影响下, 水体混合均匀。季风引起的水体扰动可能是球形棕囊藻藻华的主要因素之一(Hai et al, 2010)。
3.1.2 影响球形棕囊藻藻华的生物因素
在欧洲北海, 球形棕囊藻是春季常见有害藻华物种, 藻华发生时浮游植物演替往往出现硅藻—球形棕囊藻—硅藻的演替规律(Rousseau et al, 2002;Lancelot et al, 2007)。相对于高纬度海区, 此次大鹏湾球形棕囊藻藻华演替则表现略有不同。球形棕囊藻藻华发生在硅藻(中肋骨条藻)藻华后, 而甲藻(红色赤潮藻)藻华在球形棕囊藻藻华消退后发生, 出现了硅藻—球形棕囊藻—甲藻的藻华演替模式。
在1 月20 日至22 日, 硅藻藻华爆发过程中,各类营养盐被快速消耗。期间海域中N 和Si 元素仍充裕, 但磷酸盐浓度由 0.29μmol·L-1降至0.07μmol·L-1。依据Nelson 等(1990)提出的浮游植物营养盐的最低阈值(磷酸盐为 0.1μmol·L-1)来判断,海区出现P 限制。以此为拐点, 23 日, 球形棕囊藻丰度快速上升而中肋骨条藻丰度下降, 叶绿素a含量大幅上升, 随后, 硅酸盐浓度也开始回升(24 日), 表明硅藻在竞争中不再占据优势而由球形棕囊藻贡献主要的初级生产力。实验表明, 在P 限制条件下, 球形棕囊藻比硅藻更具竞争优势(王艳 等, 2013)。
据以往的野外观察总结, 棕囊藻藻华往往发生在硅藻藻华之后(赵越 等, 2019)。硅藻的衰亡对棕囊藻藻华的益处是多方面的。一方面硅藻细胞的裂解为海域带来大量有机营养物质, 已有研究表明球形棕囊藻能够利用有机态营养物质包括有机磷源(王艳 等, 2006; 沈萍萍 等, 2018; 黄肖阳 等,2019) , 因此即便海域已处于寡无机磷状态, 球形棕囊藻藻华仍能爆发。另一方面, 死亡硅藻的硅质壳为棕囊藻单细胞提供附着基质, 有助于囊体的形成和生长(Sanderson et al, 2008; Borkman et al, 2016)。在一些囊体中还能观察到硅藻的包埋(Sazhin et al,2007)。据调查, 棕囊藻赤潮伴生的硅藻多为较大型硅藻和链状硅藻((Rousseau et al, 1994; 徐宁 等,2003; Poulton et al, 2007; 王超 等, 2010; 贺成 等,2019), 其中就包括骨条藻。本次观测到的中肋骨条藻和球形棕囊藻藻华的演替再次说明了棕囊藻与硅藻在群落中内在竞争与依赖的关系。
1 月27 日, 红色赤潮藻丰度上升。随后的28日, 红色赤潮藻丰度猛增1 个数量级, 而球形棕囊藻丰度快速下降且囊体数量缩减为27 日的1/2, 囊体直径并未观察到明显的变化。由于未观察到其他环境因子的剧烈波动足以引起球形棕囊藻丰度如此剧烈的下降, 因此生物因素, 即红色赤潮藻藻华的暴发很可能是本次球形棕囊藻藻华衰亡的主要原因。红色赤潮藻是一种混合营养型甲藻, 可通过摄食其他微型生物获取所需的营养物质(Sanders,1991)。据报道, 红色赤潮藻能够摄食聚球藻(Synechococcus)(Jeong et al, 2005), 但是否能够摄食棕囊藻尚未知晓。红色赤潮藻能够分泌胞外毒素裂解共存浮游植物, 包括球形棕囊藻(黄博珠, 2016)。共培养结果表明红色赤潮藻对球形棕囊藻的生长起到抑制作用, 且抑制率随着红色赤潮藻细胞密度的上升而提高, 而红色赤潮藻自身生长率受到共培养作用显著提高(黄博珠, 2016)。这为推演本次球形棕囊藻衰亡潜在原因提供了基础证据, 可能情形如下:红色赤潮藻通过释放胞外毒素裂解囊体, 获取大量营养物质, 由此快速增长, 与之增长的毒素进而使得球形棕囊藻藻华整体消亡。当29 日球形棕囊藻丰度降低到低水平时, 红色赤潮藻丰度也迅速回落,二者丰度在后续时间均处于较低水平, 即使此时水体中硝酸盐和铵盐仍然充裕。这反映了二者复杂的关系, 即球形棕囊藻藻华暴发为红色赤潮藻藻华提供条件, 红色赤潮藻反过来促使球形棕囊藻的消亡,随后红色赤潮藻藻华也无法维持, 开始共同消退。
3.2 球形棕囊藻藻华对碳循环作用
藻华发生期间, 沿岸海水的pH 从7.6 逐渐提高至8.1, 说明球形棕囊藻旺盛的光合作用, 吸收大量无机碳进入水体。在藻华衰退期, 海水中溶解氧浓度下降了近2mg·L-1, 表明棕囊藻有机物的迅速分解和海洋细菌的高度活性导致了氧气的减少。这些现象均说明了棕囊藻藻华发生对区域海区有机碳循环的影响显著。按照Smith 等(2014)的模型计算, 球形棕囊藻囊体平均含碳量达到20.6μg, 本次调查囊体最高丰度达到 69colonies·L-1, 总生物量约为1.4mgC·L-1。在目前发现的棕囊藻藻华生物量报道中, 约94%棕囊藻生物量低于1mgC·L-1, 低于本次研究报道的碳生物量。球形棕囊藻藻华的发生可能更加显著地影响广东沿海的碳循环过程。
4 结论
大鹏湾球形棕囊藻藻华发生过程中出现了硅藻(中肋骨条藻)—定鞭藻(球形棕囊藻)—甲藻(红色赤潮藻)的藻华演替。球形棕囊藻藻华的发生受多种物理化学和生物因素的综合影响, 其中主要理化因素为铵盐和硝酸盐, 水体扰动也可能有利于藻华的形成。此外, 球形棕囊藻相对于硅藻的竞争优势也可能起着重要作用。红色赤潮藻藻华的发生可能是球形棕囊藻藻华消亡的原因。
