类风湿关节炎滤泡调节性T细胞与血清免疫球蛋白及疾病活动度相关性研究〔1〕
2022-06-09高强王佩佩牛腾耀王霞詹静慧张艳丽
高强,王佩佩,牛腾耀,王霞,詹静慧,张艳丽
(宁夏医科大学基础医学院,宁夏 银川 750004)
类风湿关节炎(RA)是一种以关节滑膜的慢性炎症为基本病理改变的全身性自身免疫疾病,临床上多表现为对称性、持续性、进行性的小关节受累,并最终导致关节畸形和功能丧失[1]。28关节疾病活动性评分(DAS28)以28个关节[包括双手近端指关节(10个)、双手掌指关节(10个)、双腕关节(2个)、双肘关节(2个)、双肩关节(2个)、双膝关节(2个)]计分,通过测量患者压痛关节数、肿胀关节数及血沉(ESR)来计算,可以较好地反映RA患者的疾病活动度[2]。同时,RA患者血清中血清免疫球蛋白(Ig)M,IgG,IgA水平均高于正常人,提示体液免疫功能紊乱在RA的发生发展中起到了重要作用[3]。这些免疫球蛋白多为自身抗体,如类风湿因子(RF)等,会导致RA患者出现关节肿痛、骨质破坏,甚至发生关节畸形[4]。滤泡调节性T细胞(Tfr)是一种定位于淋巴滤泡生发中心(GC)的CD4+T细胞,主要通过抑制滤泡辅助性T(Tfh)细胞以及GC中B细胞的功能来发挥其负向调节体液免疫的作用,从而维持机体免疫稳态[5]。RA目前的主要治疗方法是长期服用抗风湿药物,尚无根治办法。已经有研究[6-9]显示Tfr细胞的数目和功能异常与多种自身免疫性疾病有关[6]。本实验拟通过研究RA患者外周血Tfr细胞与血清免疫球蛋白水平及疾病活动度的相关性,讨论Tfr细胞在RA中发挥的作用,为临床上干预RA的发展提供新的方向。
1 材料与方法
1.1 材料
选择2020年7月—2021年7月30 例在宁夏医科大学总医院风湿免疫科就诊的RA患者,均符合2010年美国风湿病学会(ACR)/欧洲风湿病联盟(EULAR)制定的诊疗标准[10]。RA诊断标准:就诊前6个月不合并其他感染性疾病和自身免疫病;就诊前未服用过激素及抗风湿类药物。患者年龄(53.7±11.9) 岁;男15 例,女15 例;检测血清IgM为(1.7±1.2) g/L,IgG为(17.3±6.4) g/L,IgA为(3.4±1.5) g/L。同时纳入30名健康体检者为对照组。纳入标准:近期无感染、发热;无自身免疫病及肿瘤、艾滋病、结核等慢性感染性疾病病史。健康对照组年龄(49.6±10.6) 岁,男15 例,女15 例。
Accuri C6型流式细胞仪购自美国BD公司;人外周血淋巴细胞分离液购自北京索莱宝科技有限公司;多甲藻黄素-叶绿素蛋白-花青素5.5(PerCP-Cy5.5)标记的抗人CD4单克隆抗体(CD4-PerCP-Cy5.5)、Alexa Fluor 488(AF488)标记的抗人CXC趋化因子受体5(CXCR5)单克隆抗体(CXCR5-AF488)购自美国BD公司;别藻蓝蛋白(APC)标记的抗人叉头盒P3(FOXP3)单克隆抗体(FOXP3-APC)购自美国eBioscience公司。
1.2 方法
1.2.1 RA患者分组
根据DAS28值,将RA患者分为高度活动组(DAS28>5.1,16 例)和轻中度活动组(DAS28≤5.1,14 例)[11]。
1.2.2 标本采集与处理
采集RA患者和健康对照者的新鲜全血,乙二胺四乙酸二钠(EDTA)抗凝。用等体积磷酸缓冲液(PBS)稀释全血后,加入人外周血淋巴细胞分离液分离外周血单个核细胞(PBMC),再用PBS缓冲液洗涤。
1.2.3 流式细胞术检测外周血Tfr细胞比例
取刚分离的PBMC 2×106个,顺序加入CD4-PerCP-Cy5.5,CXCR5-AF488和FOXP3-APC溶液各3 μL,在室温且避光的条件下孵育30 min后,用PBS缓冲液洗涤两次,上机检测。
1.3 统计学方法
2 结 果
2.1 RA组和健康对照组外周血Tfr细胞比例比较
根据流式细胞术结果,外周血中的Tfr细胞比例RA组为(0.77±0.07)%,健康对照组为(1.27±1.66)%,RA组与健康对照组相比明显下降,差异有统计学意义(t=-15.139,P<0.05,见图1)。
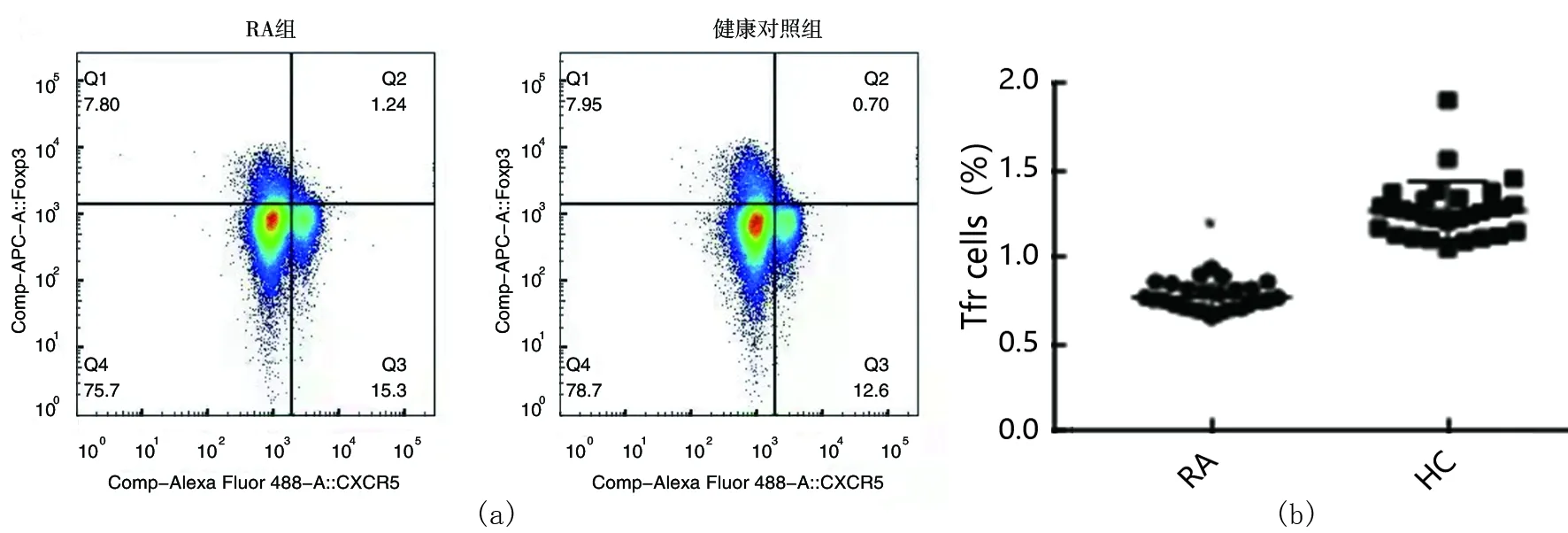
(a):两组外周血Tfr细胞比例流式细胞术检测;(b):两组外周血Tfr细胞比例的半定量分析,与健康对照组相比较,P<0.05
2.2 RA组高度活动组与轻中度活动组Tfr细胞比例比较
RA组中,Tfr细胞比例高度活动度组为(0.74±0.44)%,轻中度活动组为(0.81±0.74)%,高度活动度组低于轻中度活动组,差异有统计学意义(t=-3.523,P<0.05)。
2.3 RA患者外周血Tfr细胞比例与血清免疫球蛋白水平的相关性
Spearman相关性分析结果显示,RA患者外周血Tfr细胞比例与血清IgM,IgG,IgA水平均呈负相关(r=-0.4876,r=-0.3961,r=-0.4053,见图2)。

(a):Tfr细胞比例与血清IgM水平相关性;(b):Tfr细胞比例与血清IgG水平相关性;(c):Tfr细胞比例与血清IgA水平相关性
3 讨 论
RA发病机制复杂,病程迁延不愈,以关节、滑膜的慢性炎症为主要特征,发生软骨和骨的损害,而且还伴随全身多系统症状,包括心血管系统、呼吸系统、神经系统、血液系统等[12]。本研究发现,RA患者外周血Tfr细胞比例相比于健康对照组显著下降;在RA组中,高度活动组Tfr细胞比例低于轻中度活动组,且外周血Tfr细胞比例与血清免疫球蛋白水平呈负相关,说明Tfr细胞数量减少在RA大量自身抗体的产生及疾病的发展中起到了重要作用。自身抗体是多种自身免疫性疾病的病理产物和血清学标志物。自身抗体的产生可导致免疫复合物在各脏器中沉积,激活补体系统和其他免疫细胞进而引起全身不可控的自身免疫反应,造成严重的组织损伤。此外,自身抗体还可以通过抗体依赖细胞介导的细胞毒作用(ADCC)直接损伤靶组织,自身抗体水平越高,疾病的症状往往越严重[13]。研究[14]表明,Tfr细胞的数量减少或功能障碍导致的过度Tfh细胞应答和GC反应会刺激自身抗体的产生。Tfh细胞和Tfr细胞均为CD4+T细胞亚群,二者关系密切,在表型上有许多类似之处,均表达CXCR5、B细胞淋巴瘤因子-6(Bcl-6)、诱导性共刺激分子(ICOS)、程序性死亡蛋白-1(PD-1)。但是由于Tfr细胞起源于外周的自然调节性T(nTreg)细胞,所以其表型更接近于nTreg细胞。因此,Tfr细胞除表达上述的分子以外,还表达FOXP3、糖皮质激素诱导的肿瘤坏死因子受体(GITR)、细胞毒性T淋巴细胞相关抗原4(CTLA-4)等[15]。Tfh细胞可以分泌CXC趋化因子配体13(CXCL13),其与B细胞表面及自身表达的受体CXCR5结合,招募B细胞和自身迁移至GC中,并通过其表面表达的多种信号分子促进GC中B细胞的成熟、活化以及抗体的产生[16]。研究[17]表明,体液免疫中B细胞的数量和抗原亲和力决定了其接受Tfh细胞辅助的能力,而自身反应性B细胞可能会过多地获得Tfh细胞辅助,逃脱免疫耐受,进而导致自身抗体的产生。Tfr细胞则在GC反应的负向调控中发挥着重要的作用,其通过抑制Tfh细胞和GC的B细胞来抑制体液免疫。Tfr发挥作用主要是通过抑制B细胞活化的下游效应,包括免疫球蛋白类别转换(CSR)和体细胞高频突变等[18-21]。Tfr发挥其效应依赖多种途径,例如,Tfr细胞可以通过其表面表达的抑制性分子CTLA-4与B细胞以及Tfh细胞表面的受体结合,直接抑制B细胞和Tfh细胞的发育;此外,Tfr细胞还抑制白细胞介素-4(IL-4)的分泌,而IL-4则在GC反应和抗体产生的过程中发挥着重要作用。另有,Tfr细胞还可通过分泌抑制性的细胞因子如IL-10、转化生长因子-β(TGF-β)等抑制GC反应和抗体的产生[22-23]。因此,Tfr细胞的数量减少很可能引起体液免疫功能紊乱,导致大量自身抗体的产生,是RA重要的发病基础[24-25],并且可能与疾病的活动度有关。
综上所述,Tfr细胞数量减少,可能是引起RA大量自身抗体产生的一个重要危险因素,并且与疾病的发展有关。其机制可能是Tfr细胞通过抑制Tfh细胞和GC中B细胞的功能来发挥负向调节体液免疫功能的作用。但其发挥作用的信号通路和具体分子机制仍有待于进一步研究证实,以期具体阐明Tfr细胞在RA中的作用。
