番鸭细小病毒YL08株VP2和VP3蛋白的原核表达及免疫反应性
2022-06-09李静谢鹏宇于天飞柳芳芳尹海畅于志丹
李静 谢鹏宇 于天飞 柳芳芳 尹海畅 于志丹
摘要:为获得番鸭细小病毒(muscovy duck parvovirus,MDPV)重组结构蛋白VP2、VP3,本研究以含有MDPV YL08株VP1基因的重组载体pET-32a-VP1为PCR扩增模板,分别亚克隆VP2、VP3基因。构建了重组载体 pGEX-6p-VP2、pGEX-6p-VP3并将它们转化至大肠杆菌Rosetta(DE3)中,分别构建了重组菌株pGEX-6p-VP2/Rosetta(DE3)和pGEX-6p-VP3/Rosetta(DE3)。2种重组菌株在IPTG诱导下分别获得了重组蛋白GST-VP2和GST-VP3,分子质量分别为91、86 ku。Western blot分析结果表明,重组蛋白GST-VP2和GST-VP3可特异性结合GST-tag单克隆抗体和MDPV感染番鸭血清,免疫反应性良好。Dot-ELISA比较分析结果表明,在等质量条件下,GST-VP2的免疫反应性强于GST-VP3。
关键词:番鸭细小病毒;VP2;VP3;原核表达;免疫反应性
中图分类号: S852.65+7 文献标志码: A
文章编号:1002-1302(2022)09-0169-04
番鸭细小病毒(Muscovy duck parvovirus,MDPV)主要侵害3周龄以内的雏番鸭,引起番鸭细小病毒病,国内亦称番鸭“三周病”[1-2]。我国动物医学专家林世棠于1991年最先发现并报道了该病发生[3]。番鸭细小病毒病发病率为40%~50%,死亡率在50%~80%之间,对番鸭饲养业的危害极大[4]。MDPV和亲缘关系密切的鹅细小病毒(goose parvovirus,GPV)一同被列为细小病毒科(Parvoviridae)依赖病毒属(Dependovirus)雁形目依赖细小病毒1(Anseriform dependoparvovirus 1)[5]。MDPV是1 种单链DNA病毒,无囊膜,基因组大小为5 132 nt,两端为末端倒置重复序列(ITR)[6]。MDPV基因组有左、右2个开放阅读框,以重叠基因的形式利用转录本可变剪接方式分别编码转译非结构蛋白(NS)和结构蛋白(VP)。已有研究表明,NS参与病毒复制,调控病毒基因表达[7]。VP1、VP2和VP3等3 种结构蛋白以约1 ∶1 ∶8的比例组装病毒衣壳[8]。已有研究表明,VP2为重要免疫原性蛋白[9]。本研究通过原核表达系统表达获得MDPV YL08株VP2、VP3重组蛋白,以期为MDPV病毒相关蛋白功能研究奠定物质基础。
1 材料与方法
1.1 菌种和质粒
含有MDPV YL08株全长VP1基因的重组载体pET-32a-VP1[10]、原核表达载体pGEX-6p-1、感受态大肠杆菌DH5α和Rosetta(DE3)由齐齐哈尔大学生命科学与农林学院动物免疫学研究室制备或保存。
1.2 主要分子生物学试剂
T 4 DNA连接酶、BamHⅠ和XhoⅠ限制性核酸内切酶购自宝生物工程(大连)有限公司;质粒提取试剂盒、DNA胶回收试剂盒购自Omega公司。辣根过氧化物酶(HRP)标记的GST-tag单克隆抗体购自Thermo Fisher公司。HRP-兔抗鸭IgY IgG(H+L)购自上海铭修生物科技有限公司。
1.3 试验时间与地点
试验于2020年10月至2021年2月在齐齐哈尔大学生命科学与农林学院动物免疫学研究室进行。
1.4 引物设计
参照MDPV YL08株VP1基因序列(GenBank登录号:KU589295),利用Primer Premier 5.0软件设计了3条特异性引物,由哈尔滨博仕生物技术有限公司合成。
VP2F:5′-CGCGGATCCACGGCTCCTGCTAAAAAG-3′(划线处为BamHⅠ位点);
VP3F:5′-CGCGGATCCATGGCAGAGGGAGGAAG-3′(划线处为BamHⅠ位点);
VPR:5′-GGCCGCTCGAGTTACAGATTCTGAGTC-3′(划线处为XhoⅠ位点)。
1.5 基因片段扩增及回收纯化
VP2基因PCR反应体系(50 μL):2 μL 1 ∶10 000稀释的pET-32a-VP1,4 μL dNTPs,5 μL 10×PCR Buffer,1 μL 上游引物VP2F(25 pmol/μL),1 μL 下游引物VPR(25 pmol/μL),1 μL ExTaq酶(5 U/μL),36 μL 无菌去离子水。PCR扩增程序为:94.0 ℃ 5 min;94.0 ℃ 90 s,30.0 ℃ 90 s,72.0 ℃ 3 min,35 个循环;72.0 ℃ 7 min;4.0 ℃终止反应。
VP3基因PCR反应体系(50 μL):2 μL 1 ∶10 000稀释的pET-32a-VP1,4 μL d NTPs,5 μL 10×PCR Buffer,1 μL 上游引物VP3F(25 pmol/μL),1 μL 下游引物VPR(25 pmol/μL),1 μL ExTaq酶(5 U/μL),36 μL 无菌去离子水。PCR扩增程序为:94.0 ℃ 5 min;94.0 ℃ 90 s,57.0 ℃ 90 s,72.0 ℃ 3 min,35 个循环;72.0 ℃ 7 min,4.0 ℃终止反应。
上述2种PCR扩增产物分别通过琼脂糖凝胶电泳检测。按照Omega公司DNA胶回收试剂盒说明书操作流程回收纯化VP2、VP3基因PCR扩增片段。
1.6 重组载体pGEX-6p-VP2和pGEX-6p-VP3的构建
胶回收BamHⅠ和XhoⅠ双酶切后的VP2、VP3基因PCR扩增片段和表达载体pGEX-6p-1。分别在含有VP2/pGEX-6p-1和VP3/pGEX-6p-1的连接体系中加入T 4 DNA连接酶,于16 ℃的温度下连接过夜。连接产物VP2/pGEX-6p-1和VP3/pGEX-6p-1分別转化DH5α。挑取单个转化后的DH5α菌落于LB液体培养基(氨苄青霉素,100 μg/mL)中,37 ℃温度下培养14 h,按照Omega公司质粒提取试剂盒说明书操作流程提取质粒。酶切鉴定并测序验证外源基因插入的准确性。获得的重组载体分别命名为pGEX-6p-VP2、pGEX-6p-VP3。B34FDA31-1A06-492A-ACC5-3C31F209EC5F
1.7 重组蛋白GST-VP2和GST-VP3的诱导表达
分别将pGEX-6p-VP2和pGEX-6p-VP3转化感受态大肠杆菌Rosetta(DE3),制备重组菌pGEX-6p-VP2/Rosetta(DE3)、pGEX-6p-VP3/Rosetta(DE3)。按照1 ∶100的比例分别将pGEX-6p-VP2/Rosetta(DE3)、pGEX-6p-VP3/Rosetta(DE3)接种于50 mL LB液体培养基(氨苄青霉素,100 μg/mL)的中,220 r/min、37 ℃温度下继续培养至适宜的诱导表达浓度(D 600 nm=0.5~0.6)时,加入IPTG使其在整个诱导体系中的浓度为 1.0 mmol/L,37 ℃温度下继续培养4 h,间隔1 h取样。各个时间段获得的菌液样品以8 000 g/min离心5 min,弃去上清液。以菌体沉淀湿质量计算,按照30 μL/mg的比例用PBS重悬菌体沉淀。通过SDS-PAGE方法检测重组蛋白GST-VP2和 GST-VP3 表达情况。
1.8 重组蛋白GST-VP2和GST-VP3的纯化及鉴定
按照文献[11]所述方法分别纯化重组蛋白 GST-VP2 和GST-VP3,Bradford法测定蛋白浓度[12]。纯化的GST-VP2和GST-VP3转印到硝酸纤维素膜上。将含有转印蛋白的膜片置于5%脱脂乳溶液中,于4 ℃温度下封闭过夜。37 ℃温度下置于PBS(1 ∶100)稀释的HRP标记抗GST-tag单克隆抗体溶液中孵育2 h,PBST溶液洗涤3 次后以4-CN作为酶促反应底物进行显色。
1.9 重组蛋白GST-VP2、GST-VP3的免疫反应性
按照“1.8”节中的操作方法对重组蛋白GST-VP2和GST-VP3进行转印和封闭。封闭后的含有转印蛋白的硝酸纤维素膜在37 ℃温度下依次置于PBS稀释(1 ∶200)的MDPV阳性血清中作用2 h、PBS稀释(1 ∶1 000)的HRP-兔抗鸭IgY IgG(H+L)中作用1 h,PBST溶液洗涤3 次后以4-CN作为酶促反应底物进行显色。
1.10 Dot-ELISA比较重组蛋白GST-VP2和 GST-VP3的免疫反应性
将GST-VP2和GST-VP3分别以1 000、100、10、1 ng/点的包被量直接点于硝酸纤维素膜上,一抗使用PBS稀释(1 ∶200)MDPV阳性血清,酶标二抗使用PBS稀释(1 ∶1 000)的HRP-兔抗鸭IgY IgG(H+L),具体操作步骤参照文献[13]进行。
2 结果与分析
2.1 MDPV YL08株VP2、VP3基因的PCR扩增
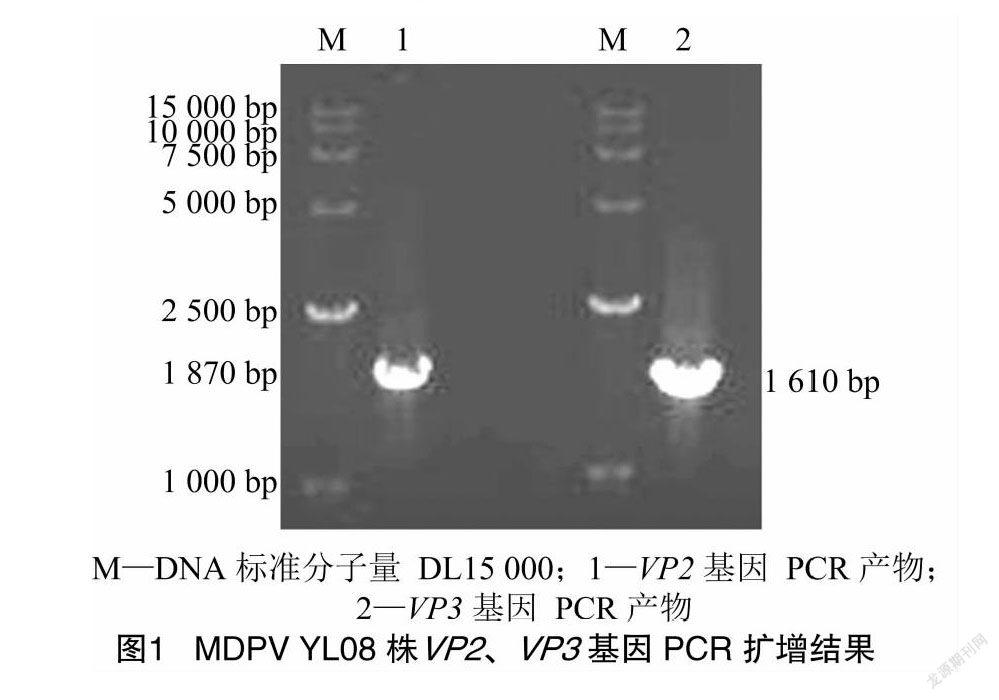
通过PCR扩增,分别亚克隆获得了与预期大小符合的1 870 bp(VP2)和1 610 bp(VP3)的DNA片段,PCR的琼脂糖凝胶电泳检测结果见图1。
2.2 重组载体pGEX-6p-VP2、pGEX-6p-VP3的酶切鉴定
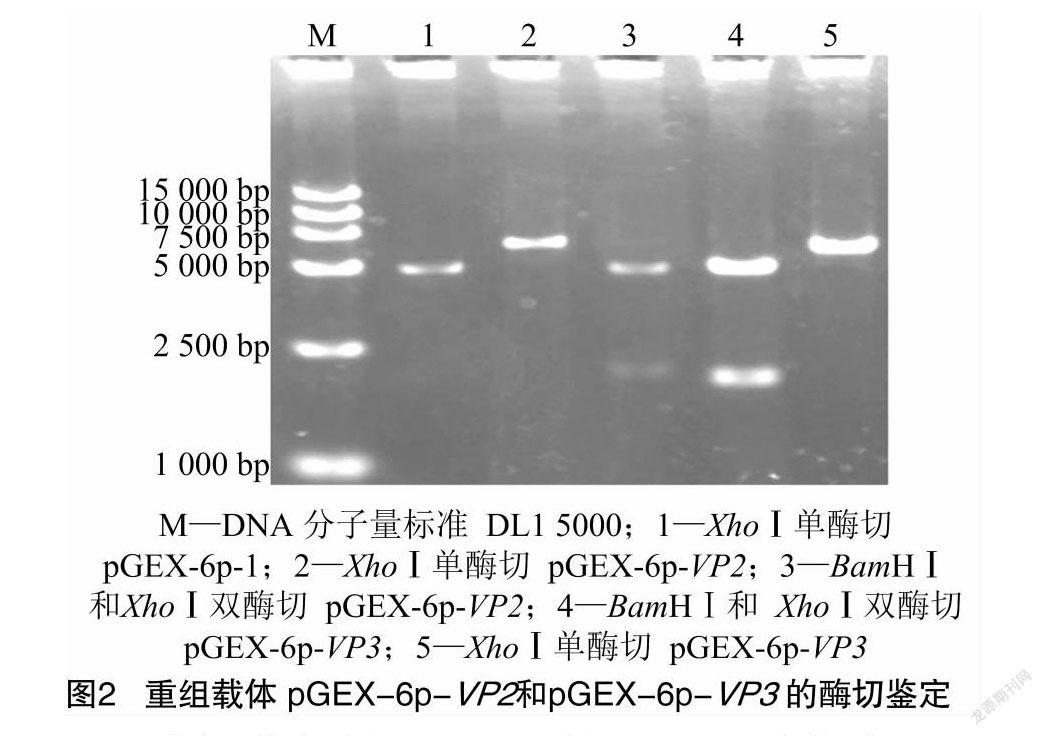
酶切鉴定结果表明,pGEX-6p-VP2经XhoⅠ酶切得到约6 800 bp的条带(表达载体pGEX-6p-1和VP2基因片段大小之和),经BamHⅠ和XhoⅠ酶切得到约4 900 bp载体条带和1 900 bp的VP2基因片段条带;单酶切pGEX-6p-VP3得到约6 500 bp的条带(表达载体pGEX-6p-1和VP3基因片段大小之和)、双酶切pGEX-6p-VP3得到约4 900 bp的载体条带和1 600 bp的VP3基因片段。由图2可知,上述酶切产物琼脂糖凝胶电泳结果与预期相符。测序结果表明,VP2、VP3基因已正确插入至原核表达载体pGEX-6p-1中。
2.3 重组蛋白GST-VP2、GST-VP3的表达
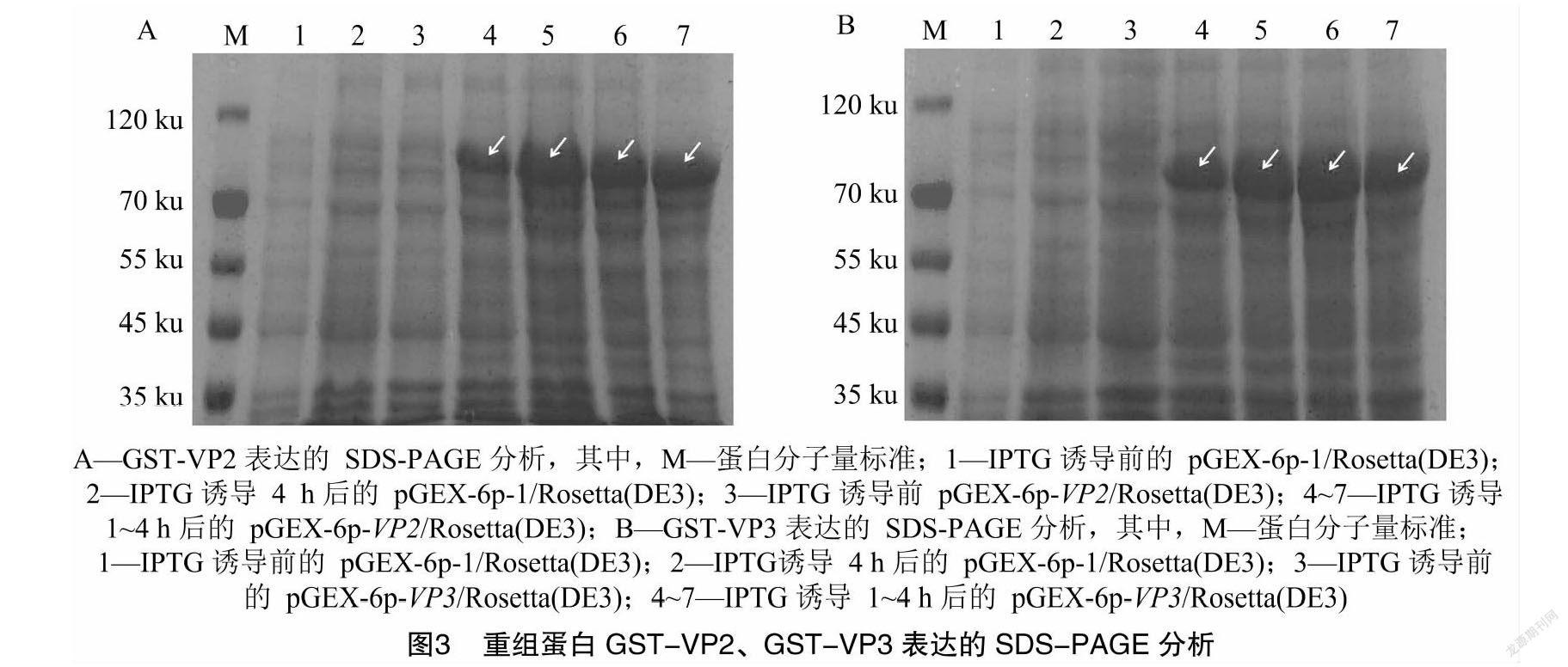
SDS-PAGE结果,由图3可知,IPTG诱导后,pGEX-6p-VP2/Rosetta(DE3)和pGEX-6p-VP3/Rosetta(DE3)可分别表达出符合预期大小的91 ku和86 ku的目的蛋白条带(白色箭头所示)。
2.4 重组蛋白GST-VP2、GST-VP3的纯化及鉴定
由GST-VP2和GST-VP3纯化结果(图4),Bradford法检测GST-VP2和GST-VP3的浓度分别为0.77、0.63 mg/mL。GST-VP2和GST-VP3可与HRP标记抗GST-tag单克隆抗体特异性结合,说明获得的2种蛋白为融合于GST标签的重组蛋白。
2.5 重组蛋白GST-VP2、GST-VP3的免疫反应性
由Western blot结果(图5)可知,GST不与MDPV感染番鸭血清结合,硝酸纤维素膜对应位置无代表阳性反应的深色条带;重组蛋白GST-VP2、GST-VP3可与MDPV阳性血清特异性结合,硝酸纤维素膜对应位置上显示出明显深色条带,免疫反应性良好。
2.6 Dot-ELISA比较重组蛋白GST-VP2和 GST-VP3的免疫反应性
重组蛋白GST-VP2和GST-VP3在抗原包被量为1 000、100、10 ng/点时,均可与MDPV阳性血清发生特异性的结合,形成清晰的阳性反应斑点;抗原包被量在1 ng/点时,GST-VP3几乎无可见斑点,GST-VP2仍可见阳性反应斑点(图6) ,表明重组蛋白GST-VP2的免疫反应性强于GST-VP3。
3 讨论与结论
MDPV YL08株为2008年笔者所在实验室分离鉴定的1株新型MPDV,重组分析表明其可能起源于不同的MDPV之间的重组[14]。这些新型重组毒株的出现,提示我们在临床上应持续监测、探索番鸭细小病毒病的流行病学及临床进化。Wang等通过原核系统表达获得了MDPV VP1蛋白氨基端的含有198个氨基酸的重组蛋白,并以此重组蛋白作为检测抗原通过Western blot检测了临床血清样本,检测结果表明,能与该重组蛋白特异性结合的抗体最早出现于番鸭感染MDPV之后的第6周[15]。据此认为,基于VP蛋白的诊断抗原可用于检测MDPV晚期感染。通过杆状病毒/昆虫细胞表达的MDPV VP2和VP3蛋白亦具有良好的抗原性,可作为诊断抗原[16]。真核表达系统表达的蛋白相较于原核表达系统表达的蛋白具有更为完善的糖基化等修饰过程,但表达试验操作步骤复杂、成本较高,如果原核表達的蛋白就能满足免疫反应性等要求,采用原核表达系统表达目的蛋白更具有时间成本和经济成本优势。Dot-ELISA分析中,重组蛋白GST-VP2的免疫反应性强于GST-VP3,这可能是因为VP2蛋白比VP3蛋白的分子量更大,理论上含有更多的抗原表位。本研究获得了原核表达的抗原性良好的MDPV 重组VP2、VP3蛋白,可为MDPV病毒蛋白功能研究奠定一定的物质基础。B34FDA31-1A06-492A-ACC5-3C31F209EC5F
參考文献:
[1]Shen H Q,Huang J F,Yan Z Q,et al. Isolation and characterization of a recombinant Muscovy duck parvovirus circulating in Muscovy ducks in South China[J]. Archives of Virology,2020,165(12):2931-2936.
[2]吴 萌,朱善元,吴海涛,等. 番鸭细小病毒VP3基因在昆虫细胞中的表达与鉴定[J]. 江苏农业科学,2018,46(21):58-60.
[3]林世棠,郁晓岚,陈炳钿,等. 一种新的雏番鸭病毒性传染病的诊断[J]. 中国畜禽传染病,1991,13(2):25-26.
[4]袁佐清,吴庆海,曹 铮,等. 番鸭细小病毒病近年研究进展[J]. 黑龙江畜牧兽医,2020(15):39-42.
[5]Wang J Y,Mi Q L,Wang Z X,et al. Sole recombinant Muscovy duck parvovirus infection in Muscovy ducklings can form characteristic intestinal embolism[J]. Veterinary Microbiology,2020,242:108590.
[6]Wang J Y,Wang Z X,Jia J Y,et al. Retrospective investigation and molecular characteristics of the recombinant Muscovy duck parvovirus circulating in Muscovy duck flocks in China[J]. Avian Pathology,2019,48(4):343-351.
[7]Dong J W,Bingga G L,Sun M H,et al. Application of high-resolution melting curve analysis for identification of Muscovy duck parvovirus and goose parvovirus[J]. Journal of Virological Methods,2019,266:121-125.
[8]于天飞,谢鹏宇,尹海畅,等. 脊椎动物细小病毒衣壳结构研究进展[J]. 黑龙江畜牧兽医,2020(19):25-30,167.
[9]Tu M,Liu P,Liu F,et al. Construction of expression vectors of capsid proteins from goose parvovirus and investigation of the immunogenicity[J]. Acta Virologica,2018,62(4):415-423.
[10]于天飞,董慧莹,黎 明,等. 番鸭细小病毒YL08株VP1基因的克隆及序列分析[J]. 畜牧与兽医,2016,48(7):40-43.
[11]高慎阳,查恩辉,王 珅,等. 一种“高性价比”切胶纯化原核表达蛋白的方法[J]. 中国农学通报,2010,26(22):24-26.
[12]汪家政,范 明. 蛋白质技术手册[M]. 北京:科学出版社,2000.
[13]于天飞,董慧莹,张喜文,等. 猪传染性胃肠炎病毒血清抗体Dot-ELISA检测方法的建立[J]. 中国预防兽医学报,2018,40(10):956-959.
[14]Yu T F,Li M. Identification of recombination among VP1 gene of Muscovy duck parvovirus from the Mainland of China[J]. Veterinary Microbiology,2016,195:78-80.
[15]Wang C Y,Shieh H K,Shien J H,et al. Expression of capsid proteins and non-structural proteins of waterfowl parvoviruses in Escherichia coli and their use in serological assays[J]. Avian Pathology,2005,34(5):376-382.
[16]le Gall-Reculé G,Jestin V,Chagnaud P,et al. Expression of Muscovy duck parvovirus capsid proteins (VP 2 and VP 3) in a baculovirus expression system and demonstration of immunity induced by the recombinant proteins[J]. The Journal of General Virology,1996,77:2159-2163.B34FDA31-1A06-492A-ACC5-3C31F209EC5F
