不同调节剂浸种对苦苣菜种子萌发及幼苗生长的影响
2022-06-09郭爱华曹媛
郭爱华 曹媛


摘要:研究温度、浸种时间、赤霉素(GA 3)用量、褪黑素用量和2,4-D溶液用量对苦苣菜种子萌发特性及幼苗生长生理的影响,为苦苣菜选择良好的萌发和生长条件。设置不同温度、浸种时间、生长调节剂浓度处理苦苣菜种子,研究对苦苣菜发芽率、发芽势等发芽指标及苗质量、根长、苗高等生长生指标,以及对脯氨酸含量、淀粉酶活性、过氧化物酶(POD)活性等生理代谢的影响。结果表明,25 ℃、浸种6 h时,苦苣菜的种子萌发指标及幼苗生长状况显著高于其他试验组;200 mg/L GA 3溶液对苦苣菜种子萌发和幼苗生长显著有效;100 μmol/L褪黑素溶液可显著促进苦苣菜细胞生理活性物质含量的增加,脯氨酸含量、淀粉酶活性、POD活性分别较对照组高20.93 μg/g鲜质量、2.28 U、26.66 U/(g·min);10 mg/L 2,4-D溶液可显著促进苦苣菜种子萌发和幼苗生理代谢。苦苣菜种子最适宜的萌发温度是25 ℃,最适宜的浸种时间是6 h;3种调节剂都不同程度地对苦苣菜种子萌发及幼苗生长具有促进作用,其中 200 mg/L GA 3、100 μmol/L褪黑素、10 mg/L 2,4-D溶液处理的效果最显著。
关键词:苦苣菜;生长调节剂;种子萌发;幼苗;赤霉素;褪黑素;2,4-D溶液
中图分类号: S636.904+.1 文献标志码: A
文章编号:1002-1302(2022)09-0148-06
苦苣菜(Sonchus oleraceus L.),别称苦菜,属菊科苦苣属,是纯天然、药食同源的野生草本植物[1],含有多种有效活性成分,如维生素C、类胡萝卜素、短链脂肪酸、多糖、芹菜素、木樨素及其衍生苷类[2-3],具有较高的营养价值。苦苣菜性微寒味苦,其嫩茎叶可凉食,是临床上常用的清热解毒、消暑保健、防治贫血、杀菌消炎、提高免疫力的药物[4],近年来受到较多学者的关注。Widderick等研究发现,苦苣菜喜光,暗黑可使其发芽率降低72%[5]。Ting等在2016年发表的研究发现,苦苣菜提取物对HepG-2、K562等肿瘤细胞有抑制作用,可防治癌症[6]。苦苣菜的根、叶有较强的抗氧化活性[1],具有抗溃疡[7]、镇痛的效果,对糖尿病、心血管疾病有一定的防治作用[8]。苦苣菜不仅可作为蔬菜食用,还可作为药剂开发,由于其有抗氧化及抑菌效果,还可作为化妆品添加剂及果蔬采后保鲜剂。目前,人们对苦苣菜的喜爱程度越来越深,对其需求量也相应增长。赤霉素(GA 3)、褪黑素和2,4-二氯苯氧乙酸(2,4-D)等调节剂对植物種子萌发、幼苗生长有一定影响,但对苦苣菜的作用尚未见报道。
本研究以苦苣菜种子为材料,研究温度、浸种时间、GA 3、褪黑素、2,4-D等调节剂对苦苣菜种子萌发及幼苗生长生理代谢的影响,从而得出较适宜苦苣菜的生长条件,为苦苣菜的人工开发、大量种植提供技术方面的支持。由于野生苦苣菜资源有限,且晚秋及冬季缺乏,因此有关苦苣菜的培养及开发研究显得极其重要。本研究旨在探讨不同条件因素对苦苣菜种子萌发及幼苗生长生理的影响,找寻最适宜苦苣菜的生长条件,为提高苦苣菜的产率提供参考。
1 材料与方法
1.1 试验材料
苦苣菜种子品牌为琪龙特选,试验为2019年在吕梁学院生命科学系细胞生物学实验室进行。
1.2 试验方法
1.2.1 苦苣菜种子萌发和幼苗的培养 将苦苣菜种子浸泡在装有蒸馏水的烧杯中,浸泡一定时间后按间距摆放在有2层湿纱布的培养皿中,每皿放30粒,在生化培养箱中,使种子见光催芽、长成幼苗。
1.2.2 发芽温度的测定 将摆放好的种子分别置于15、20、25、30、35 ℃培养箱中,根据发芽指标测定苦苣菜种子的最适发芽温度,每组试验重复3次。
1.2.3 浸种时间的测定 设置5组浸种时间,分别为1、6、12、18、24 h。浸种后将苦苣菜在“1.2.2”节中所得最适温度下培养,每组试验重复3次。
1.2.4 GA 3、褪黑素、2,4-D溶液的配制 分别配制质量浓度为50、100、150、200、250、300 mg/L的GA 3溶液,质量浓度为50、100、150、200、250 μmol/L的褪黑素溶液,质量浓度为0.5、1、10、100、1 000 mg/L 的2,4-D溶液,将苦苣菜种子浸泡在不同浓度的溶液中,用筛选出的最佳浸种时间浸种,取出苦苣菜种子后,用清水冲洗若干次并用吸水纸吸干种子表面的水分,置于“1.2.2”节中所得最适温度下培养,以清水处理作为对照,每组试验重复3次。
1.3 相关指标的测定方法
发芽率、发芽势、发芽指数(GI)、活力指数的测定参考孔佳茜等的方法[9]。
种子培养10 d后,选取长势一致的3株幼苗,测量平均根长、苗高[9]。
脯氨酸含量的测定采用茚三酮显色法;淀粉酶活性的测定采用硝基水杨酸法[10]。
过氧化物酶(POD)活性的测定采用愈创木酚法[11]。
数据统计使用Excel 2010,作图使用GraphPad Prism 8.0.2,数据分析使用SAS 8.0。
2 结果与分析
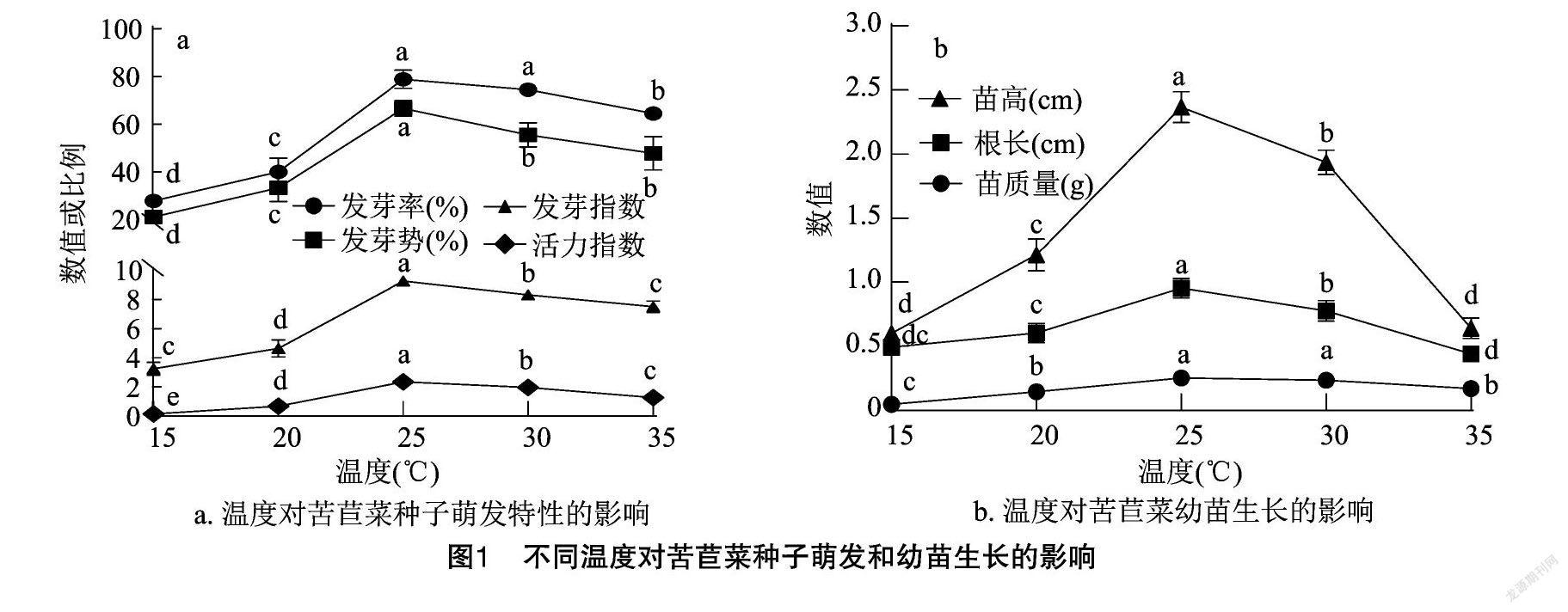
2.1 温度对苦苣菜种子萌发及幼苗生长的影响
如图1-a所示,在15~35 ℃的培养温度处理下,除25、30 ℃处理苦苣菜种子的发芽率,30、35 ℃处理的发芽势差异不显著外,其他各组发芽率、发芽势、发芽指数和活力指数差异显著(P<0.05)。在25 ℃的培养温度处理下,苦苣菜种子的发芽率、发芽势、发芽指数和活力指数均达到了最大值,分别为78.8%、70.0%、9.25、2.3。如图1-b所示,在15~35 ℃的培养温度处理下,苦苣菜苗高、根长、苗质量呈先上升后下降的趋势,在培养温度为25 ℃时达到最高值,当培养温度为25、30 ℃时,苗质量差异不显著,但与其他各组间在苗高、根长、苗质量方面的差异均显著(P<0.05)。随着温度继续升高,各指标均随之降低,并影响幼苗发育。综上分析可知,苦苣菜种子较适宜的发芽及培养温度为25 ℃。5C0A1166-DC98-4EA5-8E9E-C74A9947F4B0
2.2 浸种时间对苦苣菜种子萌发和幼苗生长的影响
如图2-a所示,浸种6 h对苦苣菜种子发芽率、发芽势、发芽指数、活力指数都有显著性影响,分别较浸种1 h时提高了46.7百分点、53.33百分点、7.08、1.62。浸种6~18 h,各试验处理对种子萌发的影响差异不显著。由图2-b可以看出,不同浸种时间对苦苣菜幼苗生长的影响规律与影响种子萌发的规律相似,且浸种6~18 h对幼苗根长和苗质量的影响差异不显著,浸种 24 h 反而不利于种子萌发和幼苗生长。由此可见,在本研究中,最佳浸种时间为6 h。
2.3 不同浓度GA 3溶液浸种对种子萌发和幼苗生理的影响
从图3-a、图3-b可看出,不同浓度的GA 3溶液对苦苣菜种子萌发和幼苗生长有一定影响,尤其对发芽率、发芽势、苗高的影响较大。低浓度的GA 3溶液对苦苣菜种子及幼苗发育有促进作用,在浓度为200 mg/L时的促进作用最明显,与对照组相比,其发芽率、发芽指数差异不显著,而发芽势、活力指数、根长、苗质量、苗高的差异均显著(P<0.05)。此外,研究发现, 浸种溶液浓度较高时,对种子萌发及幼苗发育有一定的抑制作用。
从图4可以看出,添加不同浓度的GA 3对苦苣菜幼苗生理物质含量有一定的影响。与对照组相比,GA 3溶液对淀粉酶活性和POD活性有促进作用,且浓度需在150~250 mg/L以上。200 mg/L GA 3溶液对脯氨酸含量(以鮮质量计)有增加作用,较对照组增加了3.89 μg/g。
2.4 不同浓度褪黑素溶液对苦苣菜种子萌发和幼苗生理指标的影响
由图5可以看出,过低或过高浓度的褪黑素都不利于苦苣菜种子萌发和幼苗生长。100 μmol/L褪黑素溶液处理对苦苣菜发芽指标及幼苗生长有促进作用,但与对照组相比,发芽率、发芽势、发芽指数差异不显著;100 μmol/L褪黑素溶液处理苦苣菜苗高、根长、苗质量的促进作用显著高于对照组。250 μmol/L褪黑素溶液处理对苦苣菜种子的抑制作用较明显,其发芽率、发芽势、发芽指数均显著低于对照组,而对苦苣菜幼苗苗高、苗质量的抑制作用却不显著。
从图6可以看出,大于100 μmol/L浓度的褪黑素溶液处理可显著促进苦苣菜细胞生理活性物质含量的提高,且随着褪黑素浓度的进一步增加,其促进作用降低。
2.5 不同浓度2,4-D溶液浸种对苦苣菜种子萌发的影响
不同浓度2,4-D溶液浸种对苦苣菜种子萌发及幼苗生长的影响不同。从图7可以看出,用 10 mg/L 2,4-D溶液浸种的种子发芽率、发芽势分别较对照组提高了8.89%、11.12%,且差异显著(P<0.05);10 mg/L 2,4-D溶液浸种后萌发的幼苗苗高、苗质量也较对照显著增高。
图8显示,2,4-D溶液对脯氨酸含量、淀粉酶活性、POD活性均有一定的影响。2~20 mg/L 2,4-D 溶液对淀粉酶活性均具有增强作用,且组内差异不显著。10 mg/L 2,4-D溶液对脯氨酸含量和POD活性都有显著的促进作用。
3 讨论
苦苣菜不仅可以鲜食,还可加工成各类食品和饮料,如苦苣菜挂面、苦苣菜茶。Su等研究发现,苦苣菜对O 3敏感,可作为特殊的指示植物[12]。苦苣菜具有较强的抗氧化及抑菌功能[13],是可进一步开发的天然人工添加剂的潜在资源,同时可成为化妆品的加工原料。由此可见,加大苦苣菜产量、丰富其资源势在必行。
苦苣菜种子较小,容易被风吹散,在土壤中保留的时间较短,其萌发、生长受温度、水势、光照等条件影响[5],在5~35 ℃均可发芽,0~0.2 MPa为其最佳萌发水势条件,当光照不充分时,萌发率显著降低。本研究发现,苦苣菜种子浸种6 h后,在培养温度为25 ℃条件下的发芽率、发芽势等发芽指标和生长生理代谢较高,有利于种子萌发及幼苗生长,浸种时间过长或温度过高反而不利于种子萌发和幼苗生长。
生长调节剂具有效率高、低毒性等特点,符合现代农业绿色可持续发展的要求。GA 3是一种赤霉酸生长调节剂,外源施加GA 3可促进种子萌发,在种子萌发过程中,GA 3从胚中释放出来,通过α-淀粉酶刺激特定基因的mRNA转录[14],900 mg/L GA 3浸种可使番茄在较短时间内获得较旺盛的幼苗,且田间发育状况较好。在本研究中,200 mg/L GA 3溶液对苦苣菜种子萌发和幼苗生理指标的影响显著,其原因可能是GA 3的吸收增加了蛋白质的积累,以满足能量需求、氧化还原调节和代谢活化[15-16]。褪黑素于1995年首次在植物中被发现,现有研究结果表明,褪黑素可调节植物细胞膜的稳定性,提高抗氧化性能[17],影响根系生长,从而增加根系吸收水分和营养物质的能力,提高生物量产量,调节基因表达[18],促进甘蓝、黄瓜、大豆、番茄等植物种子的发芽,同时对干旱、 盐胁迫、重金属等胁迫有修复作用[19]。这也解释了为什么在本研究中,褪黑素处理显著促进了幼苗苗高、根长、苗质量、脯氨酸含量、淀粉酶活性及POD活性的增加。2,4-D是一种常用的生长素类似物,可促进细胞分裂和伸长,影响根系发育及物质运输[20],低浓度2,4-D溶液就可促进种子萌发及幼苗生长代谢。
4 结论
在本研究的温度、浸种时间范围内,25 ℃条件下种子的萌发效果最好,浸种6 h萌发及活力较高且有利于幼苗生长。不同调节剂对苦苣菜种子萌发及幼苗生长代谢均有低浓度促进、高浓度抑制的功效,200 mg/L GA 3、100 μmol/L褪黑素、10 mg/L 2,4-D溶液的效果最明显。褪黑素对于幼苗的作用显著高于对种子的作用。
参考文献:
[1] 韩阳阳,王天晓,朱海芳,等. 苦菜不同部位提取物的抗氧化活性[J]. 食品科学,2010,31(19):45-48.5C0A1166-DC98-4EA5-8E9E-C74A9947F4B0
[2]Rangika M S M M. Antioxidant activities of Sonchus oleraceus L.[D]. Wellington:Victoria University of Wellington,2014.
[3]Liu Z W,Zhao X L. Effects of different extraction methods on extraction rate of polysaccharide from Sonchus oleraceus L.[J]. Medicinal Plant,2010,1(5):35-36,39.
[4]Yin J,Si C L,Wang W H. Antioxidant activity of flavonoids and their glucosides from Sonchus oleraceus L.[J]. Journal of Applied Biological Chemistry,2008,51(2):57-60.
[5]Widderick M J,Walker S R,Sindel B M,et al. Germination,emergence,and persistence of Sonchus oleraceus,a major crop weed in subtropical Australia[J]. Weed Biology & Management,2010,10(2):102-112.
[6]Ting H Y,Li Q,Wang Y L,et al. Anti-tumor effect of hot aqueous extracts from Sonchus oleraceus (L.) L. and Juniperus sabina L.—two traditional medicinal plants in China[J]. Journal of Ethnopharmacology,2016,185:289-299.
[7]Alothman E A,Awaad A S,Safhi A A,et al. Evaluation of anti-ulcer and ulcerative colitis of Sonchus oleraceus L.[J]. Saudi Pharmaceutical Journal,2018,26(7):956-959.
[8]Fabiana C V,Marina de M P,Santos-e-Silva L D,et al. Evaluation of the antinociceptive activity of extracts of Sonchus oleraceus L. in mice.[J]. Journal of Ethnopharmacology,2009,124(2):306-310.
[9]孔佳茜,趙铭森,孟晓康,等. PEG模拟干旱胁迫对大麻种子萌发的影响[J]. 种子,2020,39(9):26-30,52.
[10] 赵海蓓,危常州,张新疆,等. 腐殖酸浸种对玉米种子萌发及幼苗生长的影响[J]. 新疆农业科学,2020,57(11):2118-2125.
[11]张明聪,何松榆,秦 彬,等. 外源褪黑素缓解干旱胁迫对春大豆苗期影响的生理调控效应[J]. 大豆科学,2020,39(5):742-750.
[12]Su B Y,Zhou M H,Xu H,et al. Photosynthesis and biochemical responses to elevated O 3 in Plantago major and Sonchus oleraceus growing in a lowland habitat of northern China[J]. Journal of Environmental Sciences,2017,53(6):113-121.
[13]McDowell A,Thompson S,Stark M,et al. Antioxidant activity of Puha (Sonchus oleraceus L.) as assessed by the cellular antioxidant activity (CAA) assay[J]. Phytotherapy Research,2011,25(12):1876-1882.
[14]Balaguera-López H E,Cárdenas-Hernández J F,lvarez-Herrera J G,et al. Effect of gibberellic acid (GA 3) on seed germination and growth of tomato (Solanum lycopersicum L.)[J]. Acta Horticulturae,2009,821(821):141-148.
[15]Lando A P,Viana W G,Vale E M,et al. Cellular alteration and differential protein profile explain effects of GA 3 and ABA and their inhibitor on Trichocline catharinensis (Asteraceae) seed germination[J]. Physiologia Plantarum,2020,169(2):258-275.
[16]文景锜,陈仕勇,柏晓玲,等. H 2O 2处理对3种高寒燕麦种子萌发和幼苗生长的影响[J]. 种子,2020,39(10):86-88,93.
[17]Castaares J L,Bouzo C A. Effect of exogenous melatonin on seed germination and seedling growth in melon (Cucumis melo L.) under salt stress[J]. Horticultural Plant Journal,2019,5(2):79-87.
[18]Liu J L,Wang W X,Wang L Y,et al. Exogenous melatonin improves seedling health index and drought tolerance in tomato[J]. Plant Growth Regulation,2015,77(3):317-326.
[19]Simlat M,Ptak A,Skrzypek E,et al. Melatonin significantly influences seed germination and seedling growth of Stevia rebaudiana Bertoni[J]. PeerJ,2018,6(6):e5009-e5033.
[20]Clarke C R,Tegg R S,Thompson H K,et al. Low-dose foliar treatments of the auxin analog 2,4-D reduce potato common scab and powdery scab for multiple potato cultivars and enhance root development[J]. Crop Protection,2020,136:105-208.5C0A1166-DC98-4EA5-8E9E-C74A9947F4B0
