2种睡莲不同部位对低温胁迫的生理响应及抗寒性评价
2022-06-09黄祥楚光明徐迎春王雪莲杨梅花
黄祥 楚光明 徐迎春 王雪莲 杨梅花

摘要:为探究耐寒睡莲不同部位对低温胁迫的生理响应及其抗寒性,研究以我国新疆原生种雪白睡莲(Nymphaea candida)和栽培品种伊丽莎白公主睡莲(Nymphaea ‘Princess Elizabeth)为试验材料,在人工气候箱中模拟低温胁迫环境(0 ℃)设置持续低温处理0、12、24、36、48、60、72 h,测定不同时长低温胁迫下2种睡莲叶片、叶柄、根状茎中的丙二醛(MDA)含量、相对电导率(REC)、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、可溶性糖(SS)含量、可溶性蛋白(SP)含量、叶绿素含量等生理指标,并用主成分分析法和隶属函数法对2种睡莲不同部位及其品种之间的抗寒性进行综合评价。结果表明:不同部位之间,雪白睡莲叶片和叶柄部位抗寒性强于伊丽莎白公主睡莲,根状茎部位弱于伊丽莎白公主睡莲;2个品种之间,雪白睡莲抗寒性强于伊丽莎白公主睡莲。本研究结果为进一步探讨耐寒睡莲品种抗寒机制和扩繁推广提供了科学依据。
关键词:雪白睡莲;伊丽莎白公主睡莲;低温胁迫;生理响应;隶属函数综合评价;抗寒性评价
中图分类号:S682.320.1 文献标志码: A
文章编号:1002-1302(2022)09-0128-07
睡莲是睡莲科(Nymphaeaceae)睡莲属(Nymphaea)多年生水生植物,具有很高的观赏、食用、药用、生态修复等价值[1]。睡莲按其生态习性特征可分为耐寒睡莲(hardy waterlily)、热带睡莲(tropical waterlily),前者分布于亚热带和温带地区,后者分布于热带地区[2]。低温是限制睡莲自然越冬的主要因素,睡莲在低温胁迫下的生理响应及抗寒性研究对睡莲推广种植具有重要的指导意义。
0 ℃是低温对植物产生危害的温度界线[3],低温胁迫导致植物的细胞膜透性、保护酶活性及渗透调节物质等发生显著性变化[4]。植物抗寒性与多种因素相关,抗寒性机理十分复杂,抗寒性评價必须是多方面的[5]。目前,国内外对荷花[6-7]、水生鸢尾[8]、水生菖蒲[9]等水生植物的抗寒性研究较多,其中,吉琴对6种热带睡莲进行人工低温胁迫处理,研究了不同品种热带睡莲抗寒性并进行了抗寒能力综合评价[10]。而针对耐寒睡莲及其不同部位的抗寒生理研究鲜有报道。
本试验选取我国新疆原生种雪白睡莲(Nymphaea candida)和栽培品种伊丽莎白公主(Nymphaea ‘Princess Elizabeth)2种耐寒睡莲为试验材料,在低温0 ℃环境下(智能气候箱人工模拟)处理不同时长,测定其不同部位(叶片、叶柄、根状茎)的生理指标,研究低温胁迫下其生化指标的变化规律和不同部位对低温响应的差异,结合生理指标,建立抗寒性评价体系,以期为睡莲抗寒性鉴定、耐寒选育和扩繁推广提供科学依据。
1 材料与方法
1.1 试验区概况
试验于2020年在新疆维吾尔自治区石河子市石河子大学进行,试验地位于86°3′9″E、44°17′49″N附近,海拔430 m,无霜期为168~171 d,年均气温 7~8 ℃,日照时数2 300~2 700 h,年降水量180~270 mm。
1.2 试验材料
本试验选用雪白睡莲(Nymphaea candida)和伊丽莎白公主(Nymphaea ‘Princess Elizabeth)睡莲2个耐寒品种,于2020年4月采用温室内自然光照的盆栽方式,盆深50 cm、口径45 cm,正常水肥管理,当植株长至9~11张叶时,选取长势良好的植株,进行低温处理。
1.3 试验方法
根据前期预试验结果,将2种盆栽睡莲分别移至人工气候箱中模拟低温胁迫环境(0 ℃)。低温处理时长为0、12、24、36、48、60、72 h,取样时间为每天10:00。叶片、叶柄取样点为长势相同的浮水功能叶及其叶柄,根状茎取样点为长势相同的主茎,每个指标取3盆重复。将取样叶片、叶柄、根状茎洗净、擦干,其中叶片去除主脉和叶缘。取样材料分成2个部分,一部分剪碎(0.5 cm×0.5 cm)用于测定相对电导率和叶绿素含量指标,另一部分液氮冻存后置于-80 ℃保存,用于丙二醛含量、可溶性渗透调节物质、酶活性等生理指标的测定。
1.4 指标测定
相对电导率(REC)采用电导法[3]测定;丙二醛(MDA)含量采用硫代巴比妥酸法[3]测定;超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性分别采用氮蓝四唑(NBT)还原法比色法、愈创木酚法和紫外吸收法[11]测定;可溶性糖(SS)和可溶性蛋白(SP)含量分别采用蒽酮比色法和考马斯亮蓝G-250染色法[3]测定;叶绿素含量采用分光光度计法[11-12]测定。
1.5 数据分析
通过隶属函数法计算各指标的隶属函数值[13],其中,REC和MDA含量采用降型分布函数:U(X i)=(X imax-X ij)/(X imax-X imin);SS、SP含量及SOD、POD、CAT活性与Chl总含量采用升型分布函数:U(X i)=(X ij-X imax)/(X imax-X imin),式中:X ij表示各指标值;X imax和X imin分别表示第i项指标的最大值和最小值[13],隶属函数值乘以对应的权重系数累加求和得出综合评定值。通过Excel 2016整理数据、绘图,SPSS 19.0对数据进行数据标准化和主成分分析。
2 结果与分析
2.1 低温胁迫对睡莲细胞膜透性的影响
由图1可知,随着低温胁迫时间的延长,2种睡莲不同部位REC均呈上升趋势。处理72 h时,叶片中REC相比对照增幅为雪白睡莲(182.4%)<伊丽莎白公主睡莲(235.5%);叶柄中REC相比对照增幅为雪白睡莲(142.6%)<伊丽莎白公主睡莲(175.5%);根状茎中REC相比对照增幅为雪白睡莲(103.1%)>伊丽莎白公主睡莲(92.1%)。随着低温胁迫时间的延长,2种睡莲叶片、叶柄中MDA含量明显呈现先升后降趋势,而根状茎中MDA含量整体呈逐渐上升趋势。低温处理24~36 h时,叶片中MDA含量达到最大值,相比对照增幅为雪白睡莲(41.2%)<伊丽莎白公主睡莲(120.6%);低温处理36 h时,叶柄中MDA含量达到最大值,相比对照增幅为雪白睡莲(108.1%)<伊丽莎白公主睡莲(160.5%);根状茎中MDA含量在72 h达到最大值,相比对照增幅:雪白睡莲(135.2%)>伊丽莎白公主睡莲(77.8%)。0510B22B-641D-458D-BCEB-DE920FD38F0F
2.2 低温胁迫对睡莲抗氧化酶活性的影响
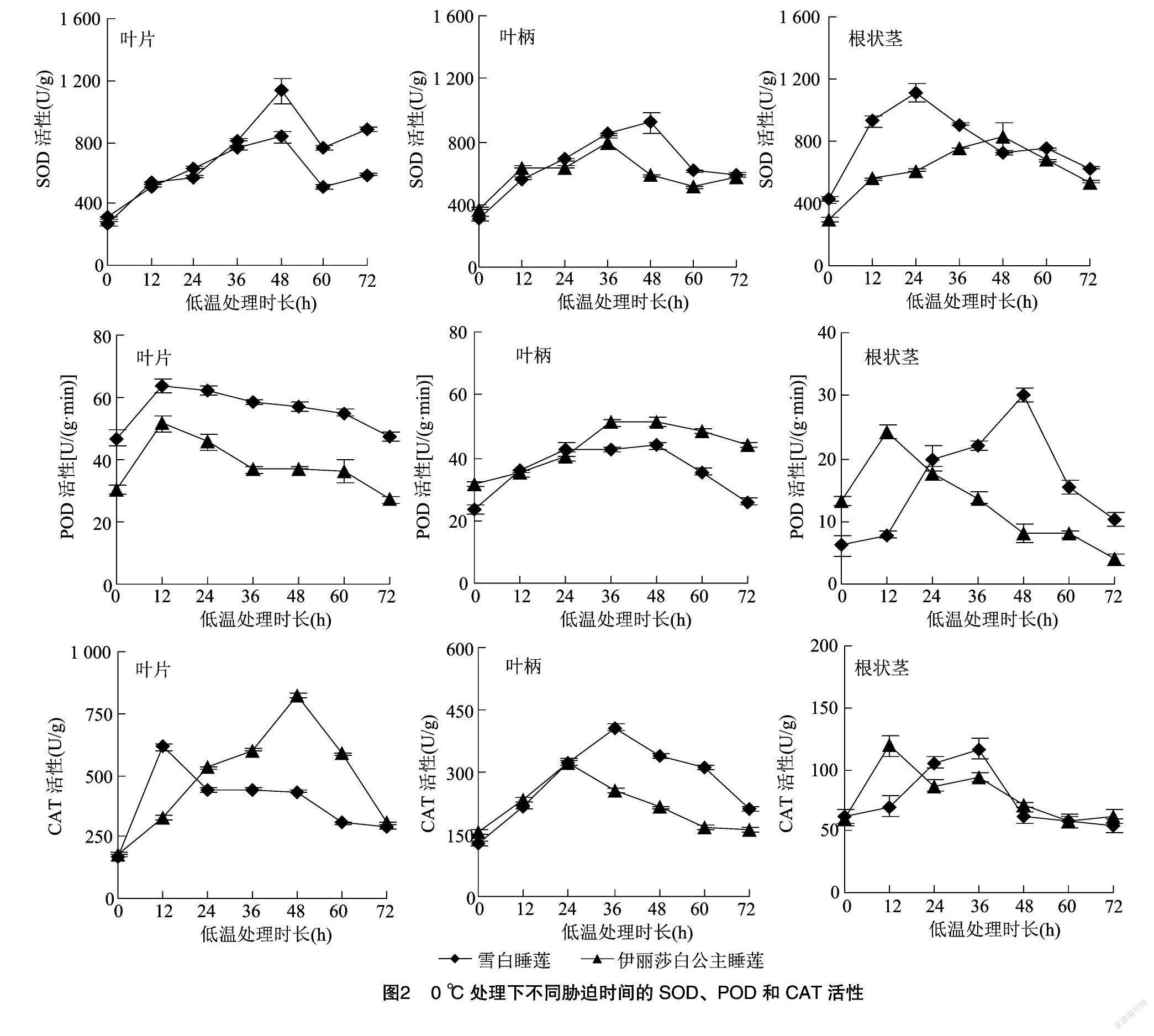
由图2可知,随着低温胁迫时间的延长,2种睡莲不同部位SOD活性均整体呈现先升后降的趋势。低温处理48 h,叶片中SOD活性均上升到最大值,相比对照增幅为雪白睡莲(166.9%)<伊丽莎白公主睡莲(314.8%);低温处理36~48 h,叶柄中SOD活性分别达到最大值,相比对照增幅为雪白睡莲(199.3%)>伊丽莎白公主睡莲(113.4%);根状茎的SOD活性分别在低温处理24、48 h时上升到最大,相比对照增幅:雪白睡莲(158.7%)<伊丽莎白公主睡莲(178.4%)。
2种睡莲不同部位POD活性均呈现先升后降的趋势。低温处理12 h,叶片中POD活性上升到最大值,相比对照增幅为雪白睡莲(35.5%)<伊丽莎白公主睡莲(70.0%);低温处理48 h,叶柄中POD活性分别达到峰值,相比对照增幅为雪白睡莲(87.0%)>伊丽莎白公主睡莲(63.1%);根状茎的POD活性分别在低温处理48、12 h上升到最大,相比对照增幅为雪白睡莲(390.4%)>伊丽莎白公主睡莲(82.7%)。
2种睡莲不同部位CAT活性均呈现先升后降的趋势。低温处理12、48 h,叶片中CAT活性均上升到最大值,相比对照增幅为雪白睡莲(263.4%)<伊丽莎白公主睡莲(356.6%);低温处理36、24 h,叶柄中CAT活性分别达到最大值,相比对照增幅为雪白睡莲(217.6%)>伊丽莎白公主睡莲(108.2%);根状茎的CAT活性分别在低温处理36、12 h上升到最大,相比对照增幅为雪白睡莲(91.1%)<伊丽莎白公主睡莲(96.3%)。
2.3 低温胁迫对睡莲可溶性渗透调节物质的影响
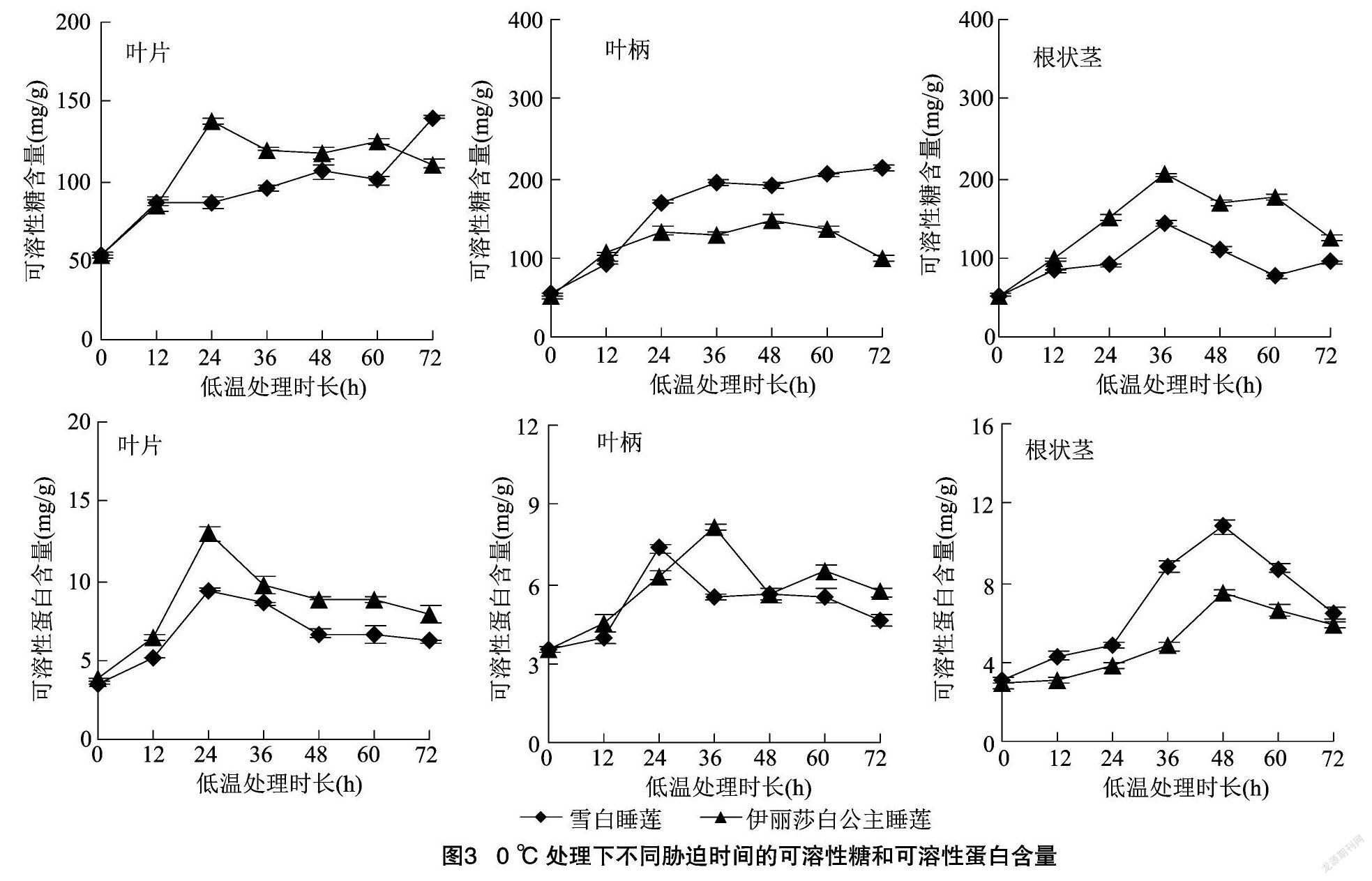
由图3可知,随着低温胁迫时间的延长,2种睡莲根状茎中SS含量整体呈先升后降的趋势;叶片、叶柄部位SS含量,雪白睡莲逐渐升高,伊丽莎白公主睡莲呈先升后降的趋势。低温处理72、24 h,叶片中SS含量相比对照增幅为雪白睡莲(165.6%)>伊丽莎白公主睡莲(156.7%);低温处理72、48 h,叶柄中相比对照增幅为雪白睡莲(301.0%)>伊丽莎白公主睡莲(194.2%);在低温处理36 h,根状茎中SS含量相比对照增幅为雪白睡莲(168.9%)<伊丽莎白公主睡莲(286.4%)。
2种睡莲不同部位中SP含量均呈现先升后降的趋势。低温处理24 h,叶片中SP含量相比对照增幅为雪白睡莲(164.2%)<伊丽莎白公主睡莲(242.0%);低温处理24、36 h,叶柄中SP含量相比对照增幅为雪白睡莲(106.3%)<伊丽莎白公主睡莲(132.2%);低温处理48 h,根状茎中SP含量相比对照增幅为雪白睡莲(248.9%)>伊丽莎白公主睡莲(152.2%)。
2.4 低温胁迫对叶绿素总含量的影响
由图4可知,随着低温胁迫时间的延长,2种睡莲不同部位叶绿素总含量呈现先降再升再降的变化趋势。2种睡莲不同部位整体在0~12 h明显下降,12~36 h逐渐上升,在36 h下降差异性明显。低温胁迫72 h后,叶片中叶绿素总含量相比对照降幅为雪白睡莲(37.6%)<伊丽莎白公主睡莲(48.8%);叶柄中叶绿素总含量相比对照降幅为雪白睡莲(55.7%)>伊丽莎白公主睡莲(53.4%)。
2.5 抗寒性综合评价
2.5.1 寒性综合评价体系的建立
抗寒性综合评价体系中,提取主成分累计贡献率达到80%以上的指标对睡莲的抗寒性进行综合评价[14]。由表1可知,叶片、叶柄、根状茎中前3个主成分的累计贡献率分别为80.71%、84.65%、82.64%。以前3个主成分分析各指标的权重,由表2可知,睡莲叶片中抗寒性相关性最大的指标是SP含量,其次是CAT活性;睡莲叶柄中抗寒性相关性最大的指标是CAT活性,其次是SOD活性;睡莲根状茎中抗寒性相关性最大的指标是SP含量,其次是SOD活性和SS含量。
2.5.2 各指标隶属度值及抗寒性综合指数
抗寒性综合指数是各指标隶属函数值加权计算后的综合评定值[15],综合评定值越大,抗寒性越强[16]。由表3可知,2种睡莲的相同部位抗寒性强弱也存在差异,叶片、叶柄部位抗寒性为雪白睡莲>伊丽莎白公主睡莲;根状茎部位抗寒性为雪白睡莲<伊丽莎白公主睡莲。以2种睡莲不同部位综合得分计算出每种睡莲的隶属函数值,再求得每種睡莲的抗寒性综合评定值,结果表现为雪白睡莲>伊丽莎白公主睡莲。
3 讨论与结论
低温胁迫对植物的细胞膜系统损伤很大,细胞膜系统的破坏程度常用MDA含量和REC进行评估[17]。研究表明,MDA含量和REC随着胁迫时间的延长均有不同程度的上升[18-19]。本试验中,低温胁迫期间(0~72 h),雪白睡莲和伊丽莎白公主睡莲根状茎部位MDA含量和REC整体上呈现逐渐上升的趋势,但根状茎中REC增幅远低于叶片和叶柄。2种睡莲叶片和叶柄中MDA含量整体呈现先升后降的趋势,表明低温胁迫前期,膜质过氧化作用加剧, MDA含量大量增加。 但在24~36 h后开始呈现下降趋势,表明经一段时间的低温锻炼后,2种睡莲地上部分抵御低温能力提高,削弱了膜质过氧化作用,这与张武君等在低温胁迫对金银花叶片的影响研究中MDA含量变化结果[20]基本一致。2种睡莲不同部位的REC值均呈不断上升趋势,表明睡莲植物细胞膜在低温胁迫过程中选择透性减弱,膜内溶质外渗,从而导致REC值持续增加。从MDA含量和REC值的大小及变化趋势可得出,雪白睡莲的叶片和叶柄部分受低温胁迫的伤害程度低于伊丽莎白公主睡莲,而根状茎部位高于伊丽莎白公主睡莲。
低温胁迫下,SOD、POD、CAT等活性发生变化调控植物体内的活性氧系统,参与其对低温的调控[21-22]。本试验中,2种睡莲不同部位SOD、POD、CAT活性均呈现先升后降的趋势,表明低温胁迫激发抗氧化酶使其活性增强,当持续低温超出其抵抗范围,细胞结构遭到破坏,保护酶系统清除活性氧的能力下降,与李春燕等在小麦叶片低温胁迫的研究中,抗氧化酶活性的变化趋势[23]相一致。本试验中,2种睡莲不同部位SOD活性均保持较高水平,可及时歧化细胞内的O- 2·,但不同部位中POD、CAT活性存在差异。雪白睡莲叶片中POD、CAT活性在低温胁迫12 h时急剧上升达到峰值,而伊丽莎白公主睡莲根状茎中POD、CAT活性变化情况与之相同,表明2种睡莲地上地下部位在低温胁迫下的应激反应中清除SOD歧化O- 2·而产生的H 2O 2的机制上存在差异。这可能是睡莲在长期进化过程中,为适应水生环境,不同部位结构存在差异[24],进而导致地上部位与地下部分对低温响应的差异。0510B22B-641D-458D-BCEB-DE920FD38F0F
低温胁迫下,细胞内SS和SP大量积累,通过降低细胞的渗透势来维持膨压,提高植物的抗寒能力[25-27]。本试验中,2种睡莲不同部位的SS、SP含量较低温胁迫前均有不同程度的升高,这是2种睡莲在提高细胞内可溶性渗透调节物质含量以减弱低温对其伤害,增强自身抗寒性。这与李欣等在低温胁迫下荷花地下茎可溶性渗透调节物质含量变化情况[28]基本一致。低温胁迫后,2种睡莲根状茎中SS、SP含量均呈现先升后降的趋势,说明在低温胁迫前期(0~24 h),睡莲根状茎细胞内SS、SP含量增加以调节细胞渗透压,增强其抗寒能力;但在低温胁迫后期(24~72 h),细胞质膜透性被破坏,细胞内含物外渗的同时SS、SP含量也因此下降。低温胁迫期间,雪白睡莲的叶片和叶柄中SS含量增幅高于伊丽莎白公主睡莲,根状茎中SS含量增幅低于伊丽莎白公主睡莲;2种睡莲不同部位SP含量增幅情况恰好相反。可推测SS是雪白睡莲抵抗低温胁迫的主要可溶性渗透调节物质,而在伊丽莎白公主睡莲中则是SP,这可能与2种睡莲不同类型根状茎相关。耐寒睡莲不同类型根状茎之间的抗寒性需进一步研究。
植物体内的叶绿素含量在逆境环境下会产生生理变化[29]。本试验中,2种睡莲的叶片、叶柄中叶绿素总含量整体呈先降后升再降趋势。低温胁迫前期(0~24 h),叶绿素含量的下降与张雪的研究结果[30]不同,这可能与本研究中处理温度低于植物叶绿素形成的最低温度(2~4 ℃)有关;低温处理24~36 h时,叶绿素含量整体小幅度增加,这可能是植物前期对低温环境一定程度的适应;低温胁迫后期(36~72 h),叶绿素含量逐渐降低,说明在持续低温下叶绿素的合成受到限制,2种睡莲对低温逆境做出的生理反应。在低温胁迫下,雪白睡莲相对伊丽莎白公主睡莲叶绿素含量降幅保持一个较低的水平,这与抗寒性强的品种维持较高的叶绿素含量[31]相一致。
逆境胁迫过程中,多种因素共同影响植物生理生化指标的变化,单一指标不能满足对植物抗逆性的评价[15,32]。本研究中,通过主成分分析和隶属函数法对2种睡莲品种之间及其不同部位的抗寒性进行综合性评价。结果表明,不同部位之间,雪白睡莲叶片、叶柄部位抗寒性高,根状茎部位抗寒性低于伊丽莎白公主睡莲;2个品种之间,雪白睡莲抗寒性高于品种伊丽莎白公主睡莲。综合指标得出的结果与单个指标(REC、MDA含量、SS含量)得出的结果相一致,与抗氧化酶活性等指标得出的结果存在一定差异。且综合指标的结果与实际形态观测结果基本一致,说明运用综合评价法来确定睡莲的抗寒性是很有必要的。
本试验结果表明,随着低温胁迫时间的延长,雪白睡莲和伊丽莎白公主睡莲的叶片、叶柄、根状茎均表现出一定的抗寒性。在低温胁迫下,2种耐寒睡莲通过提高MDA含量和REC值,调节抗氧化酶SOD、POD、CAT活性,增加SS、SP及叶绿素含量来抵御低温伤害。通过生理生化指标和抗寒性综合评价得出,不同部位之间,雪白睡莲叶片和叶柄部位抗寒性强于伊丽莎白公主睡莲,根状茎部位弱于伊丽莎白公主睡莲;2个品种之间,雪白睡莲抗寒性强于伊丽莎白公主睡莲。本研究结果为进一步探讨耐寒睡莲品种抗寒机制和扩繁推广提供了科学依据。
参考文献:
[1]中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京:科学出版社,1993:1-13.
[2]黄国振. 睡莲[M]. 北京:中国林业出版社,2009:3-10.
[3]李合生. 现代植物生理学[M]. 3版. 北京:高等教育出版社,2012:361-366.
[4]丁红映,王 明,谢 洁,等. 植物低温胁迫响应及研究方法进展[J]. 江苏农业科学,2019,47(14):31-36.
[5]杨宁宁,孙万仓,刘自刚,等. 北方冬油菜抗寒性的形态与生理机制[J]. 中国农业科学,2014,47(3):452-461.
[6]Tu J,Zhang M,Xu B G,et al. Effect of physicochemical properties on freezing suitability of lotus (Nelumbo nucifera) root [J]. International Journal of Refrigeration,2015,50:1-9.
[7]趙瑞霜. 荷花抗寒品种筛选及生理研究[D]. 南京:南京农业大学,2014.
[8]张 京,孙小明,吴家森,等. 4种常绿水生鸢尾抗寒性的初步研究[J]. 河北农业大学学报,2012,35(2):30-34,40.
[9]张建旗,赵 峰,巴永娣,等. 4种水生植物抗寒性比较[J]. 草原与草坪,2013,33(4):63-65,70.
[10]吉 琴. 低温胁迫对不同热带睡莲品种抗寒生理的影响[J]. 上海农业学报,2016,32(5):114-118.
[11]王学奎,黄见良. 植物生理生化实验原理和技术[M]. 3版. 北京:高等教育出版社,2015:1-306.
[12]谢晓金,李映雪,张耀鸿. 园林植物抗寒性测定技术的研究[J]. 福建林业科技,2008,35(3):244-249.
[13]李长慧,李淑娟,刘艳霞,等. 低温胁迫对10份鹅观草属野生种质抗寒生理指标的影响[J]. 草业科学,2018,35(1):123-132.
[14]李松岗. 实用生物统计[M]. 北京:北京大学出版社,2002:134-139.
[15]崔莺文,李文明,钱燕萍,等. 欧洲冬青对低温胁迫的生理响应及抗寒性评价[J]. 生物学杂志,2019,36(3):55-59.
[16]宋静爽,王 静,刘周斌,等. 辣椒苗期对低温胁迫的响应及耐冷评价体系的建立[J]. 分子植物育种,2020,18(22):7537-7546.0510B22B-641D-458D-BCEB-DE920FD38F0F
[17]Sairam R K,Tyagi A. Physiology and molecular biology of salinity stress tolerance in plants [J]. Current Science,2004,86(3):407-421.
[18]Liu W Y,Yu K M,He T F,et al. The low temperature induced physiological responses of Avena nuda L.,a cold-tolerant plant species[J]. The Scientific World Journal,2013,2013:658793.
[19]李 瑶. 嫁接提高甜瓜耐低温生理机制的研究[D]. 长春:吉林大学,2014:1-58.
[20]张武君,刘保财,赵云青,等. 金花茶对低温胁迫的生理响应及耐寒性分析[J]. 核农学报,2020,34(2):401-408.
[21]冯 炘,于贤昌,郭恒俊,等. 低温胁迫对黄瓜嫁接苗和自根苗保护酶活性的影响[J]. 山东农业大学学报(自然科学版),2002,33(3):302-304.
[22]Sun W M,Shi Z H,Zhang G F. Research progress of superoxide dismutase[J]. Journal of Modern Agriculture,2013,2(1):1-12.
[23]李春燕,徐 雯,刘立伟,等. 低温条件下拔节期小麦叶片内源激素含量和抗氧化酶活性的变化[J]. 应用生态学报,2015,26(7):2015-2022.
[24]陈维培,张四美,郎继华. 睡莲叶的解剖[J]. 南京师大学报(自然科学版),1987(4):69-75.
[25]Hayat S,Hayat Q,Alyemeni M N,et al. Role of proline under changing environments:a review[J]. Plant Signaling and Behavior,2012,7(11):1456-1466.
[26]尹大川,楊立宾,邓 勋,等. 绿木霉对樟子松苗木生长指标及生理生化指标的影响[J]. 北京林业大学学报,2015,37(1):78-83.
[27]Shao X F,Zhu Y,Cao S F,et al. Soluble sugar content and metabolism as related to the heat-induced chilling tolerance of loquat fruit during cold storage[J]. Food and Bioprocess Technology,2013,6(12):3490-3498.
[28]李 欣,江 君,徐 君,等. 经低温锻炼后荷花不同品种对低温胁迫的生理响应差异分析[J]. 植物资源与环境学报,2015,24(4):76-82.
[29]张静袁,朱为民. 低温胁迫对番茄幼苗叶绿素和丙二醛的影响[J]. 上海农业学报,2012,28(3):74-77.
[30]张 雪. 喜树不同种源对低温胁迫的响应[D]. 杭州:浙江农林大学,2011.
[31]黄 浩,周祥斌,欧阳昆唏,等. 黄粱木种源抗寒性综合评价[J]. 华南农业大学学报,2016,37(1):82-88.
[32]王 兆. 低温胁迫对彩叶草的生理效应及抗寒性研究[D]. 福州:福建农林大学,2014.0510B22B-641D-458D-BCEB-DE920FD38F0F
