基于网络药理学和体外研究探究瓜蒌薤白半夏汤治疗动脉粥样硬化的机制
2022-06-08庄安琪李轶维
冯 利,庄安琪,李轶维,王 月,杨 科
(1.国家开放大学医药学院,北京 100039;2.中国计量大学生命科学学院,浙江 杭州 310018)
动脉粥样硬化是一种主要发生在大中型动脉的慢性疾病,以脂质的积累,平滑肌细胞的增殖,细胞凋亡、坏死和纤维化,以及局部炎症为特征。动脉粥样硬化可造成冠状动脉狭窄,引起心肌梗死和心力衰竭;动脉粥样硬化斑块引起的动脉狭窄或破裂可导致脑部短暂性缺血、缺血性中风或出血性中风的发作。采用阿托伐他汀降血脂或阿司匹林抗血小板聚集是目前临床上治疗动脉粥样硬化的常规方法。但因动脉粥样硬化的发病机制十分复杂,这些方法并不能达到良好治疗效果。中药具有多成分、多靶点的特点,在防治动脉粥样硬化方面具有自身独特优势,因此越来越受到人们的关注。
瓜蒌薤白半夏汤最早记载于《金匮要略》,主治痰盛瘀阻胸痹证。胸痹指胸部闷痛、喘息不得卧,即现代医学上的冠状动脉粥样硬化相关疾病。已有文献报道[1-2],瓜蒌薤白半夏汤联合西药治疗冠状动脉粥样硬化性心脏病、心绞痛患者的总有效率可达96.77%,且可通过升高NO含量治疗缺氧性肺动脉高压。已有研究发现[3-7],瓜蒌薤白半夏汤对抗动脉粥样硬化可能与抗炎、减轻氧化损伤、保护血管内皮、调节脂质代谢、降低病变动脉壁硫酸软骨素蛋白聚糖、硫酸皮肤素蛋白聚糖含量有关。基于中药多靶点、多通路的治疗特点,瓜蒌薤白半夏汤治疗动脉粥样硬化的分子机制值得进一步探究。网络药理学整合了生物学、药理学、计算生物学等多学科的相关知识,可从整体角度探讨药物与疾病的相关性,符合中医学整体观与辨证原则[8]。从网络药理学角度研究瓜蒌薤白半夏汤主要关注的疾病是冠心病[7,9]、慢性阻塞性肺病[10],其作用机制与其调节血小板活化及炎症通路等相关。此外,还有未经试验验证的瓜蒌薤白半夏汤临床治疗器官定位和药效成分预测[11]相关的研究。但是,尽我们最大所能,我们未检索到基于网络药理学研究瓜蒌薤白半夏汤治疗动脉粥样硬化的相关研究报道。本研究旨在利用网络药理学的优势与方法分析各目标点之间的潜在关系并构建网络图,探究瓜蒌薤白半夏汤治疗动脉粥样硬化的潜在分子机制。
1 材料与方法
1.1 网络药理学研究
1.1.1瓜蒌薤白半夏汤化合物及靶点检索 本研究以“瓜蒌”、“薤白”、“半夏”为检索词在中药系统药理学数据库与分析平台(TCMSP,https://tcmspw.com/tcmsp.php)中检索瓜蒌薤白半夏汤的所有化学成分,然后以药物口服利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18为筛选条件检索相关化学成分及相应靶点。
1.1.2动脉粥样硬化靶点检索与筛选 以“Atherosclerosis”为检索词在OMIM(https://omim.org/)、GeneCards(https://www.genecards.org/)、DrugBank(https://go.drugbank.com/)和TTD数据库(http://db.idrblab.net/ttd/)检索并去重得到动脉粥样硬化的相关靶点。
1.1.3瓜蒌薤白半夏汤与动脉粥样硬化共同靶点筛选 将以上检索得到的瓜蒌薤白半夏汤与动脉粥样硬化的靶点上传于Venn图制作平台(http://www.ehbio.com/ImageGP/ index.php/Home/Index/VennDiagram.html)得到二者的交集靶点,即瓜蒌薤白半夏汤治疗动脉粥样硬化的潜在靶点。
1.1.4中药-化合物-靶点-疾病网络图构建 利用Cytoscape 3.6.1软件以三味中药(瓜蒌、薤白、半夏)筛选得到的化合物分子、交集靶点以及动脉粥样硬化为靶点,构建“中药-化合物-靶点-疾病”网络图。
1.1.5蛋白相互作用图构建 将瓜蒌薤白半夏汤与动脉粥样硬化的交集靶点上传至STRING数据库(https://string-db.org/)中,并将条件物种设置为“Homo sapiens”,最小相互作用分数设置为0.400 0。然后将获得的蛋白相互作用图导入Cytoscape 3.6.1软件中利用Network Analyzer模型进行可视化分析。
1.1.6富集分析 将获得的瓜蒌薤白半夏汤和动脉粥样硬化共同靶点导入DAVID数据库中(https://david.ncifcrf.gov/summary.jsp),得到靶点相应的功能及在信号通路中的作用;限定物种条件为“Homo sapiens”,阈值设定为P<0.05,进行Gene ontology(GO)生物过程分析和Kyoto encyclopedia of genes and genomes(KEGG)通路富集分析,并利用GraphPad prism 8.0绘制柱状图并在ImageGp平台上(http://www.ehbio.com/Cloud_Platform/front/)制作气泡图。
1.2 体外实验验证
1.2.1药物与试剂 β-谷甾醇(B21972)购自上海源叶生物有限公司;氧化型低密度脂蛋白(XS20201007,Oxidized low-density lipoprotein, Ox-LDL)购自北京协生生物科技有限责任公司;白细胞介素-1β(EK0392,interleukin 1β,IL-1β)、白细胞介素-6(EK0410,interleukin 6,IL-6)和肿瘤坏死因子-α(EK0525,tumor necrosis factor-α,TNF-α)试剂盒购自Boster 生物技术公司;线粒体膜电位检测试剂盒(C2006,JC-1)、吡咯烷二硫代甲酸铵盐(S1808,Ammonium pyrrolidinedithiocarbamate,PDTC)和噻唑蓝溴化四唑(ST1537,MTT)购自碧云天生物技术有限公司;NF-κB抗体(10745-1-AP)、IL-1β抗体(16806-1-AP)、IL-6抗体(21865-1-AP)、TNF-α抗体(17590-1-AP)购自武汉三鹰生物技术有限公司。
1.2.2细胞来源与培养 HAEC细胞购自美国ATCC细胞库,细胞由含10%胎牛血清的RPMI 1640培养液培养,并置于5% CO2、37 ℃培养箱中培养,取对数生长期细胞用于以下实验。
1.2.3MTT法测定细胞活力 HAEC细胞以5×103个/孔的密度接种于96孔板中,置于5% CO2、37 ℃培养箱中培养24 h后进行后续实验。首先在Ox-LDL造模浓度实验中,将细胞分为8组,分别加入0、40、50、60、70、80、90、100 mg·L-1的Ox-LDL,孵育24 h后移除细胞液并加入1 g·L-1的MTT溶液,孵育4 h后,加入100 μL的DMSO,然后,在570 nm波长下测定OD值。在β-谷甾醇毒性实验中,将细胞分为6组,分别加入0、0.25、0.5、1、2、4 mg·L-1的β-谷甾醇,在5% CO2、37 ℃培养箱培养12 h后,采用上述Ox-LDL造模浓度实验中所述方法,利用MTT溶液测定每孔细胞的OD值;在β-谷甾醇对细胞保护作用的实验中,将细胞分为7组,Control、Model及5个β-谷甾醇组(0.25、0.5、1、2、4 mg·L-1),β-谷甾醇组预给药不同浓度梯度的β-谷甾醇,孵育12 h后,除Control组外,其他组别均加入40 mg·L-1的Ox-LDL,最后,采用上述Ox-LDL造模浓度实验中所述方法,测定细胞OD值。
1.2.4JC-1法测定细胞凋亡情况 将HAEC细胞接种于24孔板,分为Control、Model和β-谷甾醇组,当细胞处理结束后,移除细胞液,然后每孔加入1 mL的JC-1染色工作液,在37 ℃黑暗条件下孵育30 min,吸去上清,用JC-1染色缓冲液洗涤5次,并加入1 mL细胞培养液,最后在荧光显微镜下进行观察。
1.2.5酶联免疫吸附测定细胞培养液中炎症因子的表达 将HAEC细胞按照1×105个/孔的密度接种于24孔板,培养24 h后,将细胞分为Control、Model、β-谷甾醇组和PDTC组,然后按上述方法处理各组细胞,其中PDTC组细胞加入0.125 g·L-1的PDTC,孵育2 h后加入40 mg·L-1的Ox-LDL进行细胞造模;培养结束后,将细胞培养液收集于无菌EP管中,在1 000 r·min-1的条件下离心5 min后,移入新的EP管中备用,最后,根据ELISA试剂盒说明书所述的检测步骤检测细胞上清中IL-1β、IL-6、TNF-α的含量。
1.2.6蛋白印迹法测定细胞内相关蛋白的表达 首先采用RIPA缓冲液提取细胞蛋白,使用BCA测定其蛋白浓度,然后用10%和8%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白并转移至PVDF膜上,转膜结束后在5%脱脂牛奶中封闭2 h,然后与p-NF-κB抗体(1 ∶1 000)、NF-κB抗体(1:1 000)、IL-1β抗体(1 ∶1 000)、IL-6抗体(1 ∶1 000)、TNF-α抗体(1 ∶1 000)在4 ℃条件下孵育过夜,次日,用PBS洗涤3次后与辣根过氧化物酶标记驴抗山羊IgG(H+L)孵育2 h,最后利用特超敏ECL化学发光试剂盒进行显影观察,并利用Image Lab软件进行半定量分析。

2 结果
2.1 瓜蒌薤白半夏汤活性化合物通过TCMSP和BATMAN-TCM数据库检索到瓜蒌薤白半夏汤的化合物共293个,在OB≥30%和DL≥0.18的条件下筛选得到可用于分析的化合物30个,其中,瓜蒌、薤白、半夏分别有10、11和10个化合物分子,薤白和半夏有1个共同化合物分子(Tab 1)。

Tab 1 Active ingredients of Gualou Xiebai Banxia decoction
2.2 瓜蒌薤白半夏汤和动脉粥样硬化共同靶点将上述获得的瓜蒌薤白半夏汤的30个活性成分进行反向寻找得到136个对应靶点,在GeneCards、OMIM、TTD数据库中检索动脉粥样硬化靶点,其中在GeneCards数据库中得到780个靶点,OMIM数据库中得到200个靶点,TTD数据库中得到34个靶点,去重后得到803个靶点。将两者的靶点制作成Venn图后发现其共同靶点为78个,即瓜蒌薤白半夏汤治疗动脉粥样硬化有78个潜在靶点(Fig 1)。

Fig 1 Venn diagram of common targets of Gualou Xiebai
2.3 中药-化合物-靶点-疾病网络图将瓜蒌薤白半夏汤和对应的30个活性化合物分子、78个交集靶点以及动脉粥样硬化导入Cytoscape 3.6.1软件中进行可视化分析(Fig 2)。由Fig 2可见,中药-化合物-靶点-疾病网络图中共有112个节点(1种疾病、3味中药、30个化合物活性分子、78个潜在靶点)。此外,瓜蒌薤白半夏汤的活性成分对应多个靶点,1个靶点也对应多个活性化合物分子,其中槲皮素(MOL000098,Quercetin)、豆甾醇(MOL000449,Stigmasterol)、β-谷甾醇(MOL000358,Beta-sitosterol)、卡文定碱(MOL002670,Cavidine)、黄芩素(MOL002714,Baicalein)分别对应52、16、15、14、12个活性靶点,而靶点PTGS2、PRKACA、ADRB2、PGR、SCN5A分别对应19、11、10、9、7个化合物分子。
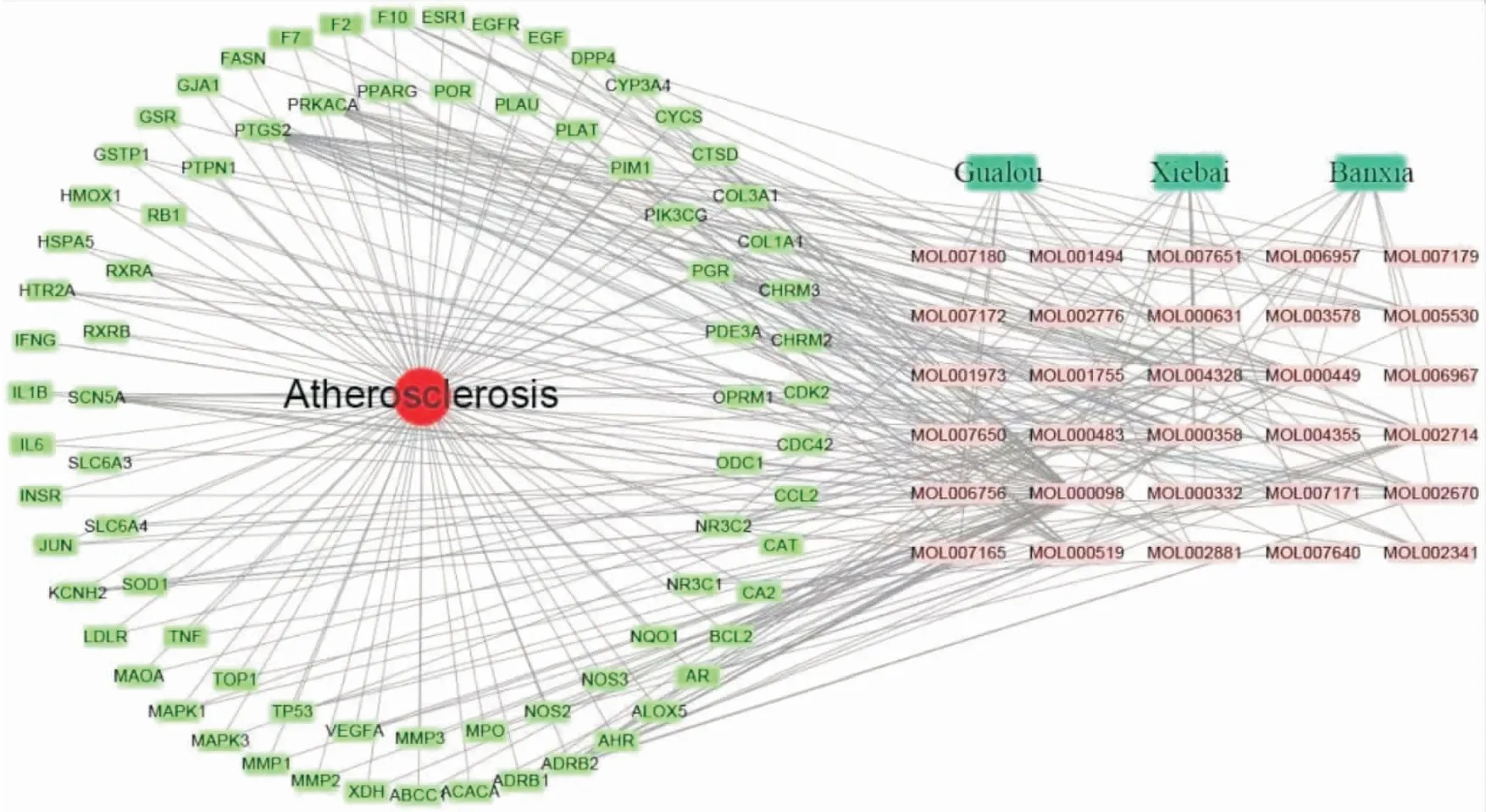
Fig 2 Network diagram of TCM-compound-target-disease
2.4 蛋白相互作用网络将瓜蒌薤白半夏汤和动脉粥样硬化共同靶点制作为蛋白相互作用网络图(protein protein interaction,PPI)(Fig 3),发现IL-6、MAPK3、TP53、TNF、VEGFA、MAPK1的Degree值均在45以上(Degree:IL-6=52、MAPK3=51、TP53=48、TNF-α=47、VEGFA=46、MAPK1=46),且显著高于其他靶点,以上靶点与炎症通路、细胞凋亡和增殖等有密切关系。
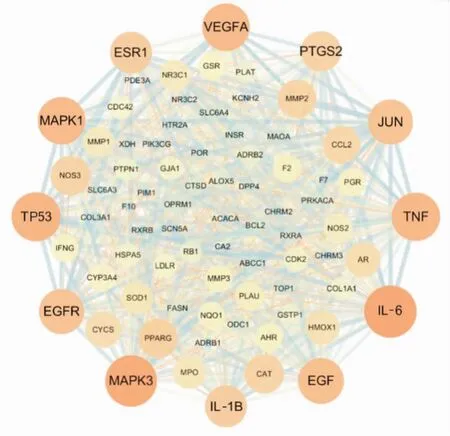
Fig 3 Diagram of protein interaction network
2.5 GO富集分析为进一步探究瓜蒌薤白半夏汤治疗动脉粥样硬化的作用机制,将上述得到的共同靶点在DAVID数据库中进行GO分析,结果共得到GO分析条目417条(P<0.05),其中229条生物过程(BP)条目、49条细胞组成(CC)条目、69条分子功能条目,分别占比54.92%、11.75%、16.55%,各类占比前10的条目如Fig 4所示,BP条目涉及到的有positive regulation of cell proliferation、oxidation-reduction process、apoptotic process等过程。这提示瓜蒌薤白半夏汤治疗动脉粥样硬化的靶点主要与细胞凋亡、细胞增殖、氧化和蛋白结合等有关。

Fig 4 Results of gene function GO enrichment analysis
KEGG通路富集分析得到14条相关信号通路,例如PI3K-Akt、MAPK、TNF等,并涉及IL-6、TNF等炎症因子以及MAPK3、MAPK1等丝裂原活化蛋白激酶,这表明瓜蒌薤白半夏汤治疗动脉粥样硬化可能与抗炎、细胞凋亡等机制有密切关系(Fig 5)。

Fig 5 Results of gene KEGG pathway enrichment analysis
2.6 β-谷甾醇对Ox-LDL诱导的HAEC细胞凋亡的影响由中药-化合物-靶点-疾病网络图(Fig 2)及Tab 1可知,槲皮素、豆甾醇、β-谷甾醇、卡文定碱、黄芩素这几种化合物是瓜蒌薤白半夏汤治疗动脉粥样硬化的主要的潜在活性分子。而上述物质中,槲皮素和黄芩素治疗动脉粥样硬化已有相关报道,豆甾醇、β-谷甾醇、卡文定碱未检索到调控动脉粥样硬化的报道,但有他们在调节脂质代谢、炎症等基础病理方面的相关报道。因此,我们初步选择β-谷甾醇为研究对象来验证我们网络药理实验结果的正确性。Ox-LDL造模浓度实验结果如Fig 6A所示,由Fig 6A可见,HAEC细胞活力在40~100 mg·L-1浓度梯度的Ox-LDL的作用下呈显著下降趋势,其中,在Ox-LDL浓度为40 mg·L-1时,细胞活力较control组明显(P<0.05)降低,且大约为control组细胞活力的50%。因此,后续实验选择浓度为60 mg·L-1的Ox-LDL进行细胞造模。对β-谷甾醇的毒性研究发现,其浓度在0.25,0.5,1,2及4 mg·L-1时,HAEC细胞的活力无显著变化(Fig 6B)。β-谷甾醇的细胞保护实验结果如Fig 6C所示,与control组相比,模型组HAEC细胞活力明显(P<0.01)下降,但浓度为1,2,4 mg·L-1的β-谷甾醇可以明显(P<0.05,0.01,0.01)提高HAEC细胞的活力。利用JC-1荧光染色检测细胞凋亡情况时发现,与control组细胞相比,模型组细胞的红色荧光较强,绿色荧光较弱,而β-谷甾醇可以逆转模型组细胞的上述趋势(Fig 6D)。提示β-谷甾醇可阻止Ox-LDL诱导的细胞凋亡。
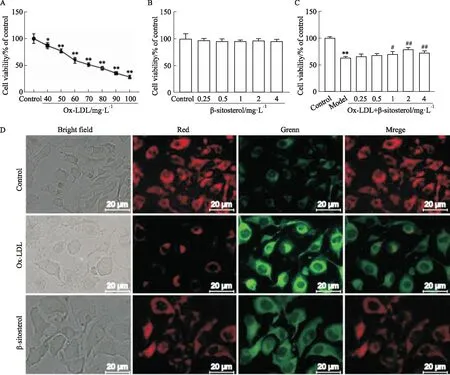
Fig 6 Effect of β-sitosterol on ox-LDL induced apoptosis of
2.7 β-谷甾醇对Ox-LDL诱导的HAEC细胞损伤的抗炎作用从蛋白相互作用网络图(Fig 3)可知,瓜蒌薤白半夏汤治疗动脉粥样硬化的靶点主要涉及IL-6、TNF-α等炎症因子,因此对Ox-LDL诱导的HAEC细胞损伤的炎症因子进行测定。结果发现(Fig 7),与control组相比,模型组细胞中的IL-1β、IL-6和TNF-α的含量明显增高(P<0.01);与模型组相比,β-谷甾醇组细胞中的IL-1β、IL-6和TNF-α的含量明显降低(P<0.05,0.01),这说明β-谷甾醇可对抗Ox-LDL诱导的HAEC细胞损伤而发挥抗炎作用。

Fig 7 Anti-inflammatory effect of β-sitosterol on
2.8 β-谷甾醇对炎症因子及其相关通路的影响对瓜蒌薤白半夏汤治疗动脉粥样硬化的靶点进行富集分析发现其主要涉及炎症通路(Fig 5)。因此利用Western blot法对相关通路蛋白进行探测。结果显示(Fig 8),与control组细胞相比,模型组细胞的p-NF-κB/NF-κB、IL-1β、IL-6、TNF-α表达水平明显增加(P<0.01),但在β-谷甾醇的作用后,HAEC细胞中p-NF-κB/NF-κB、IL-1β、IL-6、TNF-α表达量明显降低(P<0.05,0.01),这提示瓜蒌薤白汤可通过作用于炎症通路治疗动脉粥样硬化。
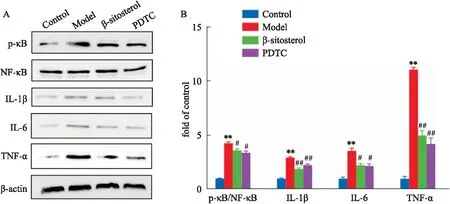
Fig 8 Effects of β -sitosterol on inflammatory factors and NF-κB signaling n=4)
3 讨论
动脉粥样硬化在中医虽无此名,但根据其临床表现,医家将其归于“胸痹、中风”等范畴[12]。对于动脉粥样硬化的病机各路医家众说纷纭,有学者认为毒邪可致脏腑功能紊乱,津液代谢失常,最终形成痰瘀痹阻血脉的病理状态,从而形成动脉粥样硬化。因此祛瘀化痰、清热解毒为治疗动脉粥样硬化的治则之一。瓜蒌薤白半夏汤最早记载于《金匮要略》,是由蒌实、薤白和半夏三味中药组成,方中,瓜蒌清热涤痰、薤白行气导滞、半夏燥湿化痰,三药合用行通阳散结、清热祛痰之效。现代药理学研究亦表明,瓜蒌薤白半夏汤可通过调节脂质代谢、抑制氧化应激、减轻炎症反应等有效延缓动脉粥样硬化的进展[6]。中药成分复杂、作用靶点多,其治疗疾病的确切机制不容易阐明。网络药理学整合了生物学、药理学、计算生物学等相关学科的知识,可从整体角度探讨药物与疾病的相关性,符合中医学整体观与辨证原则,有助于阐明中药发挥药效作用的机制。
从网络药理学角度研究瓜蒌薤白半夏汤主要关注的疾病是冠心病[7,9]、慢性阻塞性肺病[10],以及未经试验验证的瓜蒌薤白半夏汤临床治疗器官定位和药效成分预测[11]等研究。本研究试图从网络药理学角度探究瓜蒌薤白半夏汤治疗动脉粥样硬化的潜在作用机制。
本研究显示,瓜蒌薤白半夏汤治疗动脉粥样硬化有30个活性化合物分子以及78个潜在治疗靶点。张雯等[11]基于网络药理学分析了瓜蒌薤白半夏汤的药效成分并得到了邻苯二甲酸、甲基丁香酚等潜在化合物。本研究发现,β-谷甾醇作为半夏和薤白共有的活性化合物分子,可能是治疗动脉粥样硬化的潜在有效物质,其具有抗氧化、降脂、抗炎等药理作用。大量研究表明,摄入富含β-谷甾醇的食物可降低低密度脂蛋白在血液中的浓度[13]。氧化型低密度脂蛋白是引起动脉粥样硬化的危险因素之一,可诱导血管内皮细胞凋亡,继而导致血管内膜增生、炎症细胞浸润、脂质沉积和斑块破裂。因此抑制Ox-LDL诱导的血管内皮细胞凋亡是治疗动脉粥样硬化的重要手段。本研究中采用Ox-LDL诱导HAEC细胞损伤,发现β-谷甾醇可明显降低Ox-LDL诱导的细胞凋亡。初步证明了β-谷甾醇是瓜蒌薤白半夏汤治疗动脉粥样硬化的药效分子。
动脉粥样硬化与LDL等脂蛋白在动脉内膜沉积,形成局部炎症,炎症招募单核细胞分化为巨噬细胞,巨噬细胞在摄取LDL后死亡、破裂有密切关系。本研究的蛋白网络分析结果显示,IL-6、TNF-α是瓜蒌薤白半夏汤治疗动脉粥样硬化的潜在靶点。IL-6是巨噬细胞和T细胞在炎症早期产生的促炎因子,已有研究[14]显示,抑制IL-6信号传导可降低动脉粥样硬化的发生风险。TNF-α的特异性单克隆抗体和抑制剂也可抑制动脉粥样硬化的发展[15]。本研究发现,β-谷甾醇可明显降低Ox-LDL诱导的IL-6及TNF水平升高。此外,研究发现[16],IL-1β在动脉粥样硬化病变中的表达也明显增高,被认为是临床治疗动脉粥样硬化的潜在靶点,本研究证实了这一点,且β-谷甾醇也可明显降低Ox-LDL诱导的升高的IL-1β水平。以上表明,瓜蒌薤白半夏汤可通过减轻炎症导致的细胞损伤发挥治疗动脉粥样硬化的作用。
通过GO和KEGG分析证实,瓜蒌薤白半夏汤治疗动脉粥样硬化是通过多途径、多方式介导。金宏飞等[7]利用网络药理学探讨瓜蒌薤白半夏汤治疗冠心病的作用机制时发现,其机制主要与血小板活化通路、FoxO信号通路相关。NF-κB信号通路是调节上述炎症因子的重要途径,在动脉粥样硬化的发病机制,炎症和细胞死亡中发挥关键作用。Hajra等[17]研究发现,低密度脂蛋白受体(LDLR)-/-小鼠在长期喂食高脂饲料后,内皮细胞中NF-κB活性显著增加,这导致了其动脉粥样硬化的发生几率增加。韦磊等[18]也证实,在高脂喂养ApoE-/-小鼠后,NF-κB磷酸化水平增加。本研究也发现,Ox-LDL可显著升高p-NF-κB在HAEC细胞中的表达量,但β-谷甾醇可以明显降低其活化水平。这进一步说明瓜蒌薤白半夏汤可通过抗炎作用治疗动脉粥样硬化,其分子机制可能与调控NF-κB信号通路有关。
综上所述,瓜蒌薤白半夏汤可通过多靶点、多途径治疗动脉粥样硬化。本研究结果初步显示,β-谷甾醇是瓜蒌薤白半夏汤治疗动脉粥样硬化的活性药效分子,其分子机制与调节抗炎、细胞凋亡信号通路有关。后续研究将进一步筛选其他潜在化合物以探究瓜蒌薤白半夏汤治疗动脉粥样硬化的其他可能机制。
