肝癌中蛋白质翻译后修饰的研究进展
2022-06-08田雪飞曾普华
柳 卓,田雪飞,曾普华
(1. 湖南省中医药研究院附属医院,湖南 长沙 412000;2. 湖南中医药大学科技处,湖南 长沙 412006)
肝癌是发于肝内胆管上皮细胞或肝细胞的恶性肿瘤,是中国导致死亡的第二大癌症。2020年,全球确诊为肝癌的人超过90万,其中中国人有41万[1]。肝癌具有起病隐匿、恶性度高、进展快、预后差和死亡率高等特点。晚期症状主要表现为肝痛、乏力、消瘦、黄疸、腹水等。肝癌容易在肝内及肝外发生转移,易侵犯门静脉及分支并形成瘤栓,肝外转移分为血行、淋巴道、种植转移等,严重影响患者的生命质量。肝癌早期,采用积极的手术治疗配合介入及静脉化疗,并结合口服索拉菲尼等药物积极予以治疗,患者一般可以带瘤生存。肝癌后期的治疗有外科手术、肝移植、放化疗等联合手段,但其预后较差,容易反复发作,5年生存率仅为12.1%[2-3]。因此,提高肝癌患者的生存率,早治疗、早诊断非常必要。
蛋白质翻译后修饰(protein translational modifications,PTMs)是指通过共价加工1个或几个氨基酸残基加上修饰基团或通过蛋白质水解剪去基团而改变蛋白质的性质[4]。这个过程是采用可逆的状态模式,调节蛋白功能,改变理化性质。目前已发现300多种不同的翻译后修饰,主要形式包括磷酸化、糖基化、乙酰化、泛素化等。在蛋白翻译后修饰方式的鉴定过程中,蛋白会首先被酶切成肽段,然后进入质谱进行分析,通过质谱分析,得到的是一系列肽段的分子质量信息[4]。对于某一个特定肽段而言,在没有发生任何翻译后修饰的情况下,其序列信息和分子量是确定的。因此,可以更直观的了解到PTMs的作用。很多研究表明,PTMs跟肿瘤代谢密切相关,并能调控肿瘤抑制因子与癌蛋白的表达。本文就PTMs的几种形式在肝癌中的作用进行综述,并探索其相关药物开发前景,为肝癌干预诊断提供新的思路。
1 糖基化
蛋白质的糖基化是一种最常见的蛋白翻译后修饰,是在糖基转移酶作用下将糖类转移至蛋白质和蛋白质上特殊的氨基酸残基形成糖苷键的过程。研究表明70%人类蛋白包含一个或多个糖链,1%的人类基因组参与了糖链的合成和修饰[5]。
糖基化主要分为O-糖基化和N-糖基化。蛋白质苏氨酸或丝氨酸的自由OH基与O-糖链共价连接称为O-糖基化,蛋白质天冬氨酸的自由NH2基与N-糖链共价连接称为N-糖基化[6]。研究显示,异常糖基化修饰能影响肿瘤细胞的生长、治疗诊断以及转移侵袭等[6]。异常糖基化修饰在肝癌中常常出现,影响相关蛋白的生物学活性,在增强化疗效果和化疗耐药中发挥重要作用,并能用于诊断标记。除此之外,蛋白质糖基化在肝癌中还表现出如下作用。
1.1 肝癌诊断标记人羧酸酯酶1(carboxylesterase 1,CES1)是一种丝氨酸酯酶,在CES1的N79端含有一个独特的单糖连接糖基,CES1的单链糖基化对肝癌细胞具有抗增殖作用,是肝细胞癌的血清标志物之一[7]。此外,血浆中的纤维蛋白原Aα亚型细胞中O-聚糖糖基化的数量在肝硬化患者中降低,而血浆中纤维蛋白原Bβ和γ-亚基在肝硬化和肝癌患者中均升高,基于此可3 h内判断患者是否患有肝病[8]。
1.2 促进肝癌侵袭O-连接的N-乙酰葡糖胺(O-GlcNAc)在PTMs中发挥调控作用,O-GlcNAc糖基化修饰是在糖基转移酶OGT的催化下以O-糖苷键形式共价连接到蛋白质的丝氨酸或苏氨酸羟基上的单糖修饰[9]。在小分子RNA研究方面,肝癌组织和细胞中表现出miR-424-5p通过负调节O-GlcNAc,抑制原癌基因丝氨酸和苏氨酸蛋白激酶有丝分裂原激活蛋白酶(rapidly accelerated fibrosarcoma 1,RAF1)糖基化,从而促进肿瘤转移[10]。
1.3 肝癌代谢相关Chen等[11]发现铁死亡诱导剂Erastin通过抑制O-GlcNAc糖基化修饰c-Jun来调节肝癌的代谢相关核表达和转录活性,并能进一步抑制人重组AP1(c-Jun)蛋白表达,同时谷胱甘肽(glutathione,GSH)的合成受O-GlcNAc糖基化修饰c-Jun的调控。临床中已发现O-GlcNAc糖基化修饰c-Jun与GSH之间有正相关,GSH参与体内三羧酸循环及糖代谢。所以蛋白糖基化可能与肝癌能量代谢有相关性。
2 磷酸化
蛋白质磷酸化是最重要的一种蛋白PTMs之一。磷酸化是指在蛋白质或中间代谢产物上加磷酸基团的过程。蛋白质磷酸化主要发生在丝氨酸和苏氨酸上,具有参与细胞信号传导及通路调控的重要作用,跟转录调节、信号传导、DNA损伤修复等过程密切相关[12]。Di等[13]发现磷酸化在癌症生长中发挥重要作用:当磷酸化时,癌细胞中的脯氨酸羟化酶(prolyl hydroxylase 2,PHD2)发挥活性,能促进癌细胞在肿瘤的低氧区域的死亡。在肝癌中,蛋白的磷酸化主要发挥以下作用。
2.1 肝癌的诊断标记磷酸化的Aα-纤维蛋白原亚型在肝癌患者中降低,而肝硬化单磷酸化增加,可作为肝癌和肝硬化的诊断依据[8]。在建立肝癌动物模型中通过蛋白质组学分析,从433种蛋白中筛选发现抑癌蛋白组磷酸赖氨酸磷酸组氨酸无机焦磷酸性磷酸酶(phospholysine phosphohistidine inorganic pyrophosphate phosphatase,LHPP),进一步研究发现LHPP的水平出现了下调并能影响肝癌的生长,增加LHPP表达则能够有效抑制癌细胞增殖并阻止肝功能损伤[14]。
2.2 影响肝癌增殖肝癌细胞异常分泌的蛋白激酶Cδ(protein kinase C-delta,PKCδ)能与硫酸乙酰肝素类磷脂酰肌醇蛋白聚糖3结合并可锚定在肝癌细胞表面从而调节肝癌细胞的增殖。更进一步研究发现PKCδ能激活促生长因子(insulin-like growth factors-1,IGF-1)受体(IGF1R),进而增强细胞外调节蛋白激酶(extracellular regulated protein kinases1/2,ERK1/2)的活性,从而加速肝癌细胞的生长,可见,抗PKCδ能减少肝癌细胞的增殖以及肿瘤生长,可应用于肝癌治疗[15]。
3 乙酰化
乙酰化主要被组蛋白脱乙酰酶(histone deacetylase,HDAC)和组蛋白乙酰转移酶(histone acetyltransferase 1,HAT)调控并发生在赖氨酸残基上。乙酰化修饰对各种细胞信号传导、细胞核功能及相关通路调控有调节作用,可以改变关键的代谢酶类的功能,从而促进癌细胞的快速增殖,蛋白被乙酰化后会参与细胞周期阻滞、细胞分化、肿瘤免疫等[16]。很多癌症发生发展过程中,HDAC抑制剂能有选择性的调节相关的因子和抑癌基因的表达,从而发挥较强的抗癌作用[17]。
3.1 致癌作用首先,乙酰化可以影响肝癌细胞的糖代谢关键酶。磷酸甘油激酶1(phosphoglycerate kinase 1,PGK1)是代谢性糖酵解途径中的重要酶,PGK1 K323位点的乙酰化能促进其酶活性和癌细胞代谢,肝癌组织中PGK1明显过表达,PGK1的缺失显著降低了癌细胞的增殖和肿瘤发生[18]。其次,可以通过自噬促发增殖。组蛋白去乙酰化酶HDAC3促进组蛋白H4在赖氨酸16位点的乙酰化,作用于磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)并增强自噬相关的微管相关蛋白1A/1B-轻链 3(MAP1LC3,LC3)和半胱氨酸蛋白酶(autophagy related 4 homolog,ATG4)之间的相互作用,从而触发细胞自噬,影响肝细胞增殖[19]。
3.2 肿瘤的转移蛋白乙酰化参与肿瘤血管生成相关的肿瘤细胞迁移。5号染色体的基因(spermatogenic Zip 1,SPZ1)在肿瘤发生过程中作为原癌基因和人Twist相关蛋白1(TWIST1)的乙酰化形成SPZ1-TWIST1复合物,是癌细胞迁移的必需物。使用人源化单克隆血管生长因子中和抗体如贝伐珠单抗能有效地消除乙酰化SPZ1-TWIST1复合物诱导的诱导上皮-间质转化(epithelial-mesenchymal transition,EMT)和肿瘤发生转移[20]。
3.3 肝癌标志作用组蛋白H3第27位赖氨酸的乙酰化(H3K27ac)是活跃的增强子已知的最佳表观遗传标记物,其转录活性受到多个组蛋白赖氨酸位点乙酰化的协同作用的调控[21]。研究表明,组蛋白乙酰转移酶活性的核受体共激活因子3(nuclear receptor coactivator 3,NCOA3)的富集与HGF处理反应位点的H3K27ac相关:NCOA3通过肝细胞生长因子(human growth factor,HGF)信号级联在转录上调节G蛋白偶联受体溶血磷脂酸受体6(LPAR6),LPAR6与肝癌细胞HGF信号转导之间存在表观遗传联系,因此,LPAR6可作为肝癌治疗干预的生物标志物[22]。
3.4 调节肝癌代谢能量平衡线粒体核糖体蛋白S5(mitochondrial ribosomal protein S5,MRPS5)已被证明在肝癌代谢过程中参与肝癌细胞代谢重编程发挥重要作用。生物信息学分析表明,MRPS5与线粒体复合体I的功能密切相关。进一步的实验证实MRPS5促进了烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的产生,增强肝癌细胞线粒体功能,参与能量调节。乙酰化MRPS5能直接导致糖酵解蛋白的表达增加并促进Warburg效应。而去乙酰化MRPS5定位于线粒体,促进线粒体复合物-I功能和NAD的生成,增强线粒体呼吸,调节癌细胞能量代谢[23]。
4 泛素化
泛素化(包括类泛素化)作为重要的蛋白质翻译后修饰,一直是肿瘤生物学研究的重点和热点。泛素化修饰是一个可逆的酶级联反应,由泛素连接酶和去泛素化酶等精确调控。泛素化过程通常需要3种泛素酶的协同作用,其中E1泛素激活酶与E2泛素偶联酶激活泛素,将其链接到蛋白底物上,而泛素连接酶在靶蛋白的特异性识别及泛素化系统活性的调控中起最重要的作用。泛素连接酶在靶蛋白的特异性识别及泛素化系统活性调节中起着重要的作用[24]。迄今有近600种E3泛素连接酶和100种去泛素化酶被报道。泛素化修饰后能抑制底物泛素-蛋白酶体途径降解,进而参与细胞周期、自噬、天然免疫等多种生理过程的调节。在肝癌中蛋白泛素化还能表现出如下功能。
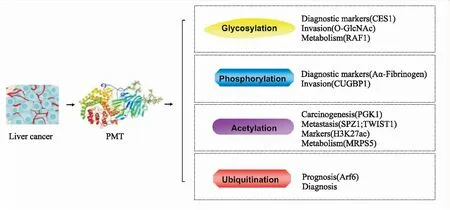
Fig 1 Post translational modification of proteins in liver cancer
4.1 调节肝癌稳定信号Tribbles同源物2(TRIB2)对实体恶性肿瘤和非实体恶性肿瘤都至关重要。肝癌细胞中TRIB2表达上调,TRIB2与E3泛素连接酶发挥作用,从而调节下游效应器的蛋白质稳定性:TRIB2为肝癌特异性Wnt/β-连环蛋白信号转导下游靶点,可见TRIB2蛋白泛素化在肝癌细胞存活和转化中起重要作用[25]。
4.2 肝癌治疗药物敏感相关阿霉素是常用的治疗肝癌的化合物,在最近对其化疗药的敏感性研究中表明沉默信息调节因子6(silent information regulator,SIRT6)能预防阿霉素诱导的细胞死亡。SIRT6使叉形头转录因子的O亚型(FOXO3)上调,同时增加FOXO3泛素化减低其稳定性。从而预防阿霉素诱导的细胞死亡作用[26]。
4.3 调节肝癌预后TCP1复合物的伴侣蛋白(chaperonin containing TCP-1 complex,CCT)亚基3是一种非核蛋白,CCT3能阻断多聚胞嘧啶结合蛋白2的泛素化,从而延长癌蛋白Yes相关蛋白1(Yes-associated protein 1,YAP1)和转录因子CP2(TFCP2)的半衰期。临床上,CCT3与YAP和TFCP2呈正相关,CCT3-YAP-TFCP2轴水平升高可能是调节肝脏恶性肿瘤预后的关键[27]。
4.4 调节肝癌能量平衡在E3连接酶肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)催化下,赖氨酸63型连接多聚泛素化对自噬受体蛋白的后续识别起着重要作用。TRAF6介导的泛素化系统,通过自噬调节糖酵解,为治疗自噬受损肝癌的糖解治疗干预开辟了一条途径[28]。
5 展望
已有大量证据证实,PTMs参与调节肝癌的生长增殖、侵袭转移、药物材料和放射敏感性等。在肝癌的治疗干预及预后均体现其初步价值。现在研究表明,PTMs相关的药物联合使用,安全性较好、靶向性高,但仍然需要更多实验验证。
