基于肠道菌群探讨复方黑骨藤有效成分组对胶原性关节炎大鼠的调节作用
2022-06-08洪文静李晨阳
王 博,张 宏,2,洪文静,李晨阳,陈 健,沈 磊,李 琪,2
(四川师范大学1.生命科学学院、2. 植物功能基因组及生物信息研究中心,四川 成都 610101)
类风湿关节炎(rheumatoid arthritis,RA)是以关节软骨及滑膜为靶器官的自身免疫性疾病,以关节滑膜增生、衬里层增厚以及多种炎性细胞浸润为主要特征,患病率高,可渐进性破坏关节软骨,严重可致残[1]。有一民间经典组方——复方黑骨藤可用于治疗RA,由黑骨藤(PeriplocaforrestiiSchltr.)、秦艽(GentianamacrophyllaPall.)和延胡索(RhizomaCorydalis)按一定比例混合而成,黑骨藤具有祛风除湿、活血消痈的功效[2],秦艽具有祛风湿、清湿热、止痹痛、退虚热之功效,延胡索可活血、行气、止痛[3]。本课题组前期研究[4-6]已确定黑骨藤中的绿原酸类、黄酮类和杠柳毒苷类,秦艽中的环烯醚帖类具有抗炎活性,延胡索中的生物碱类起镇痛作用。基于上述有效组分,分别制得三味药的有效片段,绿原酸类、黄酮类和杠柳毒苷类占黑骨藤有效片段质量比的0.55,环烯醚帖类占秦艽有效片段质量比的0.51,生物碱类分别占延胡索30%乙醇洗脱片段、95%乙醇洗脱片段质量比的0.46、0.54。此外,分别完成黑骨藤、秦艽、延胡索有效片段的最佳抗炎实验,确定出它们各自的最佳剂量,最后根据三味药物的最佳有效成分组配伍为复方黑骨藤有效成分组,并对其进行量效关系考察确立最佳配比[7]。
随着微生态的发展,越来越多的证据表明,肠道微生物的组成和功能变化与RA发病密切相关,肠道菌群起到维护胃肠道屏障、调节机体免疫力的作用,若肠道菌群紊乱,肠道菌群多样性改变,致病菌增加,优势菌群减少,便会影响机体的正常生理功能,导致疾病发生。研究表明使用抗风湿药后可一定程度上改善肠道菌群失衡,菌群结构与炎症程度具有一定的联系[8],肠道菌群改善后可减少相关炎症因子的表达以减轻关节炎病变[9]。
目前,研究复方黑骨藤与其有效成分组对RA的治疗作用多采用生物指标判定和病理组织切片观察等方法,成本高且耗时长,本实验运用16s rRNA高通量测序技术探究CIA大鼠肠道菌群结构,观察复方黑骨藤有效成分组对大鼠肠道菌群的影响,分析差异物种并预测其功能,以新的角度评判其治疗作用与效果,以期提升人们对复方黑骨藤有效成分组与肠道微生物关系的认识。
1 材料与方法
1.1 实验动物SPF级♂SD大鼠30只,体质量(120±10)g,购自成都达硕生物科技有限公司,许可证号为SCXK(川)2015-030。饲养环境温度(25±1)℃,湿度(50%~60%),自然光暗循环,自由摄食饮水。实验前适应性喂养7 d。
1.2 药材及试剂黑骨藤(PeriplocaforrestiiSchltr.)2018年购自西昌药材市场,秦艽(Gentianamacrophyllapall.,批号:20180527)及延胡索(Rhizomacorydalis,批号:20180629)均购自北京同仁堂股份有限公司,经成都中医药大学张艺教授鉴定为合格药材。雷公藤多苷片(批号:20180501,国药准字Z42021212,规格10 mg/片,远大医药黄石飞云制药有限公司),弗氏完全佐剂(Sigma-aldrich,批号:F5881),牛Ⅱ型胶原(上海源叶生物科技有限公司,批号:S12008),乙醇(分析纯,成都市科隆化学品有限公司),生理盐水(四川科伦药业股份有限公司,批号:L218112202);D-101大孔树脂(分析纯,天津市光复精细化工研究所),土壤DNA提取试剂盒(德国QIAGEN公司),Qubit dsDNA Assay Kit(美国Life Technologies公司),TaKaRa Ex Taq(日本TaKaRa公司),TNF-α、IL-6试剂盒(上海邦奕生物科技有限公司,批号:201903)。
1.3 仪器580BR10905 PCR仪(美国Bio-Rad公司),Centrifuge 5418台式高速离心机(德国Eppendorf公司),QIAxtractor(SN 002358,德国QIAGEN公司),生物分析仪(美国Agilent公司),MISEQ测序仪(美国Illumina公司),YRE-201D旋转蒸发仪(予华仪器有限责任公司),Mill-Q去离子水发生器(美国Millipore公司),BP211D型电子天平(德国Sartorius公司),冷冻干燥机(美国VIRTIS公司)。
1.4 药物制备
1.4.1黑骨藤、秦艽和延胡索有效片段的制备 参照实验室前期提取方法[5-6],黑骨藤、50%乙醇按料液比1 ∶20的比例50 ℃超声提取,秦艽、50%乙醇按料液比1 ∶20的比例80 ℃回流提取,延胡索、50%乙醇按料液比1 ∶25的比例75 ℃超声提取,三味药经浓缩后分别上样于D101大孔树脂洗脱,均先弃去水片段,黑骨藤用20%乙醇洗脱并收集,秦艽用10%乙醇洗脱并收集,延胡索依次用30%乙醇、95%乙醇洗脱并收集合并,3种洗脱片段分别经旋转蒸发、冷冻干燥至干粉,即为黑骨藤有效片段(得率4.0%)、秦艽有效片段(得率9.9%)、延胡索有效片段(得率2.5%)。
1.4.2传统复方黑骨藤的制备 将黑骨藤、秦艽和延胡索以2.5 ∶1 ∶1的比例混合均匀,打磨成粉后过筛,与50%乙醇按1 ∶40的料液比80 ℃回流提取,提取液经旋转蒸发、冷冻干燥至干粉,即为传统复方黑骨藤药物(得率25.1 %)。
1.5 造模、分组及给药随机取6只大鼠作为空白对照组(K),其余参照前期方法[7]以牛Ⅱ型胶原乳化液制备CIA大鼠模型,1周后进行二次免疫,随机分为模型组(M)、阳性对照组(Y)、复方黑骨藤有效成分组(G)、传统复方黑骨藤组(C),每组6只。d 21给药,K、M组均灌胃蒸馏水,Y组灌胃雷公藤多苷(40.0 mg·kg-1),G组灌胃复方黑骨藤有效成分组(265.7 mg·kg-1,其中含黑骨藤有效片段84.0 mg·kg-1,秦艽有效片段175.0 mg·kg-1,延胡索有效片段6.7 mg· kg-1,以各有效片段干粉重量计),C组灌胃传统复方黑骨藤(226.3 mg·kg-1,以传统复方黑骨藤药物干粉重量计),其中C、G组剂量为前期实验[7,10]筛选出的最佳剂量。每天灌胃1次,连续28 d。
1.6 指标检测及取样于造模前1 d及造模后d 7、14、21、28、35、42、49测定大鼠体重和足趾厚度,采用五级评分法评定关节炎指数(arthritis index,AI)。镜下观察关节软骨和滑膜的组织形态,分别对关节软骨的细胞状态、潮线状态以及滑膜中炎性细胞浸润、滑膜组织增生等情况进行评分。d 49时,取各组大鼠的盲肠及内容物至冻存管,液氮保存3 h后移至-80 ℃,用于测序分析。无菌环境下取大鼠右腿踝关节,10%甲醛固定,制备组织切片。剔除大鼠右腿的皮肤和肌肉组织后粉碎,生理盐水浸泡1 h,离心取上清,用于免疫组化检测。
1.7 Illumina测序提取样本的基因组DNA并检测其纯度和浓度,取适量样品,用无菌水稀释至1 mg·L-1,以其为模板,使用带Barcode的特异引物,Takara Ex Taq高保真酶进行扩增。PCR产物经检测、纯化后作为模板进行二轮扩增,再经检测纯化后进行Qubit定量,根据其浓度进行等量混样,并上机测序。
使用Vsearch 2.4.2软件对优质序列按照97%的相似度进行OTU聚类,基于分类学信息进行α多样性(Chao1、Goods coverage等物种丰富度统计,Shannon等物种多样性统计,Goods coverage反映样本的低丰度OTU覆盖情况,物种累积曲线和丰度等级图)和β多样性分析[PCoA、NMDS分析,利用R语言(version 3.2.3)进行ANOSIM分析],再采用多级物种差异判别分析(LEfSe)及线性判别分析(LDA)寻找组间差异菌属(LDA>2为差异有统计学意义),最后根据OTU计算出各功能类别的丰度进行功能预测(KEGG)。

2 结果
2.1 体质量、足肿胀度及AI评分结果如Fig 1A、B、C所示,二次致炎后至给药前(d 7~21),与K组相比,造模组大鼠体质量明显降低(P<0.01),足肿胀度和AI评分明显升高(P<0.01),说明造模成功。给药后,各给药组大鼠体质量、足肿胀度及AI评分均有不同程度的恢复。给药21 d后(d 42),与M组相比,Y、G组AI评分明显降低(P<0.01),C组明显降低(P<0.05),且Y、G组与C组差异有统计学意义(P<0.05);给药28 d后(d 49),与M组相比,各给药组足肿胀度和AI评分均明显降低(P<0.01),且G组足肿胀度与K组无明显差异,而Y、C组较K组差异明显(P<0.05)。
2.2 IL-6及TNF-α含量结果如Fig 1D所示,与K组相比,M组IL-6和TNF-α明显增加,差异有显著性(P<0.01);与M组相比Y、G、C组TNF-α和IL-6水平明显减少(P<0.05,P<0.01),差异有统计学意义。Y、G、C组TNF-α和IL-6水平与空白组相比差异无统计学意义。

Fig 1 Effect of different medicines with CIA rats
2.3 病理学指标关节软骨与滑膜病理切片如Fig 1E、F所示,K组大鼠软骨及滑膜组织形态正常。与K组相比,M组大鼠浅层软骨细胞排列紊乱,出现轻微纤维化,滑膜内衬层明显增厚,大量炎性细胞浸润,滑膜衬里下层可见纤维组织大量增生。与M组相比,各给药组均具极明显差异:Y组关节软骨基本完整,部分炎性细胞浸润,局部纤维组织轻度增生;C组关节软骨基本完整,炎性细胞有不同程度的浸润,局部纤维组织轻度增生;G组关节软骨基本完整,少量炎性细胞浸润。
2.4 菌群多样性分析
2.4.1α多样性分析 结果如Tab 1所示,与K组相比,M组Shannon值明显增加(P<0.05),Observed spieces和Chao1值也有所增加,提示CIA大鼠肠道菌群多样性明显增加、菌群总数增多;与M组相比,各给药组所有指数均呈下降趋势,其中,G组Shannon值明显降低(P<0.05),各组Goods coverage值均较高,表明样本中序列没有被测出的概率较低。如Fig 2A、B所示,物种积累曲线趋于平缓,丰度等级图的曲线水平方向较宽,下降趋势较平缓,说明抽样充分且细菌的丰度和均匀度合理。如Fig 2C所示,各组共用OTU数为2 420,与K组相比,M组小鼠肠道细菌OTU增加;较于M组,各给药组OTU均减少。
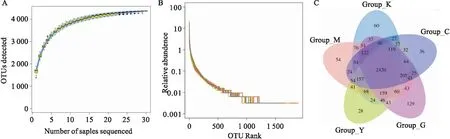
Fig 2 Diversity analysis of gut microbiota in rats
2.4.2β多样性分析 从PCoA分析结果可看出各组菌群整体结构发生不同程度的变化(Fig 3)。NMDS分析结果如Fig 4所示,Stress值均小于0.1,说明降维效果较好,样本点均具有很好的代表性,图中同一组的样本距离较近,且组间样本具有明显距离,说明组内生物重复好,组间具有不同程度差异。ANOSIM分析表明,K-M(R=0.387 0,P=0.006)和M-G(R=0.425 9,P=0.003)的细菌群落结构存在极明显差异,M-Y(R=0.203 7,P=0.040)以及M-C(R=0.361 1,P=0.016)存在明显差异。
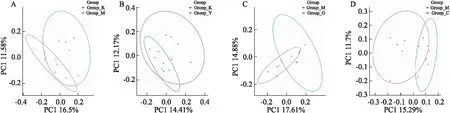
Fig 3 Multiple sample PCoA analysis
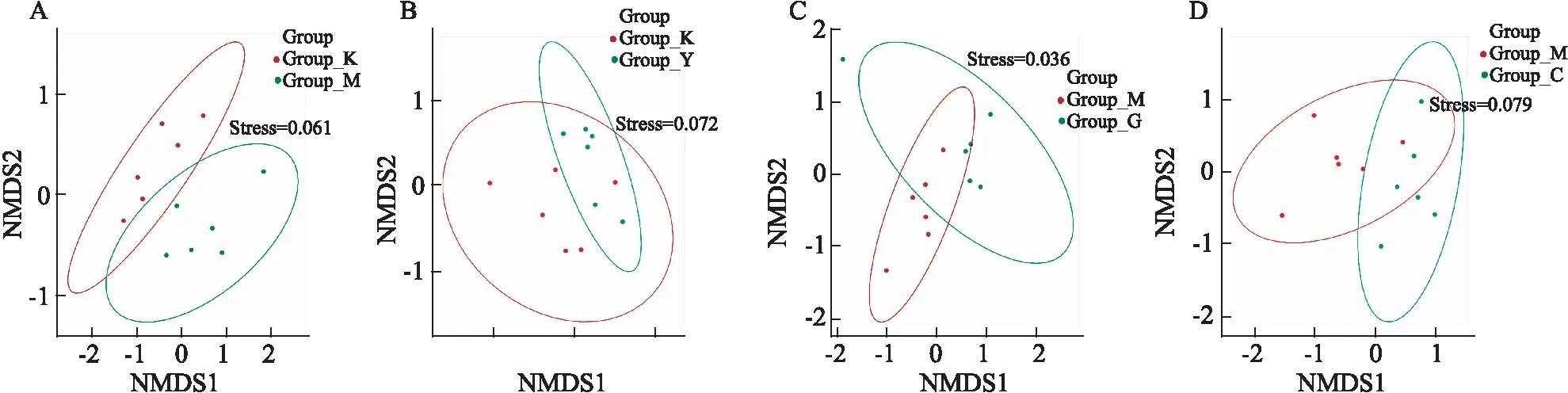
Fig 4 Multiple sample NMDS analysis
2.5 菌群的丰度变化
2.5.1造模对大鼠肠道菌群的影响 门水平上(Fig 5A),主要以拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)为主,与K组相比,M组的拟杆菌门明显减少(P<0.05),厚壁菌门具有增加的趋势,K组厚壁菌门/拟杆菌门(F/B)值为0.62,造模后上升至0.86。属水平上(Fig 5B),与K组相比较,M组拟普雷沃菌属(Alloprevotella)明显减少(P<0.05),普雷沃氏菌属(Prevotella_9、Prevotellaceae_UCG-003)减少,拟杆菌属(Bacteroides)、毛螺菌属(Lachnospiraceae_NK4A136_group)、瘤胃球菌属(Ruminococcaceae_UCG-014、Ruminococcus_1和Rumino-coccaceae_UCG-005)、乳酸杆菌属(Lactobacillus)、颤杆菌属(Oscillibacter)、假节杆菌属(Parasutterella)和理研菌属(Rikenellaceae_RC9_gut_group)有增加的趋势。
2.5.2实验药物对大鼠肠道菌群的影响 门水平上(Fig 5A),与M组相比,Y、G、C组拟杆菌门和厚壁菌门两种菌门均具有恢复趋势,F/B值分别为Y组0.83、G组0.69、C组0.72,G组更接近于K组水平。属水平上(Fig 5B),Y组拟普雷沃菌属、毛螺菌属、颤杆菌属、理研菌属和Prevotella_9增加,拟杆菌属、假节杆菌属、瘤胃球菌属、Prevotellaceae_UCG-003和乳酸杆菌属有减少的趋势;G组拟普雷沃菌属明显增加(P<0.05),与空白组无明显差异,Prevotella_9增加,毛螺菌属、拟杆菌属、假节杆菌属、瘤胃球菌属、Prevotellaceae_UCG-003、乳酸杆菌属、颤杆菌属和理研菌属均有减少的趋势;C组拟普雷沃菌属明显增加(P<0.05),与空白组无明显差异,毛螺菌属和乳酸杆菌属具有增加的趋势,拟杆菌属、假节杆菌属、瘤胃球菌属、Prevotellaceae_UCG-003、Prevotella_9、颤杆菌属和理研菌属均减少。

Fig 5 Relative abundance of bacteria community at phylum (A) and genus (B) levels
2.6 菌群的统计学分析如Fig 6所示,与K组相比,M组杜氏杆菌属(Dubosiella)、mouse_gut_metagenome、Afifella、Negadavirga、Negativibacillus、Clade_la、瘤胃球菌属(Ruminococcaceae_UCG_009)、Pseudarthrobacter明显增加,Staphylococcus、Saccharospirillum、Thalassobaculum明显减少。与M组相比,Y、G、C组Afifella明显减少,G、Y组Negativibacillus明显减少,G组杜氏杆菌属、Negadavirga明显减少,且与K组均无明显差异。

Fig 6 LDA-based distribution histogram of K-M group (A), M-Y group (B), M-G group (C) and M-C group (D)
2.7 菌群功能预测结果发现6条通路具有统计学意义:辅因子和维生素的代谢、硝基甲苯降解、次生代谢产物的生物合成和生物降解、蛋白质的消化和吸收、电子传递载体、细胞凋亡,如Fig 7所示。与K组相比,M组蛋白质的消化和吸收和细胞凋亡通路均明显减少(P<0.05),其余四条通路均明显增加(P<0.05);与M组相比,给药组前五条通路均有不同程度的恢复趋势,在细胞凋亡通路上,Y、C组无明显差异,G组明显增加(P<0.05)。

Fig 7 Prediction of gut microbiota function in rats of five groups
3 结论
本实验结果发现,给药7 d后,与模型组相比,阳性对照组和复方黑骨藤有效成分组AI评分明显降低(P<0.01),传统复方黑骨藤组明显降低(P<0.05);给药28 d后,与模型组相比,各给药组足肿胀度均明显降低(P<0.01),且复方黑骨藤有效成分组与空白组无显著性差异,而阳性对照组和传统复方黑骨藤组与空白组均具有明显差异(P<0.05),表明复方黑骨藤有效成分组可能改善CIA大鼠关节滑膜中炎性细胞浸润,保护和修复其受损的软骨组织,在减轻大鼠足趾肿胀方面效果更明显。从病理切片中可看出,各给药组关节病变情况均有所改善,且复方黑骨藤有效成分组在关节滑膜中炎性细胞浸润和组织增生等方面的治疗作用更加明显。
肠道菌群结构图显示,CIA大鼠的肠道菌群组成结构和丰度与空白组大鼠存在明显差异,拟杆菌门、拟普雷沃菌属、普雷沃氏菌属均具有维持肠道正常生理、促进机体正常发育等功能,其丰度在造模后均明显降低,说明CIA大鼠正常生理被破坏。杜氏杆菌属为肠道炎症相关菌属,造模后其丰度明显增加(P<0.05),表明CIA大鼠肠道失衡。毛螺菌属、乳酸杆菌属、颤杆菌属、理研菌属、假节杆菌属和瘤胃球菌属等有益菌丰度增加可能是由于造模药物激活大鼠机体免疫反应所导致,其中毛螺菌属、颤杆菌属、假节杆菌属产生的短链脂肪酸可抑制关节炎病症[11],乳酸杆菌可提升机体免疫,这些菌属的变化为肠道菌群紊乱引起肠道屏障功能的失调,进而引发炎症性疾病的理论提供实验依据。
给药后,阳性对照组、复方黑骨藤有效成分组和传统复方黑骨藤组分别有9种(拟普雷沃菌属、Afifella、Negativibacillus、Pseudarthrobacter、Prevotella_9、拟杆菌属、假节杆菌属、瘤胃球菌属和乳酸杆菌属)、13种(拟普雷沃菌属、Afifella、Negadavirga、Negativibacillus、杜氏杆菌属、Prevotella_9、拟杆菌属、假节杆菌属、瘤胃球菌属、乳酸杆菌、颤杆菌属、理研菌属和毛螺菌属)、8种(拟普雷沃菌属、Afifella、Pseudarthrobacter、拟杆菌属、假节杆菌属、瘤胃球菌属、颤杆菌属和理研菌属)菌属均具有恢复到空白组的趋势。复方黑骨藤有效成分组拟普雷沃菌属、Afifella、Negadavirga、Negativibacillus和杜氏杆菌属较模型组差异均明显(P<0.05),且与空白组均无明显差异,表明复方黑骨藤有效成分组大鼠肠道恢复正常生理功能。同时,从肠道菌群结构图也可看出复方黑骨藤有效成分组菌群结构较传统复方黑骨藤组更接近于空白组,说明复方黑骨藤有效成分组可通过修复CIA大鼠肠道菌群结构,使其恢复自身免疫,这与抗类风湿药物可使肠道菌群得以部分恢复结果一致[8]。
TNF-α参与软骨破坏等关节炎致病机制,IL-6能促进其释放,进而加重炎症反应。研究表明,TNF-α、IL-6与炎症相关菌属关系密切,普雷沃氏菌属与超敏C反应蛋白和IL-6等炎症标志物呈负相关[12],拟杆菌属与TNF-α和IL-1β等炎症因子呈正相关[13],造模后普雷沃氏菌属丰度减少、拟杆菌属丰度增加,这与CIA大鼠TNF-α和IL-6明显增加(P<0.05)相符,提示这两种菌属均与CIA大鼠炎症的发生有关。复方黑骨藤有效成分组可使CIA大鼠的IL-6和TNF-α明显减少(P<0.05),恢复到正常水平,这与改善肠道菌群可抑制炎症因子表达的结论吻合[9]。
功能预测发现,造模后①辅因子和维生素的代谢、②次级代谢物的合成和分解、③蛋白质的消化和吸收、④电子传递载体丰度明显增加(P<0.05)、⑤细胞凋亡通路丰度明显减少(P<0.05)。给药后,各给药组均有一定的恢复趋势,且复方黑骨藤有效成分组细胞凋亡通路的丰度明显增加(P<0.05)。复方黑骨藤的有效成分之一原花青素对辅因子Fe3+具有极强的还原能力[14];可与前体蛋白或生物活性肽相互作用,对其消化和吸收、代谢及功能产生影响[15];可抑制NAD(P)H氧化酶的活化,影响生物过程中的电子传递作用[16]。上述研究结果提示复方黑骨藤有效成分组对关节炎大鼠病理改变的作用可能与①③④通路有关。复方黑骨藤的有效成分之一绿原酸可抑制B16黑色素瘤细胞中黑色素生成[17],提示复方黑骨藤有效成分组的抗炎药效可能与②通路有关。研究发现秦艽能阻断与凋亡相关的含CARD的斑点样蛋白,还可抑制人RA成纤维滑膜细胞的增殖以减轻RA症状[18],此外,本课题组前期发现,复方黑骨藤有效成分组可激活凋亡因子caspase-3[7],提示复方黑骨藤有效成分组可能影响⑤通路。有关细胞凋亡通路与复方黑骨藤有效成分组的抗炎机制还需做进一步的探究。
综上所述,复方黑骨藤有效成分组可通过减少炎性细胞浸润和组织增生,减轻关节肿胀,以及降低IL-6和TNF-α的水平来发挥抗炎功效,相对于传统复方黑骨藤,其更能修复CIA大鼠紊乱的肠道菌群谱以恢复机体免疫,进一步说明肠道菌群在复方黑骨藤有效成分组对胶原诱导性关节炎大鼠的治疗中发挥作用。功能预测结果发现复方黑骨藤有效成分组可能影响细胞凋亡,提示复方黑骨藤有效成分组可能通过抑制滑膜细胞增殖、促进炎性细胞凋亡来缓解关节炎,为全面阐释其治疗类风湿性关节炎以及其他疾病的作用提供一定参考。
