NBED对铀的促排效果及HK-2细胞损伤的保护作用
2022-06-08周文华尹晶晶黄立群李曙芳李建国
周文华,高 洁,尹晶晶,黄立群,李曙芳,李建国
(1. 山西中医药大学,山西 晋中 030619;2. 中国辐射防护研究院,药物毒理与放射损伤药物山西省重点实验室,中核放射毒理与放射性药物临床前评价重点实验室,山西 太原 030000)
近年来随着核技术的广泛应用,核安全问题受到广泛关注。环境中的铀主要通过吸入、伤口等途径随血液进入全身循环并造成一定的毒性[1]。流行病学和实验室研究发现,铀毒性主要体现在肾脏(36.22%)、骨骼(19.48%)、肝脏(17.58%)、生殖系统(13.90%)、肺(7.24%)、神经系统(5.58%)[2]。肾脏中的铀主要沉积在肾近端小管S3段[3],胞吞进入细胞与磷酸根离子结合形成磷酸铀酰针形结晶,沉淀在细胞质中破坏细胞,造成近端肾小管损伤或坏死[4-5]。而使用促排剂形成稳定可排泄的络合物是治疗铀内污染的唯一实用方法。
放射性核素促排剂研究至今,FDA仅批准Ca/Na-DTPA、普鲁士蓝、碘化钾3种药物可以治疗放射性核素中毒,其余尚在结构优化、药效确证和临床前研究阶段。而目前临床治疗铀内污染的对策为静脉注射1.4%碳酸氢钠直至尿液pH达到8.0~9.05,并持续3 d,但低剂量效果并不明显,临床用量过多极易造成体内酸碱不平衡和电解质紊乱[6]。中国辐射防护研究院设计合成的邻苯二酚类促排剂(FZ-82-4)对钚、铜、铅等具有较好的促排效果[7]。近年来,本研究所为提高药物稳定性、改善水溶性自主设计合成了N1,N2-双(2,3-二羟基-4,6-二磺酸苄基)亚乙基二胺钠盐(N1,N2-bis (2,3-dihydroxy-4,6-disulfonic acid benzyl) ethylenediamine sodium salt , NBED)(FZ-82-4钠盐)。本研究将从动物、细胞水平研究NBED对铀的促排效果,采用铀诱导的人肾近曲小管上皮细胞(HK-2)损伤模型,研究NBED对HK-2急性铀损伤的保护作用,并与目前临床使用的广谱核素促排剂DTPA-CaNa3进行比较。
1 材料与方法
1.1 材料
1.1.1动物 SPF级ICR ♂小鼠48只,体质量(18~22)g(北京维通利华实验动物技术有限公司),质量合格证号:110011200110859381,实验动物许可证号:SCXK(京)2016-0006。实验单位为中国辐射防护研究院药物安全评价中心SPF级动物房。
1.1.2细胞 人肾小管上皮细胞(HK-2),购自BNCC细胞库,用含10%胎牛血清和1%青霉素链霉素溶液的DMEM/F12的完全培养基,培养于37 ℃、5%CO2培养箱中,待细胞融合至80%~90%时,胰酶消化传代并进行后续实验。
1.1.3试剂 NBED由本所合成,相对分子量为712.52。该化合物为黄色粉末,相对纯度大于95%[7]。促排灵注射液(DTPA-CaNa3,批号:20190605)购自军事医学研究院辐射医学研究所;醋酸铀酰[C4H6O6U(H2O)2,批号:U3873101B]购自上海吉至生化科技有限公司;胎牛血清(批号:2138109RP)、DMEM/F12培养基(批号:8121244)购自美国Gibco公司;细胞增殖毒性检测(CCK-8)试剂盒(批号:BJ05203090)、Annexin V-FITC细胞凋亡检测试剂盒(批号:BA01283496)、细胞周期检测试剂盒(批号:BA04278147)购自北京博奥森生物技术有限公司;超氧化物歧化酶(SOD)试剂盒(批号:20201226)、还原型谷胱甘肽(GSH,批号:20210126)测定试剂盒、乳酸脱氢酶(LDH)测试盒(批号:20201124)购自南京建成生物工程研究所;活性氧检测试剂盒(批号:20201212)购自北京索莱宝科技有限公司;硝酸(优级纯,批号:20200911)购自国药集团化学试剂有限公司;H2O2(分析纯,批号:20200531)购自天津欧博凯化工有限公司;超纯水(Milli-Q超纯水处理系统)。
1.1.4仪器 LY26-1FD型超净工作台(上海龙跃仪器设备有限公司),Forma 3111型直热式CO2培养箱、Countess Ⅱ型全自动细胞计数仪、Multiskan GO型全波长酶标仪、5424R高速冷冻离心机(Thermo Fisher);Milli-Q超纯水处理系统(美国Millipore);FC500型流式细胞分析仪(Beckman coulter)。NexION-5000电感耦合等离子体质谱仪(PerkinElmer)。ICP-MS测定主要条件:射频入射功率:1 600 W,雾化气流速:1.03 L·min-1,辅助气流速:1.3 L·min-1,等离子气流速:16.25 L·min-1,重复采集3次,溶液稳定时间50 s。
1.2 方法
1.2.1动物分组及给药 实验动物分为6组:空白对照组、铀染毒组[U(VI)](0.03mg)[8]、铀染毒+DTPA-CaNa3组(300 mg·kg-1)、铀染毒+NBED组(300、150、75 mg·kg-1)。
给药,实验前适应性喂养1周后,d 8开始给药,小鼠尾静脉注射醋酸铀酰后立即灌胃不同剂量NBED,DTPA-CaNa3作为阳性对照;铀染毒组于染铀后灌胃等体积生理盐水;空白对照组小鼠尾静脉注射生理盐水后立即灌胃生理盐水。给药前禁食过夜,给药2 h后给食与饮水。注射螯合剂后24 h脱臼处死小鼠,取两侧肾脏、股骨、脾脏、肝脏和肌肉。80 ℃烘至恒重,研磨均匀后,分别取0.02 g于烧杯中(因肝、脾、肌肉中铀蓄积量较少,所以肝、脾、肌肉作为一组样本处理),加入5 mL硝酸、150 ℃消解澄清后,加入1 mL H2O2继续消解至无色透明,约剩0.5~1.0 mL左右,经稀硝酸稀释后,采用ICP-MS测定各个样本中的铀含量,并转化为μg·g-1干组织。
1.2.2醋酸铀酰诱导HK-2细胞损伤模型 取对数生长期的HK-2细胞,以5×103/孔接种于96孔板中,37 ℃、5% CO2细胞培养箱中培养24 h(融合至50%~60%),去掉培养基。分别加入20、40、80、160、320、640 μmol·L-1的醋酸铀酰作用48 h,以及80 μmol·L-1的醋酸铀酰作用24、48、72 h,弃去培养液,每孔加入含10%的CCK-8培养基100 μL,37 ℃培养箱中孵育1 h,酶标仪450 nm测每孔的吸光度A并计算存活率。细胞存活率/%=(OD测定孔-OD空白孔)/(OD对照孔-OD空白孔)×100%。
1.2.3NBED对铀损伤的HK-2细胞活性影响 取对数生长期的HK-2细胞,以5×103/孔接种于96孔板中,37 ℃、5% CO2细胞培养箱中培养24 h(融合至50%~60%),去掉培养基。实验分为空白对照组、铀(80 μmol·L-1)模型组、80 μmol·L-1铀分别与不同浓度NBED(10、20、40、80、160、320 μmol·L-1)组,各组处理细胞48 h后,采用CCK-8法检测细胞活性。
1.2.4NBED对铀损伤的HK-2细胞形态变化的影响 取对数生长期的HK-2细胞,以5×105/孔接种于6孔板中,37 ℃、5% CO2细胞培养箱中培养24 h。根据“1.2.2”、“1.2.3”结果选用醋酸铀酰、NBED最适宜浓度,后续实验分为空白对照组、铀模型组(80 μmol·L-1)、阳性对照组(80 μmol·L-1U+80 μmol·L-1DTPA-CaNa3)、80 μmol·L-1铀分别与不同浓度NBED(80、40、20 μmol·L-1)组,继续培养48 h后,光镜下观察细胞形态变化并拍照。
1.2.5NBED对HK-2细胞内吞和外排铀的影响 取对数生长期的HK-2细胞,以5×105/孔接种于6孔板中,37 ℃、5% CO2细胞培养箱中培养24 h,实验分组同“1.2.4”。内吞实验:细胞染铀后立即给药后作用48 h;外排实验:除对照组外各组别用80 μmol·L-1铀作用24 h后,弃去培养基,PBS冲洗3次,对照组和铀模型组,加无血清培养基,其余各组加不同浓度含药培养基作用细胞24 h。药物作用结束后,分别收集各组培养上清和细胞,置烧杯中,加入5 mL硝酸、150 ℃消解澄清后,加入1 mL H2O2继续消解至无色透明,约剩0.5~1.0 mL左右,经稀硝酸稀释后,用ICP-MS测样本中铀含量,将测得的各处理组的数值减去空白对照组的本底值,乘以稀释倍数得各样本铀含量。内吞率/%=细胞铀含量/(细胞+培基铀总量),外排率/%=培基铀含量/(细胞+培基铀总量)。
1.2.6检测细胞SOD、GSH、ROS水平和上清LDH活力 收集细胞上清液和细胞,根据LDH活性测定试剂盒说明书在450 nm处检测LDH活性。细胞冰水浴中制备匀浆,按照SOD和GSH说明书检测SOD活力和GSH水平。流式法检测细胞内ROS,弃去细胞上清液。收集细胞加入DCFH-DA使其终浓度为10 μmol·L-1,置细胞培养箱内20 min。用无血清培养液洗涤细胞3次后,采用流式细胞仪在488 nm、525 nm处检测荧光强度即反应细胞内ROS含量。
1.2.7流式细胞仪检测细胞凋亡 各组别药物作用结束后,用不含EDTA的胰酶消化收集5×105个细胞,用预冷的PBS洗涤2次,1 000 r·min-1离心5 min,弃上清,重悬于100 μL binding buffer中,每组分别加入5 μL Annexin V-FITC和PI,37 ℃避光反应15 min后,冰上加400 μL binding buffer,1 h内上流式细胞仪进行检测。
1.2.8流式细胞仪检测细胞周期 各组别药物作用结束后,用不含EDTA的胰酶消化收集细胞,用预冷的PBS洗涤2次,1 000 r·min-1离心5 min,弃上清,重悬于70%乙醇中,-20 ℃固定过夜,检测前离心,弃乙醇,PBS洗涤后加入PI,37 ℃避光反应30 min后,1 h内上流式细胞仪进行检测。

2 结果
2.1 NBED对铀中毒小鼠的促排效果与铀染毒组相比,300、150 mg·kg-1NBED和300 mg·kg-1DTPA-CaNa3可明显降低肾内铀含量,300 mg·kg-1NBED和DTPA-CaNa3可明显降低骨内铀含量(P<0.05)。300 mg·kg-1NBED分别减少肾、骨内44.3%、18.8%的铀含量,而同浓度DTPA-CaNa3则减少16.6%和13.9%的肾、骨内铀含量,见Fig 1。

Fig 1 Efficacy of uranium removal from mice by
2.2 醋酸铀酰对HK-2细胞生长的影响与对照组相比,20、40、80、160、320、640 μmol·L-1的醋酸铀酰作用HK-2细胞48 h,以及80 μmol·L-1的醋酸铀酰作用HK-2细胞24、48、72 h后,细胞活性明显下降(P<0.01),且呈浓度和时间依赖性(Fig 2)。当醋酸铀酰浓度为80 μmol·L-1,作用时间为48 h时,细胞存活率为60.51%左右,本实验选用80 μmol·L-1、48 h作为后续诱导HK-2细胞损伤模型的浓度。

Fig 2 Effect of C4H6O6(H2O)2 on growth of HK-2
2.3 NBED对铀损伤的HK-2细胞活性影响以及形态的变化与铀模型组相比,NBED(40、80 μmol·L-1)处理组提高了细胞存活率(P<0.01),见Fig 3A。因此,选择20、40、80 μmol·L-1作为NBED给药浓度,80 μmol·L-1作为DTPA-CaNa3给药浓度。如Fig 3B所示,与空白对照组比较,铀模型组细胞数目减少、部分细胞碎片以及损伤细胞漂浮于培养基中,部分细胞变成不规则长条形。与铀模型组相比,阳性对照组和40、20 μmol·L-1NBED处理组,细胞损伤在镜下未见明显改善。80 μmol·L-1NBED组细胞数量明显比铀模型组和阳性对照组多,且大部分细胞形态正常,培养基中漂浮的损伤细胞或碎片均减少。
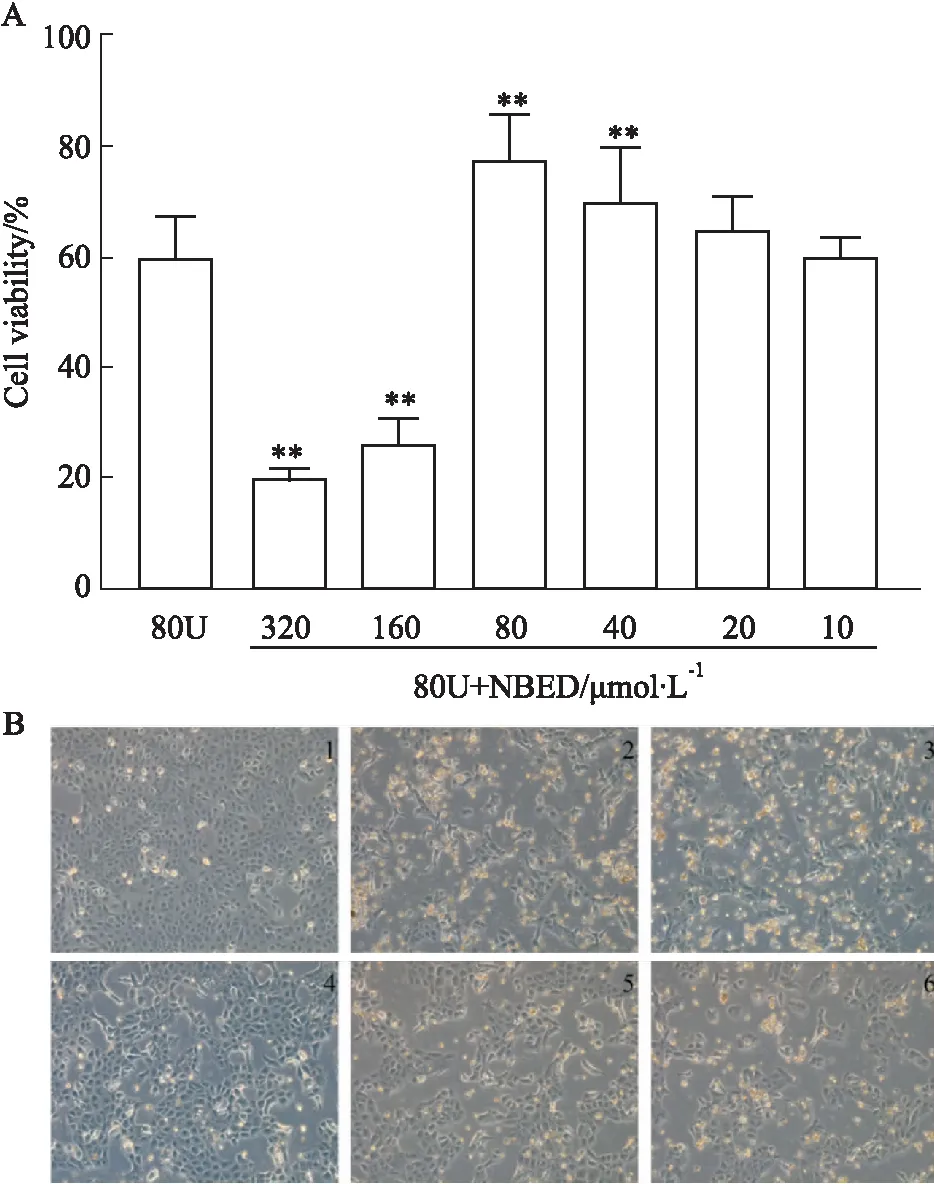
Fig 3 Effect of NBED on activity and morphology of HK-2 cells
2.4 NBED对HK-2细胞内吞和外排铀的影响醋酸铀酰和不同浓度药物作用细胞48 h,由Fig 4A可知,阳性药组和NBED组明显抑制铀内吞(P<0.05)。与铀模型组69%的内吞率相比,阳性药组和80、40、20 μmol·L-1NBED组铀内吞率分别为56%、27%、49%、58%。醋酸铀酰作用细胞24 h后,不同浓度药物作用细胞24 h,由Fig 4B可知,NBED组显著促进铀外排(P<0.01),而阳性药组没有促排效果。与铀模型组12%的外排率相比,80、40、20 μmol·L-1NBED组铀外排率分别为60%、44%、30%。以上结果表明,NBED可以抑制细胞对铀的摄取,并促进细胞内铀的释放。
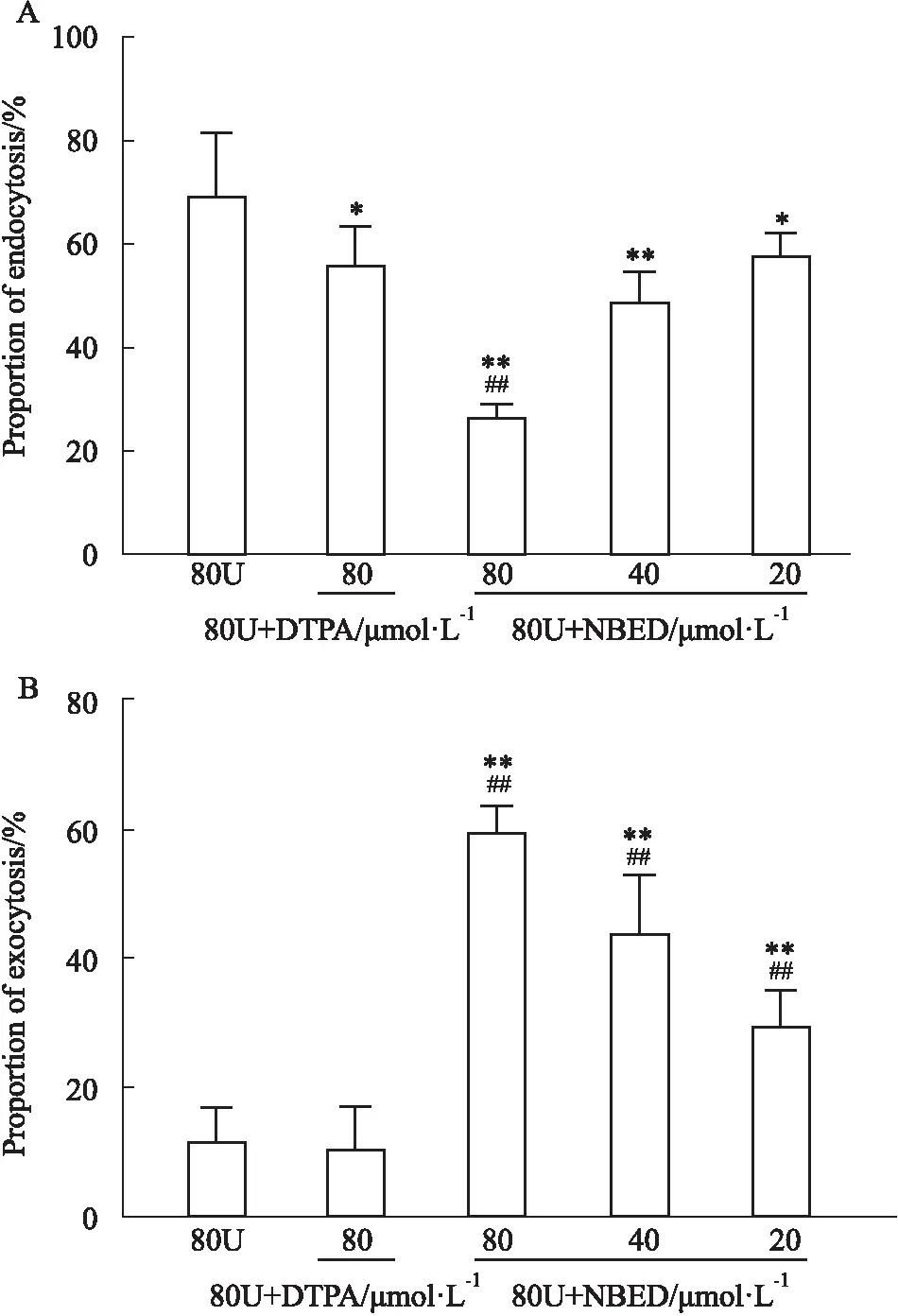
Fig 4 Effect of NBED on endocytosis and exocytosis of
2.5 NBED对细胞SOD、GSH、ROS水平和上清LDH活力的影响由Fig 5可知,与铀模型组相比,80 μmol·L-1NBED组的SOD、GSH释放量明显升高(P<0.01),ROS的表达水平和LDH活力明显下降(P<0.01);阳性对照组的SOD、GSH释放量无明显差异,ROS的表达水平升高(P<0.05),LDH活力明显升高(P<0.01)。与阳性对照组相比,80 μmol·L-1NBED组的SOD、GSH释放量明显升高(P<0.01),ROS的表达水平、LDH活力明显下降(P<0.01);40、20 μmol·L-1NBED组的SOD、GSH释放量升高(P<0.05),ROS的表达水平和LDH活力明显下降(P<0.01)。由此可见,80 μmol·L-1的NBED对铀诱导的细胞损伤具有保护作用,而同浓度阳性药DTPA-CaNa3并没有发挥保护作用,反而加剧了细胞的损伤。
2.6 NBED对铀诱导细胞凋亡的影响与对照组相比,80 μmol·L-1的铀作用HK-2细胞48 h后,有(15.80±0.51)%的细胞发生凋亡。而80 μmol·L-1的DTPA-CaNa3和80、40、20 μmol·L-1的NBED和铀作用48 h后(30.8±1.2)%、(12.6±0.6)%、(21.0±0.7)%、(20.9±0.4)%的细胞发生凋亡。阳性药组凋亡率显著高于铀模型组(P<0.01),80 μmol·L-1NBED组凋亡率明显低于铀模型组和阳性药组(P<0.01)(Fig 6)。由此可见,铀诱导HK-2细胞凋亡,80 μmol·L-1DTPA-CaNa3处理后加剧了细胞的凋亡,80 μmol·L-1NBED明显降低了细胞凋亡率。
2.7 NBED对铀诱导细胞周期的影响各组分别作用HK-2细胞48 h后,流式细胞仪检测结果显示如Fig 7所示,与对照组相比,铀模型组S期细胞比例增加,G0/G1、G2/M期细胞比例下降。40、80 μmol·L-1的NBED可明显降低S期细胞比例(P<0.01),而80 μmol·L-1的DTPA、20 μmol·L-1的NBED与模型组相比差异无显著性。

Fig 7 Effect of NBED on cell cycle of HK-2 n=3)
3 讨论
铀进入机体后会产生肾毒性、肝毒性、骨毒性、肺毒性等,并造成器官损伤、坏死和癌症等一系列疾病,除手术切除治疗外,药物螯合是目前最有效的治疗途径[9]。本所自主设计合成的NBED(FZ-82-4钠盐),前期实验表明对钚、铜、铅等具有良好的促排效果,但未见报道对铀的促排效果。本实验首次在动物水平证实NBED对铀具有较好的促排效果,且效果优于FDA批准用药DTPA-CaNa3。动物水平研究发现,300 mg·kg-1NBED对肾、骨具有较好的促排效果,可显著减少肾、骨内44.3%、18.8%的铀含量,而300 mg·kg-1DTPA-CaNa3则减少16.6%和13.9%的肾、骨内铀含量。
细胞水平采用醋酸铀酰诱导HK-2细胞急性损伤模型,研究发现醋酸铀酰作用HK-2细胞后,20、40和80 μmol·L-1的NBED立刻给药共同作用48 h,分别比模型组减少了11%、20%、42%的铀进入细胞内;20、40和80 μmol·L-1的NBED延迟24 h后给药,分别比模型组增加了18%、32%、48%的排放量。而DTPA-CaNa3仅减少了13%的铀进入细胞,外排无效果。动物、细胞水平促排研究结果显示,NBED对急性铀损伤HK-2细胞具有较好的促排效果,而DTPA-CaNa3仅在细胞外发挥螯合作用,对细胞内的铀无促排效果。这可能与DTPA-CaNa3对铀和钍几乎无效,并且口服DTPA-CaNa3后大量存在于体液或血液中,很少能透过细胞膜进入细胞内发挥作用有关[10-11]。
肾是铀的主要靶器官之一,研究表明,胞吞进入肾近端小管S3段细胞内的铀酰离子,破坏细胞膜结构、抑制LDH来抑制细胞ATP含量和糖异生,并通过消耗细胞内酶类或非酶类抗氧化剂,增加活性氧含量,使细胞发生氧化应激反应[12-13]。并通过诱导凋亡因子Bcl-2、Bid、Bax和caspase家族的表达,引起细胞凋亡级联反应,导致DNA降解和细胞死亡[14]。本研究还发现NBED与醋酸铀酰1 ∶1作用时,对铀诱导的HK-2细胞损伤具有明显的保护作用,可以提高HK-2细胞的存活率,降低细胞膜损伤,降低活性氧产生,增加抗氧化物SOD、GSH含量,减轻细胞凋亡和细胞周期S期的阻滞。而DTPA-CaNa3与醋酸铀酰1 ∶1作用时,加剧了细胞的损伤。NBED属于邻苯二酚类化合物,且有研究报道含有邻苯二酚基团的螯合剂体外抗氧化实验表明具有较高的自由基清除率[15]。而DTPA-CaNa3属于多胺多羧酸类化合物,未见研究报道其具有清除自由基作用,且因其不能透过细胞膜,加之药物本身的细胞毒性使之加剧了细胞的损伤。
综上所述,新型促排剂NBED能明显降低肾、骨内铀含量,对急性铀损伤的HK-2细胞具有一定的保护作用,且优于FDA批准用药DTPA-CaNa3,通过抑制细胞对铀的摄取,并促进细胞内铀的释放,提高细胞存活率,抑制细胞内ROS生成,提高抗氧化物SOD、GSH含量发挥抗氧化作用,并减轻铀诱导细胞损伤后S期的阻滞和凋亡。本研究首次证实NBED对铀中毒具有较好的促排效果,且能清除氧自由基,对铀损伤的HK-2细胞具有保护作用,并为后续的研究提供一定的依据。
